400037 重庆,第三军医大学新桥医院病理科2
2Department of Pathology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400042, China
软骨缺损常导致关节顽固性疼痛、关节畸形、功能障碍等一系列临床症状,给患者带来终身的伤痛,也给社会造成巨大的经济负担[1]。软骨组织主要由软骨细胞、基质及纤维构成,由于缺少血管、神经及淋巴系统等限制了其修复能力,因此,长期以来,一直被认为是最难修复的机体组织。自19世纪早期以来,随着软骨细胞移植技术的发展,软骨组织被修复的可能性和实用性被证实,研究者不断探索着各种策略来修复损伤的软骨组织。尤其是组织工程技术的发展,给人们提供了更多的仿生材料,用于损伤后软骨的修复[2]。Ⅱ型胶原(collagen Ⅱ)可由软骨细胞分泌合成[3],具有亲和性强,能为软骨细胞的生长、增殖、分化及功能发挥近似于体内组织发生发育的细胞外基质作用的特点。作为软骨损伤修复中最好的种子干细胞——骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs),是目前联合组织工程技术,实现联合移植和研究定向分化为机体所需要的特定的组织或细胞研究领域的重点及热点。研究表明collagen Ⅱ在体内和体外均可促进BMSCs向骨细胞方向分化,并可促进骨缺损的愈合[4]。而其对BMSCs的影响少见报道。本实验以collagen Ⅱ作为细胞外基质,以BMSCs为种子细胞,体外研究collagen Ⅱ对BMSCs向软骨细胞方向的分化作用,了解collagen Ⅱ对BMSCs分化为软 骨细胞的影响,以期为collagen Ⅱ作为仿生材料,用于损伤后软骨的修复研究提供实验依据。
1 材料与方法 1.1 实验动物SPF级4周龄SD大鼠50只,由第三军医大学实验动物中心提供。手术过程及处死方式严格遵循国际通用实验动物使用指南及第三军医大学动物实验管理使用规定。
1.2 实验材料 1.2.1 药品与试剂collagen Ⅱ抗体(博奥森,bs-10589R),SOX9抗体(20095)、aggrecan抗体(16492,Santa Cruz),FITC-山羊抗小鼠二抗、CY3山羊抗兔二抗(北京中杉金桥),优质胎牛血清(FBS)、DMEM/F12(Thermo scientific),CCK-8(日本DOJINDO)。
1.2.2 器材低温离心机、多功能酶标仪(美国Thermo scientific),倒置荧光显微镜(日本 Olympus),37 ℃、5% CO2培养箱(美国 Thermo Forma公司)。
1.3 方法 1.3.1 大鼠BMSCs的培养4周龄SD大鼠,以水合氯醛行腹腔注射麻醉,75%酒精消毒后,在无菌条件下剪除大鼠双侧股骨和胫骨,剔除其表面肌肉及软 组织,用10 mL注射器吸取含有10%胎牛血清、100 U/mL 青霉素G、100 mg/mL链霉素的DMEM/F12培养液冲洗骨髓腔,直至骨髓腔发白。将冲洗出来的细胞悬液移至50 mL离心管,离心1 000 r/min,5 min,制成单细胞悬液,以3×105/cm2接种于25 cm2的培养瓶中。在37 ℃、5% C02培养箱内进行培养。24 h后半量换液,以后每2~3天全量换液。换液时弃去未贴壁细胞,待贴壁细胞生长铺满瓶底后,进行传代培养。
1.3.2 大鼠BMSCs的鉴定①成骨分化:取培养第3~5代细胞,接种于预先消毒过的置入载玻片6孔板,在成骨诱导液诱导至第21天按照细胞茜素红钙结节染色试剂盒说明书对样本进行固定、染色及澄清处理,显微镜下观察钙结节染色情况;②成软骨分化:同①方法,在成软骨诱导液诱导至第21天按照阿尔欣蓝染色试剂盒说明书对样本进行固定、染色及澄清处理,显微镜下观察染色情况;③成脂分化:方法同①,在成脂诱导液诱导至第14天按照油红O染色试剂盒说明书对样本进行固定、染色及澄清处理,显微镜下观察染色情况。
1.3.3 collagen Ⅱ对BMSCs活性的检测采用CCK-8法。取对数期生长的BMSCs,0.25%胰酶消化后,台盼蓝染色细胞计数,以4 000/100 μL接种于预先用不同浓度collagen Ⅱ包被的96孔板(NEST)培养。设置空白对照组及25、50、100、200 μg/mL组,每组6个复孔,分别孵育7、14、21 d后取出,每孔加入10 μL CCK-8,孵育2.5 h后,使用多功能读数仪比色 读数,设定波长450 nm,分别测定光密度值[D(450)]。
1.3.4 collagen Ⅱ对BMSCs向软骨细胞分化的mRNA标志物检测采用实时荧光定量PCR(qPCR)法。取对数期生长的BMSCs,0.25%胰酶消化后,台盼蓝染色细胞计数,以3×105/cm2接种于预先用不同浓度collagen Ⅱ包被的6孔板(NEST)培养。设置空白对照组及25、50、100、200 μg/mL组,分别孵育7、14、21 d后取出,以TRIzol提取总RNA,测定RNA浓度,每组500 ng RNA进行逆转录为cDNA,扩增所需序列,取等量产物上样,行定量PCR检测目的基因mRNA表达量的变化,并以GAPDH作为内参。引物序列见表 1。
| 引物名称 | 引物序列 | 片段大小(bp) |
| collagen Ⅱ | 上游5′-CAGCAAGAGCAAGGAGAA-3′ | 133 |
| 下游5′-GGACAGTAGACGGAGGAA-3′ | ||
| SOX9 | 上游5′-ACTCCACCTTCACCTACAT-3′ | 323 |
| 下游5′-ATCTCAGCAATCGTTACCTT-3′ | ||
| aggrecan | 上游5′-TGGATGCCTTGGACACTT-3′ | 197 |
| 下游5′-GACGATGCTGCTCAGATG-3′ | ||
| GAPDH | 上游5′-TTCAACGGCACAGTCAAG-3′ | 116 |
| 下游5′-TACTCAGCACCAGCATCA-3′ |
采用免疫荧光方法。设置阴性对照组、空白对照组及25、50、100、200 μg/mL组,于21 d对不同组别细胞以4%多聚甲醛固定,0.5% Triton透膜,3% BSA封闭后,加入不同一抗4 ℃孵育过夜(阴性对照组不加一抗);漂洗后,以相应荧光标记二抗室温孵育2 h;漂洗后,以DAPI复染细胞核后,在荧光显微镜下观察各蛋白的表达情况。
1.4 统计学分析应用SPSS 17.0统计软件,数据以 ±s表示,多组间比较行单因素方差分析。
2 结果 2.1 BMSCs的培养和鉴定BMSCs贴壁生长,类似成纤维细胞。4 d后呈相对静止状态,之后细胞增殖加速,出现团、簇状细胞群(图 1)。传代后细胞增殖迅速,一般2~3 d可传1代。将BMSCs接种于25、50、100、200 μg/mL浓度collagen Ⅱ诱导液中培养,并分别于7、14、21 d进行分化鉴定,可见成骨诱导液中细胞间致密、呈片状,在集落中央可见明显的黑色团块的钙结节,周围颜色较浅(图 2A);成软骨后阿尔欣蓝染色可见细胞呈蓝色淡染(图 2B);成脂诱导后细胞可出现脂滴,油红O染色呈红色点状(图 2C)。
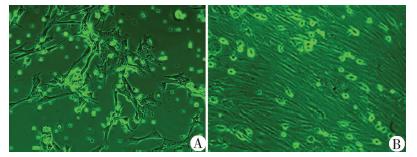 |
| A:BMSCs散在生长,呈长梭形;B:BMSCs呈鱼群样、漩涡状、辐射状或网状排列图 1 倒置相差显微镜下观察所培养的大鼠骨髓间充质干细胞形态 (×100) |
 |
| A:茜素红染色;B:阿尔欣蓝染色;C:油红O染色图 2 不同染色观察大鼠骨髓间充质干细胞分化情况 (倒置相差显微镜 ×200) |
将对数期生长的BMSCs进行分组干预。空白对照组及25、50、100、200 μg/mL组分别在第7、14、21天后,经多功能读数仪比色读数,在450 nm处测定光密度值[D(450)],经统计学比较,差异无统计学意义(P>0.05,图 3)。这提示collagen Ⅱ 作为关节软骨的主要成分,能为BMSCs细胞的生长提供细胞外基质支架条件。
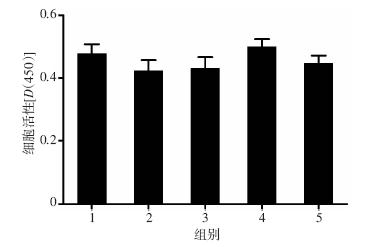 |
| 1:空白对照组;2:25 μg/mL组;3:50 μg/mL组;4:100 μg/mL组;5:200 μg/mL组图 3 CCK-8检测21 d时不同浓度collagen Ⅱ对BMSCs活性的影响 |
不同浓度组处理BMSCs 21 d后,与空白对照组比较,各浓度collagen Ⅱ、SOX9及aggrecan mRNA表达量均升高(P<0.05),以100 μg/mL组最高(P<0.01),在14 d时,各浓度组collagen Ⅱ、SOX9及aggrecan mRNA以100 μg/mL组上调最明显(P<0.05),而在7 d时,各组之间三者mRNA的表达无统计学意义(P>0.05,图 4~6)。
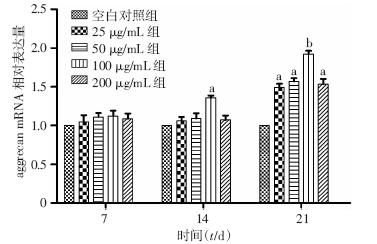 |
| a:P<0.05,b:P<0.01,与空白对照组比较图 4 qPCR检测21 d时不同浓度collagen Ⅱ处理后对BMSCs的aggrecan mRNA表达变化的影响 |
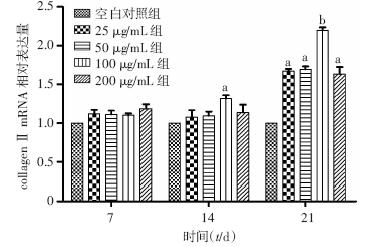 |
| a:P<0.05,b:P<0.01,与空白对照组比较图 5 qPCR检测21 d时不同浓度collagen Ⅱ处理后对BMSCs的collagen Ⅱ mRNA表达变化的影响 |
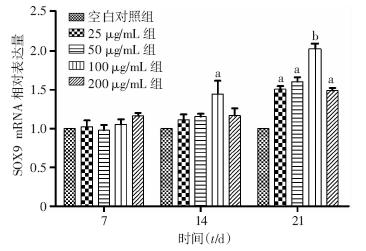 |
| a:P<0.05,b:P<0.01,与空白对照组比较图 6 qPCR检测21 d时不同浓度collagen Ⅱ处理后对BMSCs的SOX9 mRNA表达变化的影响 |
在mRNA表达量的基础上,根据以上qPCR检测结果,设置阴性对照组,空白对照组及25、50、100、200 μg/mL 浓度collagen Ⅱ组处理BMSCs 21 d后,免疫荧光结果显示:100 μg/mL组collagen Ⅱ、SOX9及aggrecan蛋白的表达量较其他各组均明显上调(P<0.05,图 7~9)。
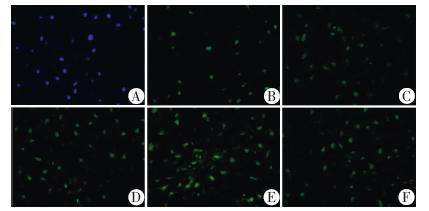 |
| A:阴性对照组;B:空白对照组;C:25 μg/mL组;D:50 μg/mL组;E:100 μg/mL组;F:200 μg/mL组图 7 免疫荧光法检测各组大鼠骨髓间充质干细胞中aggrecan蛋白的表达 (标尺:20 μm) |
 |
| A:阴性对照组;B:空白对照组;C:25 μg/mL组;D:50 μg/mL组;E:100 μg/mL组;F:200 μg/mL组图 8 免疫荧光法检测各组大鼠骨髓间充质干细胞中collagen Ⅱ蛋白的表达 (标尺:20 μm) |
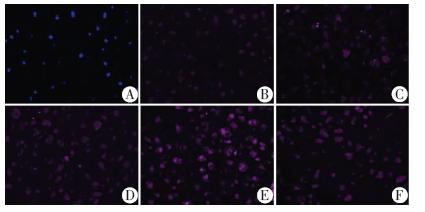 |
| A:阴性对照组;B:空白对照组;C:25 μg/mL组;D:50 μg/mL组;E:100 μg/mL组;F:200 μg/mL组图 9 免疫荧光法检测各组大鼠骨髓间充质干细胞中SOX9蛋白的表达 (标尺:20 μm) |
BMSCs作为成体干细胞的一种,自1987年Friedenstein等[5]发现以来,因其具有良好的向软骨细胞分化的潜能,在关节软骨缺损后修复领域被广泛研究[4, 6, 7]。本实验分离并培养BMSCs,证实所培养的细胞不仅具有良好的增殖能力,并且可功能 性分化为骨、软骨及脂肪细胞,为后续实验奠定了良好的细胞基础。
collagen Ⅱ在体内由软骨细胞分泌合成,并组成软骨组织的主要细胞外基质,为软骨细胞的生存提供了良好的条件[3]。研究表明其作为细胞外支架材料与脂肪来源的干细胞联合移植可促进其向软骨细胞方向分化[8, 9]。本实验以collagen Ⅱ为研究对象,采用CCK-8法检测各不同浓度collagen Ⅱ对BMSCs活性的影响,证实collagen Ⅱ具有良好的生物相容性,实验所设置的不同浓度包被的collagen Ⅱ均可为BMSCs提供良好的生存环境并保持良好的生长状态。
既往研究证明,collagen Ⅱ的局部异常堆积与遗传因素的相互作用可成为类风湿性关节炎的一个诱因[10, 11],因此我们推测collagen Ⅱ作为细胞外基质,在体内浓度的升高或者降低可能对BMSCs产生不同的作用。因此,本实验通过底物对BMSCs向软骨细胞方向分化进行研究,并设置不同浓度组别的collagen Ⅱ进行分析。结果证明:100 μg/mL组软骨标志物mRNA水平(SOX9、aggrecan及collagen Ⅱ)在14 d后均明显升高,通过蛋白水平的检测,也发现相似的趋势,均高于其他组别。此浓度的意义为后续研究该现象的机制提供了良好的浓度范围。
SOX9蛋白直接调控编码collagen Ⅱ的COL2A1基因[12],同时SOX9基因的表达可正性调控aggrecan基因的表达[13],并且是调控细胞向软骨方向分化的重要因子[14]。本实验通过观察不同时间点、不同浓度包被的collagen Ⅱ,证实100 μg/mL组可能通过与之相关的受体正反馈调控了SOX9蛋白的表达,进而引起一系列诱导BMSCs向软骨细胞分化的信号转导机制。而过低或过高浓度的collagen Ⅱ可能不能或负性调节了SOX9蛋白的表达,进而影响了BMSCs向软骨细胞分化。但这些信号转导通路可能受多种信号转导通路的影响,我们将于以后的实验中证实其可能的信号通路和调控方式。
综上所述,BMSCs作为细胞替代疗法的种子细胞与作为软骨细胞外基质的collagen Ⅱ的共同作用,促进了BMSCs向软骨细胞的分化成熟。本研究进一步阐述了collagen Ⅱ诱导BMSCs向软骨分化的较为合适的浓度,但可能在以后的实验中尚需优化。本实验可能为仿生材料的研究提供了一种新的可采用的天然细胞外基质,根据研究结果可能会进一步拓展collagen Ⅱ应用的空间,为软骨损伤的细胞替代疗法联合仿生材料植入提供了新思路。
| [1] | Makris E A, Gomoll A H, Malizos K N, et al. Repair and tissue engineering techniques for articular cartilage[J]. Nat Rev Rheumatol, 2015, 11(1): 21-34. |
| [2] | Stoop R. Smart biomaterials for tissue engineering of cartilage[J]. Injury, 2008, 39( Suppl 1): S77-S87. |
| [3] | Renard E, Poree B, Chadjichristos C, et al. Sox9/Sox6 and Sp1 are involved in the insulin-like growth factor-I-mediated upregulation of human type Ⅱ collagen gene expression in articular chondrocytes[J]. J Mol Med (Berl), 2012, 90(6): 649-666. |
| [4] | Chiu L H, Lai W F, Chang S F, et al. The effect of type Ⅱcollagen on MSC osteogenic differentiation and bone defect repair[J]. Biomaterials, 2014, 35(9): 2680-2691. |
| [5] | Friedenstein A J, Chailakhyan R K, Gerasimov U V. Bone marrow osteogenic stem cells: in vitro cultivation and transplantation in diffusion chambers[J]. Cell Tissue Kinet, 1987, 20(3): 263-272. |
| [6] | Yan J, Zhang C, Zhao Y, et al. Non-viral oligonucleotide antimiR-138 delivery to mesenchymal stem cell sheets and the effect on osteogenesis[J]. Biomaterials, 2014, 35(27): 7734-7749. |
| [7] | Zhang L F, Qi J, Zuo G, et al. Osteoblast-secreted factors promote proliferation and osteogenic differentiation of bone marrow stromal cells via VEGF/heme-oxygenase-1 pathway[J]. PLoS One, 2014, 9(6): e99946. |
| [8] | Choi J S, Kim B S, Kim J D, et al. In vitro cartilage tissue engineering using adipose-derived extracellular matrix scaffolds seeded with adipose-derived stem cells[J]. Tissue Eng Part A, 2012, 18(1/2): 80-92. |
| [9] | Adams J C, Watt F M. Regulation of development and differentiation by the extracellular matrix[J]. Development, 1993, 117(4): 1183-1198. |
| [10] | Wu J, Liu X, Chan C O, et al. Petroleum ether extractive of the hips of Rosa multiflora ameliorates collagen-induced arthritis in rats[J]. J Ethnopharmacol, 2014, 157: 45-54. |
| [11] | Wang Z, Chen Z, Yang S, et al. Berberine ameliorates collagen-induced arthritis in rats associated with anti-inflammatory and anti-angiogenic effects[J]. Inflammation, 2014, 37(5): 1789-1798. |
| [12] | Bell D M, Leung K K, Wheatley S C, et al. SOX9 directly regulates the type-Ⅱ collagen gene[J]. Nat Genet, 1997, 16(2): 174-178. |
| [13] | Sekiya I, Tsuji K, Koopman P, et al. SOX9 enhances aggrecan gene promoter/enhancer activity and is up-regulated by retinoic acid in a cartilage-derived cell line, TC6[J]. J Biol Chem, 2000, 275(15): 10738-10744. |
| [14] | Bi W, Deng J M, Zhang Z, et al. Sox9 is required for cartilage formation[J]. Nat Genet, 1999, 22(1): 85-89. |



