2 610500 成都,成都医学院:检验医学院;
3 610500 成都,成都医学院:基础医学院
2 School of Laboratory Medicine, Chengdu Medical College, Chengdu, Sichuan Province, 610500, China;
3 School of Basic Medical Sciences, Chengdu Medical College, Chengdu, Sichuan Province, 610500, China
帕金森病(Parkinson’s disease,PD)是一种神经系统退行性疾病,其重要病理学标志是胞内出现路易小体(lewy body)。研究表明遗传因素、线粒体功能障碍、氧化应激以及蛋白降解异常等许多因素都可以诱导α-突触核蛋白(α-synuclein)的异常聚集[1, 2],而α-synuclein的异常聚集正是路易小体形成的主要因素[3, 4]。近年来,人们发现自噬溶酶体途径在控制细胞内α-synuclein代谢平衡以及PD的致病过程中均发挥了非常重要的作用[5, 6]。
最近的研究表明在哺乳动物细胞内,存在类似小自噬的内体小自噬途径[7]。这一自噬途径通过热休克蛋白70(heat shock-cognate protein of 70 KDa,Hsc70)识别目标蛋白的LIR结构域(KFERQ),进而将靶蛋白输送入晚期内体(Late endosome)并经内体小自噬途径降解。Hsc70也能够识别α-synuclein,但是内体小自噬途径在α-synuclein的降解过程中发挥了怎样的作用,目前还不清楚。本研究利用慢病毒介导的shRNA技术分别干扰肿瘤易感基因101(tumor susceptibility gene 101,TSG101)和溶酶体相关膜蛋白-2A(lysosome-associated membrane protein type 2A,LAMP-2A)的表达,研究抑制内体小自噬途径和分子伴侣介导的自噬途径(chaperon-mediated autophagy,CMA)对PC12细胞中EGFP-α-synuclein(A53T)蛋白降解的影响,以期为进一步研究PD等神经系统退行性疾病的分子机制提供新的思路。
1 材料与方法 1.1 材料与试剂PC12细胞购自中国科学院典型培养物保藏委员会细胞库。DMEM完全培养基、Opti-MEMI优化培养基和胎牛血清购自Gibco公司。Lipofectamine® 3000转染试剂购自Life公司。质粒提取试剂盒购自OMEGA公司。巴佛洛霉素A1(Bafilomycin A1)购自ENZO公司。BCA蛋白定量试剂盒和Alexa Fluor® 555荧光标记驴抗小鼠IgG购自碧云天生物科技研究所。兔抗LC3B多克隆抗体购自Novus抗体公司,兔抗TSG101单克隆抗体购自上海生工生物工程有限公司,兔抗LAMP-2A多克隆抗体购自BioVision公司,小鼠抗GFP单克隆抗体和兔抗α-synuclein多克隆抗体购自巴傲得公司,小鼠抗β-actin单克隆抗体购自成都正能生物技术有限责任公司。辣根过氧化物酶标记的山羊抗兔IgG和山羊抗小鼠IgG均购自CST公司。PVDF膜和ECL化学发光试剂购自Millipore公司。嘌呤酶素(puromycin)购自北京索莱宝科技有限公司。人源性pEGFP-alphasynuclein-A53T质粒购自Addgene公司[8]。LAMP-2A和TSG101 shRNA慢病毒、对照慢病毒均由上海汉恒生物科技有限公司提供。
1.2 LAMP-2A和TSG101 shRNA慢病毒载体的构建分别根据GenBank中大鼠LAMP-2A和TSG101基因序列,设计与合成3对shRNA 靶序列。其中,正义链5′端引入BamHⅠ酶切位点,反义链5′端引入EcoRⅠ酶切位点。LAMP-2A shRNA1序列:正义链5′-GATCCG CAGTGCCTGACAAGGTGACATACAA TTCAA GAGA TTGTATGTCACCTTGTCAGGCACTG TTTTTTC-3′,反义链5′-AATTGAAAAAA CAGTGCCTGACAAGGTGACATACAA TCTCTTGAA TTGTATGTCACCTTGTCAGGCA-CTG CG-3′;LAMP-2A shRNA2序列:正义链5′-GATC-C GCAGAATGGGAGATGAATTTC TTCAAGAGA GAAATTCATCTCCCATTCTGC TTTTTTC-3′,反义链5′-AATTG-AAAAAA GCAGAATGGGAGATGAATTTC TCTCTTGAA-GAAATTCATCTCCCATTCTGC G-3′;LAMP-2A shRNA3 序列:正义链5′-GATCC GCAGTTGTGGCGATGATAAGA- TTCAAGAGA TCTTATCATCGCCACAACTGC TTTTTTC-3′,反义链5′-AATTGAAAAAA GCAGTTGTGGCGATGATAAGA TCTCTTGAA TCTTATCATCGCCACAACTGC G-3′。TSG101 shRNA1序列:正义链5′-GATCCG CCCGTAAACAGTTCCAGCTAA TTCAAGAGA TTAGCTGGAACTGTTTACGGG TTTTTTC-3′,反义链5′-AATTGAAAAAA CCCGTAAACAGTTCCAGCTAA TCTCTTGAA TTAGCTGGAACTGTTTACGGG CG-3′;TSG101 shRNA2序列:正义链 5′-GATCCG CGTCCGTCAAACTGTCAATGT TTCAAGAG-AACATTGACAGTTTGACGGACG TTTTTTC-3′,反义链5′-AATTGAAAAAA CGTCCGTCAAACTGTCAATGT TCT-CTTGAA ACATTGACAGTTTGACGGACG CG-3′;TSG101 shRNA3序列:正义链5′-GATCCG CCCTGTGCGCTAT-CGAGGTAATATA TTCAAGAGA TATATTACCTCGATAG-CGCACAGGG TTTTTTC-3′,反义链5′-AATTGAAAAAA CCCTGTGCGCTATCGAGGTAATATA TCTCTTGAA TATATTACCTCGATAGCGCACAGGG CG-3′(下划线处为干扰序列)。将合成的DNA单链退火形成双链,连接到经BamHⅠ、EcoRⅠ双酶切的慢病毒pHBLV-U6-Puro载体中,转化感受态细胞DH5α,Amp+平板筛选阳性重组子并进行测序鉴定。靶序列设计与合成均由上海汉恒生物科技有限公司完成。
1.3 LAMP-2A和TSG101 shRNA慢病毒的包装与滴度测定取对数生长期的293T 细胞,接种于75 cm2细胞培养瓶中,接种量9×106/孔,于37 ℃、5% CO2条件下培养,待细胞密度达80%~90%时,按照汉恒生物LipofiterTM转染试剂说明书操作,将含有重组子的慢病毒载体与病毒包装辅助质粒共感染293T细胞。转染48 h 和72 h后分别两次收集病毒上清,以0.45 μm滤器过滤后,于40 mL超速离心管中,72 000×g、4 ℃离心2 h,500 μL新鲜培养液重悬病毒沉淀,置于-80 ℃保存。分别取部分慢病毒浓缩液,采用梯度稀释法测定并计算病毒滴度。慢病毒的包装与滴度测定均由上海汉恒生物科技有限公司完成。
1.4 慢病毒感染PC12细胞和稳定感染PC12细胞株的筛选取对数生长期的PC12细胞,接种于24孔板中,接种量5×104/孔,于37 ℃、5% CO2培养24 h,待细胞密度达80%~90%时,以病毒液与培养液体积比1 ∶9的比例,加入对照慢病毒、LAMP-2A和TSG101 shRNA慢病毒进行感染,24 h后,更换新鲜培养液并加入2.5 μg/mL 的puromycin筛选阳性细胞。持续筛选2周后,获得各组慢病毒稳定感染PC12细胞株。
1.5 Western blot检测各组慢病毒稳定感染PC12细胞中LAMP-2A和TSG101蛋白的表达分别收集对照慢病毒、LAMP-2A和TSG101 shRNA 慢病毒的稳定感染PC12细胞,加入RIPA裂解液冰上裂解30 min,于4 ℃ 14 000×g离心15 min收集裂解上清液,BCA法测定蛋白浓度。SDS-PAGE电泳,每组上样60 μg/泳道,PVDF膜湿转60~80 min,分别加兔抗LAMP-2A抗体(1 ∶1 000)、兔抗TSG101抗体(1 ∶1 000)及小鼠抗β-actin抗体(1 ∶10 000),4 ℃孵 育过夜,TBST洗膜3次,分别加辣根过氧化物酶标记的山羊抗兔IgG(1 ∶2 000)或山 羊抗小鼠IgG(1 ∶2 000),37 ℃ 孵育1 h,TBST洗膜3次,ECL化学发光法检测相关蛋白的表达。
1.6 下调LAMP-2A和TSG101蛋白对PC12细胞中EGFP-α-synuclein(A53T)、EGFP、α-synuclein(A53T)和LC3B蛋白降解的影响分别取对照慢病毒、LAMP-2A shRNA2慢病毒和TSG101 shRNA1慢病毒的稳定感染PC12细胞,接种 于6孔板中,接种量3×105个/孔,当细胞生长至70%融 合时,按照Lipofectamine 3000转染试剂盒说明书进行pEGFP-alphasynuclein-A53T质粒转染,转染量2.5 μg/孔,37 ℃培养4 h后更换新鲜培养液。上述各组转染细胞在37 ℃继续培养36 h后,进行下一步实验。分别进行实验分组:空白对照组(Control组,仅加入D-Hanks 液),Bafilomycin A1实验组(加入终浓度为0.2 μmol/L 的Bafilomycin A1)。药物处理6 h后,胰酶消化、收集各组细胞,加入RIPA裂解液冰上裂解30 min,于 4 ℃、14 000×g离心15 min,收集裂解上清液,BCA法测定蛋白浓度。SDS-PAGE电泳,每组上样60 μg/泳道,PVDF膜湿转60~80 min,分别加兔抗LAMP-2A抗体(1 ∶1 000)、兔抗TSG101抗体(1 ∶1 000)、小鼠抗GFP抗体(1 ∶2 000)、兔抗α-synuclein抗体(1 ∶1 000)、兔抗 LC3B抗体(1 ∶1 000)及小鼠抗β-actin抗体(1 ∶10 000),4 ℃孵育过夜,TBST洗膜3次,分别加辣根过氧化物酶标记的山羊抗兔IgG(1 ∶2 000)或山羊抗小鼠IgG(1 ∶2 000),37 ℃孵育1 h,TBST洗膜3次,ECL化学发光法检测相关蛋白的表达情况。
1.7 免疫荧光技术检测各组PC12细胞中EGFP-α-synuclein(A53T)和LC3B蛋白的表达采用Stefanis等[9]的策略来检测PC12细胞中表达的外源性α-synuclein(A53T)蛋白。由于我们使用的兔抗α-synuclein抗体对PC12细胞中内源性表达的α-synuclein蛋白的亲和力较低,而与pEGFP-alphasynuclein-A53T质粒表达的人源性α-synuclein蛋白的亲和力较高,因此Western blot检测到的α-synuclein条带主要为人源性的α-synuclein(A53T)蛋白。分别取对照慢病毒、LAMP-2A shRNA2慢病毒和TSG101 shRNA1慢病毒的稳定感染PC12细胞,接种于放置了多聚赖氨酸包被圆玻片的24孔板中,接种量5×104/孔,当细胞生长至70%融合时,按照Lipofectamine 3000转染试剂盒说明书进行pEGFP-alphasynuclein-A53T质粒转染,转染量1 μg /孔,37 ℃培养4 h后更换新鲜培养液。继续培养36 h后,进行下一步实验。实验分组同1.6。药物处理6 h后,吸去培养基,PBS洗涤3次,冰甲醇-20 ℃固定15 min,PBS洗涤3次,使用含有羊血清和驴血清的封闭液室温封闭1 h,加兔 抗LC3B抗体(1 ∶200),4 ℃孵育过夜,PBS洗涤3次,再加Alexa Fluor®555荧光标记驴抗小鼠IgG (1 ∶1 000),室温孵育1 h,PBS洗涤3次,封片,利用荧光显微镜观察照相。
1.8 统计学分析运用SPSS 19.0统计软件,组间均数比较采用单因素方差分析。
2 结果 2.1 慢病毒的制备测序结果显示,6条LAMP-2A和TSG101 shRNA慢病毒载体序列与设计的6对shRNA 靶序列完全一致,表明已经成功地构建了针对LAMP2A和TSG101基因的重组慢病毒载体。将含有重组子的慢病毒载体与病毒包装辅助质粒共感染293T细胞后获得重组慢病毒,浓缩后取部分慢病毒浓缩液,采用3倍梯度稀释法测定病毒滴度。经计算得到各组慢病毒滴度均达到2×108PFU/mL,滴度较高,可以用于下一步实验。
2.2 各组慢病毒稳定感染PC12细胞中LAMP-2A和TSG101蛋白的表达LAMP-2A shRNA-2感染PC12细胞中LAMP-2A蛋白表达的抑制效果最好,而TSG101 shRNA-1感染PC12细胞中TSG101蛋白表达的抑制效果最好(图 1)。因此,选择这2组细胞分别作为下调LAMP-2A和TSG101蛋白的细胞模型用于后续实验。
 |
| A:LAMP-2A 1:对照慢病毒; 2:LAMP-2A shRNA-1;3: LAMP-2A shRNA-2; 4: LAMP-2AshRNA-3;B: TSG101 1:对照慢病毒; 2: TSG101 shRNA-1; 3: TSG101 shRNA-2; 4: TSG101 shRNA-3 图 1 Western blot检测各组慢病毒稳定感染PC12细胞中LAMP-2A和TSG101蛋白的表达 |
未加Bafilomycin A1处理的对照慢病毒组细胞(Negative+Control)中的EGFP-α-synuclein(A53T)[E-syn(A53T)]蛋白含量明显较低,与加Bafilomycin A1处理的对照慢病毒组细胞(Negative + Bafilomycin A1)比较差异有统计学意义(P<0.01),表明Bafilomycin A1抑制了细胞中EGFP-α-synuclein(A53T)蛋白的降解。同样,未加Bafilomycin A1处理时,仅下调LAMP-2A或TSG101蛋白也能够抑制细胞中EGFP-α-synuclein(A53T)蛋白的降解(P<0.01)。而加入BafilomycinA1处理后,与Negative组比较,LAMP-2A shRNA-2组、TSG101 shRNA-1组细胞中EGFP-α-synuclein(A53T)蛋白表达差异并无显著性(P>0.05,图 2)。
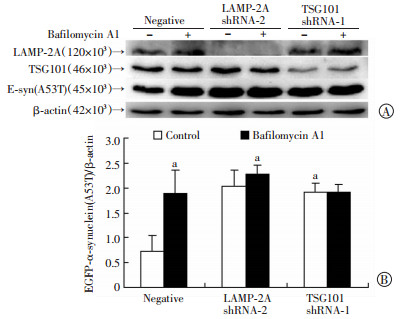 |
| A:Western blot检测;B:半定量分析 a: P<0.01,与Nega-tive+Control比较 图 2 Western blot检测各组细胞中EGFP-α-synuclein(A53T)蛋白的表达 |
Bafilomycin A1处理后,与未加Bafilomycin A1相比,对照慢病毒组细胞中的EGFP蛋白有显著增加(P<0.01),表明Bafilomycin A1处理抑制了细胞中EGFP蛋白的降解。而LAMP-2A shRNA-2组、TSG101 shRNA-1组与Negative组相比,无论是未加Bafilomycin A1,还是加入Bafilomycin A1处理,细胞中的EGFP蛋白都显著增加(P<0.01,图 3),表明下调LAMP-2A或TSG101蛋白同样能够抑制细胞中EGFP蛋白的降解。
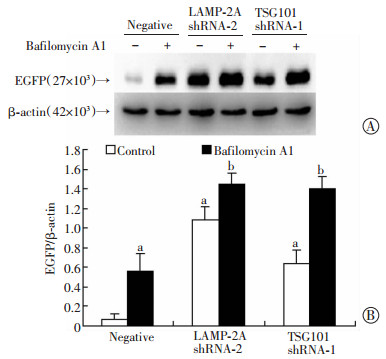 |
| A:Western blot检测;B:半定量分析 a:P<0.01,与 Negative+Control比较;b: P<0.01,与Negative+Bafilomycin A1比较 图 3 Western blot检测各组细胞中EGFP蛋白的表达 |
与EGFP蛋白相似,Bafilomycin A1处理后,与未加Bafilomycin A1相比,对照慢病毒组细胞中的α-synuclein(A53T)蛋白有显著增加(P<0.01)。而LAMP-2A shRNA-2组、TSG101 shRNA-1组与Negative组相比,无论是未加Bafilomycin A1,还是加入Bafilomycin A1处理,细胞中的α-synuclein(A53T)蛋白都有显著增加(P<0.01,图 4)。
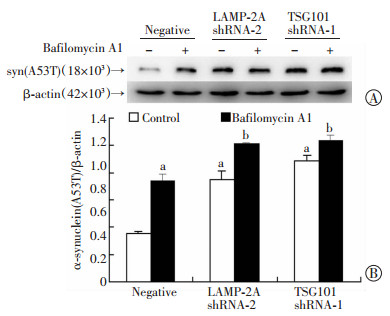 |
| A:Western blot检测;B:半定量分析 a: P<0.01,与 Negative+Control比较; b: P<0.01,与Negative+Bafilomycin A1比较 图 4 Western blot检测各组细胞中α-synuclein(A53T)蛋白的表达 |
Bafilomycin A1处理后,与未加Bafilomycin A1相比,各组细胞中的LC3-Ⅱ/LC3-Ⅰ比值都有显著提高(P<0.01)。未加Bafilomycin A1处理时,LAMP-2A shRNA-2组、TSG101 shRNA-1组与Negative组相比,细胞中的LC3-Ⅱ/LC3-Ⅰ比值也都有显著提高(P<0.01)。而加入Bafilomycin A1处理后,LAMP-2A shRNA-2 组、TSG101 shRNA-1组与Negative组相比,LC3-Ⅱ/LC3-Ⅰ比值差异并无显著性(P>0.05,图 5)。
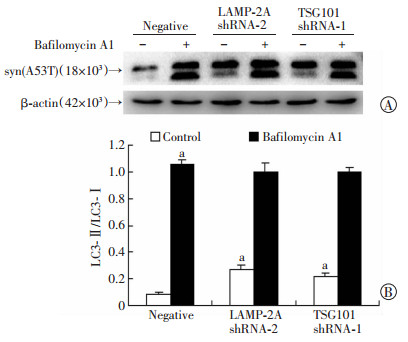 |
| A:Western blot检测;B:半定量分析 a:P<0.01,与 Negative+Control比较 图 5 Western blot检测各组细胞中LC3B蛋白的表达 |
未加Bafilomycin A1处理时(Control),各组细胞形态较为正常,与Negative组细胞相比,LAMP-2A shRNA-2组和TSG101 shRNA-1组细胞内EGFP-α-synuclein(A53T) 聚集体明显增多,LC3B自噬斑点也有增加。加入Bafilomycin A1处理后,各组细胞均发生皱缩,EGFP-α-synuclein(A53T) 聚集体和LC3B自噬斑点也显著增多(图 6)。
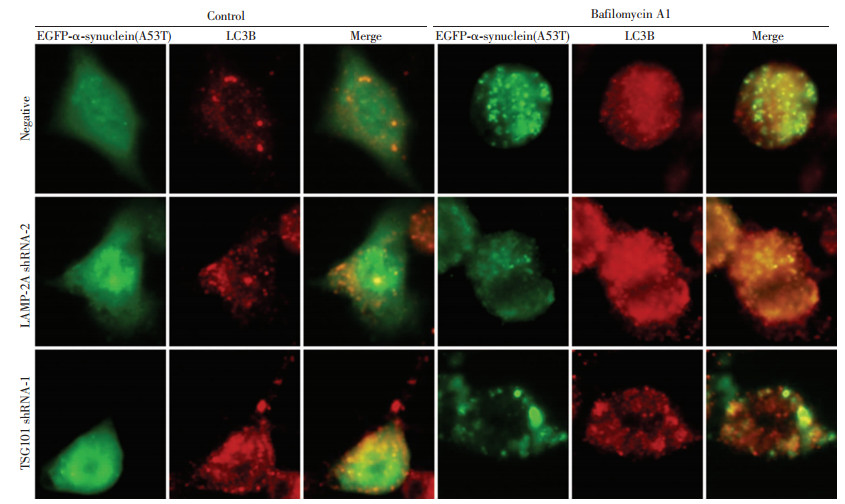 |
| 图 6 荧光显微镜下观察EGFP-α-synuclein(A53T)和LC3B蛋白的表达 (×400) |
近年来的研究表明自噬溶酶体途径在调节细胞内α-synuclein代谢平衡中发挥了非常重要的作用。经典的自噬溶酶体途径可以分为3种类型:大自噬途径(macroautophagy)、小自噬途径(microautophagy)和分子伴侣介导的自噬途径(CMA)[10]。大自噬途径是通过形成脂质双层膜包裹待降解目标蛋白或细胞器,并将其融入溶酶体内降解。已有研究证实ubiquitin-p62信号通路可以特异性的识别不溶性α-synuclein聚集体以及突变型α-synuclein并经大自噬途径降解,从而阻止其对细胞造成的损害[11]。CMA途径依赖分子伴侣对底物的特异识别作用,研究表明热休克蛋白 Hsc70可以识别野生型α-synuclein,然后通过与溶酶体膜蛋白LAMP-2A作用,从而将野生型α-synuclein 导入溶酶体内经CMA途径降解。但是,CMA途径不能降解突变型α-synuclein或α-synuclein聚集体[12, 13, 14]。 小自噬途径是溶酶体直接包裹降解蛋白质或细胞器的自噬方式,尽管小自噬途径已在酵母细胞内得到广泛证实并进行了深入研究[15, 16],然而在哺乳动物细胞内,关于小自噬途径的研究还很少,其在调控α-synuclein代谢中的作用也不清楚。最近的研究表明在哺乳动物细胞内,存在类似小自噬的内体小自噬途径[7]。这一作用同样依赖于Hsc70对目标蛋白的LIR结构域(KFERQ)的识别,进而将靶蛋白输送入晚期内体并经溶酶体降解。那么,α-synuclein是否也能通过内体小自噬途径降解,目前还不清楚。
突变型α-synuclein(A53T)基因是家族遗传性PD的致病基因之一,由于CMA途径对α-synuclein的空间结构有一定限制,α-synuclein(A53T)蛋白被Hsc70识别并结合到溶酶体膜表面后,不能通过CMA途径降解,因此会抑制CMA途径功能,导致其他CMA底物蛋白的聚集,并引起细胞死亡[17, 18]。内体小自噬途径可以通过直接包裹的方式降解底物[7],因此,与CMA途径只能降解野生型α-synuclein不同,我们推测内体小自噬途径也能降解突变型α-synuclein甚至α-synuclein聚集体。在本研究中,我们选择EGFP-α-synuclein(A53T)融合蛋白作为底物蛋白研究内体小自噬途径在降解α-synuclein中的作用。
Bafilomycin A1是空泡型H+-ATP酶的特异性抑制剂,能够破坏溶酶体腔内的低pH环境,从而抑制溶酶体内的蛋白酶活性,并阻断自噬溶酶体的形成,因此对所有类型的自噬都有抑制作用[19]。在本研究中,我们利用Bafilomycin A1处理PC12细胞,结果显著提高了对照病毒组感染细胞中EGFP-α-synuclein(A53T)、EGFP和α-synuclein(A53T)蛋白的含量,表明细胞中EGFP-α-synuclein(A53T)的确主要通过自噬溶酶体途径降解。
溶酶体膜蛋白LAMP-2A是CMA 途径中的关键调节蛋白,抑制LAMP-2A蛋白表达可以特异性地阻断CMA 途径,而不影响大自噬和小自噬等其他自噬途径[20, 21, 22]。我们利用慢病毒介导的shRNA技术干扰溶酶体膜蛋白LAMP-2A的表达,发现阻断CMA途径后,细胞中EGFP-α-synuclein(A53T)、EGFP和α-synuclein(A53T)的含量均有了显著增加,提示阻断CMA途径能够抑制EGFP-α-synuclein(A53T) 的降解。我们推测其原因可能是因为阻断CMA途径能够引起CMA底物蛋白的聚集和代偿性的大自噬降解作用,进而干扰了EGFP-α-synuclein(A53T) 通过大自噬途径的降解过程。
内体小自噬途径需要内体分选复合物(endosomal sorting complexes required for transport,ESCRT)Ⅰ和Ⅲ的参与[7],TSG101是ESCRT Ⅰ的关键调控因子[23],抑制TSG101蛋白表达可以特异性地阻断内体小自噬途径[7, 20]。为了验证内体小自噬途径在EGFP-α-synuclein(A53T)降解中的作用,我们利用慢病毒介导的shRNA技术特异抑制TSG101的表达,结果显示阻断内体小自噬途径能够诱导细胞内EGFP-α-synuclein(A53T) 、EGFP和α-synuclein(A53T)蛋白的聚集,提示内体小自噬途径在细胞内EGFP-α-synuclein(A53T)的降解中可能也发挥了一定的作用,但是这一结果也有可能是因为阻断内体小自噬途径,引起其底物蛋白的聚集和大自噬功能紊乱所导致,还需要进一步的实验来证实。
本研究结果表明:下调LAMP-2A和TSG101蛋白都能够引起细胞内LC3-Ⅱ蛋白的表达增加。LC3-Ⅱ是衡量大自噬水平的一个重要因子[24],但是细胞内LC3-Ⅱ蛋白的表达增加,既可能是大自噬途径被激活引起,也有可能是自噬体与溶酶体的融合受阻而积聚产生。已有研究认为下调LAMP-2A引起的LC3-Ⅱ蛋白增加,是由于大自噬代偿性升高所导致的[13, 20]。因此,我们推测下调TSG101,抑制内体小自噬途径后,也会引起大自噬水平的代偿性升高。
综上所述,本研究结果提示:除了大自噬途径,内体小自噬途径也可能参与了细胞内α-synuclein(A53T)蛋白的降解过程,但是其具体机制还不清楚。而进一步研究内体小自噬途径在降解突变α-synuclein以及清除α-synuclein异常聚集中的作用,将为深入阐释PD的发生机制提供新的思路。
| [1] | Xie W, Wan O W, Chung K K. New insights into the role of mitochondrial dysfunction and protein aggregation in Parkinson’s disease[J]. Biochim Biophys Acta, 2010, 1802(11): 935-941. |
| [2] | Mammucari C, Rizzuto R. Signaling pathways in mitochondrial dysfunction and aging[J]. Mech Ageing Dev, 2010, 131(7/8): 536-543. |
| [3] | Recasens A, Dehay B. Alpha-synuclein spreading in Parkinson's disease[J]. Front Neuroanat, 2014, 8: 159. |
| [4] | McNaught K S, Olanow C W. Proteolytic stress: a unifying concept for the etiopathogenesis of Parkinson’s disease[J]. Ann Neurol, 2003, 53(Suppl 3): S73-S84. |
| [5] | Martinez-Vicente M, Cuervo A M. Autophagy and neurodegeneration: when the cleaning crew goes on strike[J]. Lancet Neurol, 2007, 6(4): 352-361. |
| [6] | Rubinsztein D C. The roles of intracellular protein-degradation pathways in neurodegeneration[J]. Nature, 2006, 443(7113): 780-786. |
| [7] | Sahu R, Kaushik S, Clement C C, et al. Microautophagy of cytosolic proteins by late endosomes[J]. Dev Cell, 2011, 20(1): 131-139. |
| [8] | Furlong R A, Narain Y, Rankin J, et al. Alpha-synuclein overexpression promotes aggregation of mutant huntingtin[J]. Biochem J, 2000, 346(Pt 3): 577-581. |
| [9] | Stefanis L, Larsen K E, Rideout H J, et al. Expression of A53T mutant but not wild-type alpha-synuclein in PC12 cells induces alterations of the ubiquitin-dependent degradation system, loss of dopamine release, and autophagic cell death[J]. J Neurosci, 2001, 21(24): 9549-9560. |
| [10] | 韩起, 陈莎, 杨明珍, 等. 溶酶体相关膜蛋白2A shRNA对乳腺癌细胞株紫杉醇耐药的影响[J]. 细胞与分子免疫学杂志, 2014, 30(4): 351-354. |
| [11] | Martinez-Vicente M. Multiple ways for a-synuclein degradation[J]. Mov Disord, 2012, 27(3): 345. |
| [12] | CuervoA M, Wong E. Chaperone-mediated autophagy: roles in disease and aging[J]. Cell Res, 2014, 24(1): 92-104. |
| [13] | Cuervo A M, Stefanis L, Fredenburg R, et al. Impaired degradation of mutant alpha-synuclein by chaperone-mediated autophagy[J]. Science, 2004, 305(5688): 1292-1295. |
| [14] | Kaushik S, Cuervo A M. Chaperone-mediated autophagy: a unique way to enter the lysosome world[J]. Trends Cell Biol, 2012, 22(8): 407-417. |
| [15] | Kissova I, Salin B, Schaeffer J, et al. Selective and non-selective autophagic degradation of mitochondria in yeast[J]. Autophagy, 2007, 3(4): 329-336. |
| [16] | Farre J C, Krick R, Subramani S, et al. Turnover of organelles by autophagy in yeast[J]. Curr Opin Cell Biol, 2009, 21(4): 522-530. |
| [17] | Bourdenx M, Bezard E, Dehay B. Lysosomes and α-synuclein form a dangerous duet leading to neuronal cell death[J]. Front Neuroanat, 2014, 8: 83. |
| [18] | Yang Q, She H, Gearing M, et al. Regulation of neuronal survival factor MEF2D by chaperone-mediated autophagy[J]. Science, 2009, 323(5910): 124-127. |
| [19] | Shacka J J, Klocke B J, Roth K A. Autophagy, bafilomycin and cell death: the “a-B-cs” of plecomacrolide-induced neuroprotection[J]. Autophagy, 2006, 2(3): 228-230. |
| [20] | Klionsky D J, Abdalla F C, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring auto-phagy[J]. Autophagy, 2012, 8(4): 445-544. |
| [21] | Massey A C, Kaushik S, Sovak G, et al. Consequences of the selective blockage of chaperone-mediated autophagy[J]. Proc Natl Acad Sci U S A, 2006, 103(15): 5805-5810. |
| [22] | Kaushik S, Cuervo A M. Methods to monitor chaperone-mediated autophagy[J]. Methods Enzymol, 2009, 452: 297-324. |
| [23] | Falguieres T, Luyet P P, Bissig C, et al. In vitro budding of intralumenal vesicles into late endosomes is regulated by Alix and Tsg101[J]. Mol Biol Cell, 2008, 19(11): 4942-4955. |
| [24] | 李霞, 黄文娟, 朱素菲, 等. 雷帕霉素诱导细胞自噬促进乙型肝炎病毒的复制[J]. 第三军医大学学报, 2014, 36(12): 1233-1236. |



