2. 401331 重庆, 重庆医科大学附属大学城医院神经内科
2. Department of Neurology,Affiliated University City Hospital of Chongqing Medical University,Chongqing,401331,China
阿尔茨海默病 (Alzheimer’s disease,AD)作为痴呆最常见的原因,主要临床表现为持续进行性认知功能障碍;特征性病理改变为细胞外老年斑 (senile plaques,SP) 沉积、细胞内神经原纤维缠结和神经元丧失等。目前对该病的发病机制尚不完全清楚。β淀粉样蛋白 (amyloid beta peptide,Aβ) 级联代谢学说认为,脑内Aβ过度形成和老年斑沉积启动了AD的发病过程并起关键作用[1],因此减少不溶性Aβ的产生成为研究和治疗AD的靶点。
既往研究发现,内源性硫化氢 (hydrogen sulfide,H2S) 降低可能通过多种途径参与AD的发生、发展,补充外源性H2S可以改善痴呆小鼠认知功能[2]。本课题组近期研究发现,作为中枢神经系统内重要H2S合成酶的胱硫醚-β-合酶 (cystathionine-β-synthase,CBS) 在9、12月龄APP/PS1小鼠脑组织内表达明显减少,且与H2S含量降低呈正相关[3],但是不明确CBS过表达后H2S含量、Aβ代谢及小鼠认知功能等变化。因此,本实验通过建立APP/PS1转基因小鼠脑组织内CBS过表达模型,观察内源性H2S含量、Aβ水平及小鼠认知功能等变化。
1 材料与方法 1.1 主要试剂和仪器兔抗多克隆CBS抗体(ab135626,Abcam),兔抗多克隆Aβ1-42抗体(bs-0107R,北京博奥森),生物素标记羊抗兔IgG(SA00004-2,武汉三鹰),免疫组化染色试剂盒(SP-9001,中杉金桥),离子计(PXSJ-226,雷磁),BCA蛋白浓度测定试剂盒(P0010,碧云天);CBS高表达慢病毒颗粒由上海吉凯公司包装合成;小鼠脑立体定位仪、Morris水迷宫及分析软件等设备由重庆医科大学实验室提供。
1.2 动物分组及处理APP/PS1双转基因小鼠(APPswe× PS1E9)由南京大学模式动物研究所提供,另取同窝野生型小鼠作为空白对照。饲养环境宽松,室温及空气湿度恒定,饮食规律,昼夜节律正常。选用12月龄鼠,不分雌雄,体质量25~30 g,分为3组,每组9只。A组:野生型+空载病毒组;B组:转基因型+空载病毒组;C组:转基因+CBS病毒组,注射高效价CBS高表达慢病毒。4周后即进行水迷宫测试及后续实验。
1.3 慢病毒载体注射6%水合氯醛(0.6 mL/100 g)腹腔麻醉后,将小鼠固定于脑立体定位仪,头顶部常规备皮、消毒,暴露前囟部位。按小鼠脑立体定位图谱进行定位,确定前后囟在同一水平线后,以前囟为零点,将2 μL CBS过表达慢病毒或空载病毒以0.50 μL/min的速度注入海马(AP-2.3,ML-2.0,DV-1.7),留针约5 min后缓慢拔针,缝合消毒,待其苏醒。术后注意保温。
1.4 水迷宫实验实验过程中保持环境安静,空间参照物品位置不变,以排除外界干扰。整个实验共计6 d,分别为连续5 d的定位航行实验和第6天的空间搜索实验。
定位航行实验:小鼠每天训练4次,每次从不同象限入水,每次训练间隔1 h。记录小鼠寻找平台所需时间(逃避潜伏期)。若小鼠没有在90 s内找到平台,按90 s计算逃避潜伏期。空间搜索实验:第6天撤去平台,选择离平台最远的象限入水,记录小鼠在90 s内穿越平台所在位置的次数。
1.5 免疫组织化学染色取海马组织石蜡包埋,冠状位连续切片,按S-P三步法进行标本染色,检测CBS、Aβ1-42 。具体步骤按免疫组化试剂盒说明书进行:将切片放入60 ℃恒温烤箱中60 min。二甲苯脱蜡,梯度酒精复水;微波法修复抗原并自然冷却至室温;滴加3% H2O2去离子水,室温5~10 min;滴加山羊血清(勿洗),室温10~15 min;配置适当比例稀释后的一抗,4 ℃孵育过夜(CBS 1 ∶100;Aβ1 ∶150);次日依次加入二抗、辣根酶标记链霉卵白素工作液,37 ℃孵育10~15 min。各步骤间用PBS溶液漂洗5 min×5次。最后DAB显色、复染、脱水、透明、中性树脂封片。染色完毕后,光学显微镜下观察阳性表达并照相。
1.6 敏感硫电极法敏感硫电极法根据H2S的理化特性,通过检测微量S2-浓度,间接换算出组织中内源性H2S的含量。电极在每次使用之前需在去离子水中活化2 h以上;一个样品测定结束,需再次放入去离子水中以保持活化状态。
称取新鲜剥离的海马组织50 mg,加入生理盐水制备成质量分数为10%的组织匀浆;将组织匀浆加入锥形反应瓶(瓶底中央有直径1.0 cm,高度0.8 cm的中央孔),再加入0.5 mL 1 mol/L HCl促使组织释放H2S,向中央孔内加入0.5 mL 1 mol/L NaOH 以吸收生成的H2S并转化为S2-;迅速封口后置于37 ℃水浴摇床孵育4 h;取中央孔液体进行测定,利用标准曲线计算出S2- 浓度。剩余组织匀浆根据BCA测定蛋白浓度,组织H2S含量以nmol/mg表示。
1.7 ELISA检测Aβ1-42水平采集新鲜海马组织制备组织匀浆,离心后取上清液备用。实验前需将试剂平衡至室温。
实验严格按照试剂盒说明书进行,具体步骤如下:将标准品及处理后的待测样品按每孔各50 μL依次加入包被微孔板,再分别加入25 μL酶联亲和物,覆膜,37 ℃ 孵育反应60 min后充分弃尽孔内液体,用清洗液冲洗5次,并扣干孔内剩余液体。每孔依序分别加入底 物Ⅰ和Ⅱ各50 μL,室温下避光反应15 min。反应 过后每孔加入终止液50 μL,终止反应。在30 min内使用酶标仪读取光密度值[D(450)]。在标准曲线图上查找出每个待测样本对应的浓度范围,结果以pg/mL 表示。
1.8 统计学处理所有数据用x±s表示,采用SPSS 17.0统计软件进行重复测量数据的方差分析及单因素方差分析。
2 结果 2.1 水迷宫行为学检测 2.1.1 定位航行实验各组小鼠逃避潜伏期见表 1,在定位航行实验训练中,各组小鼠平均逃避潜伏期均呈下降趋势。与A组小鼠相比,B组小鼠潜伏期均延长(P < 0.01);C组和B组相比,在第1、2、3天,潜伏期有所降低,但差异无统计学意义(P>0.05),第4、5、6天潜伏期有统计学差异(P < 0.05,P < 0.01),且第4天差异更为明显(P<0.01)。
| 组别 | 逃避潜伏期(s) | 穿越平台次数 | |||||
| 第1天 | 第2天 | 第3天 | 第4天 | 第5天 | 第6天 | ||
| 野生型+空载病毒组 | 46.33±8.52 | 41.47±5.81 | 35.60±6.43 | 24.38±4.45 | 20.84±4.61 | 17.15±5.58 | 6.67±2.50 |
| 转基因型+空载病毒组 | 56.02±5.73 a | 53.31±5.56 a | 46.56±6.20 a | 41.83±5.55 a | 33.68±5.47 a | 31.53±5.04 a | 2.23±1.56 a |
| 转基因型+CBS病毒组 | 53.56±5.39 | 49.76±4.86 | 43.05±3.45 | 34.39±4.35 c | 28.56±3.80 b | 25.50±3.32 b | 4.56±1.88 b |
| a: P<0.01,与A比较; b: P<0.05,c: P<0.01,与B组比较 | |||||||
撤去平台后各组小鼠在90 s 内穿越平台次数见表 1。与A组小鼠相比,B组小鼠穿越平台次数明显减少(P < 0.01);过表达CBS后,C组小鼠穿越平台次数较B组有所增加(P < 0.05)。
2.2 海马组织中CBS蛋白表达各组小鼠脑组织中均可见CBS蛋白阳性表达,为棕黄色颗粒,主要为分布于神经元胞膜上。与A组相比,B组阳性表达数量明显减少,颜色变浅;C组较B组阳性表达增加,颜色变深(图 1)。
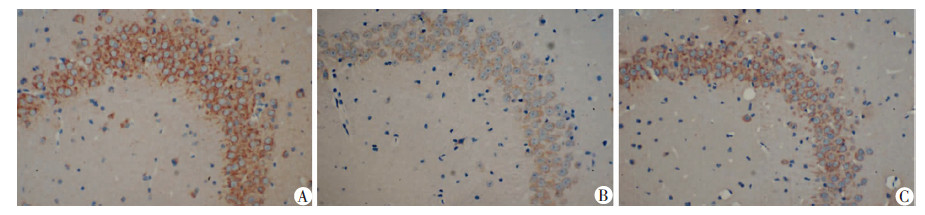 |
| A:野生型+空载病毒组;B:转基因型+空载病毒组;C:转基因型+CBS病毒组 图 1 各组海马组织内CBS蛋白表达比较(S-P ×400) |
经敏感硫电极测定,B组小鼠海马组织内H2S(8.62± 0.75)nmol/mg较A组含量(14.94±1.28)nmol/mg 明显降低(P < 0.01);过表达CBS后,C组小鼠海马组织内H2S(10.52±1.60)nmol/mg较B组含量有所增加,且差异有统计学意义(P < 0.05)。
2.4 各组小鼠海马组织中Aβ1-42含量及老年斑分布情况ELISA检测各组小鼠海马组织内Aβ1-42含量,发现与A组(256.42±73.10)pg/mL相比,B组含量(610.06±82.94)pg/mL明显增多(P < 0.01);过表达CBS后,C组Aβ1-42含量(481.09± 96.15)pg/mL较B组明显减少(P < 0.01)。在光镜下观察,Aβ1-42沉积形成的老年斑呈菊花状斑块,周边为退变神经轴突,中央颜色较深,为淀粉样物质(图 2)。在A组海马组织中几乎没有看到明显的斑块形成;B组和C组海马中均可见阳性表达;与B组相比,C组淀粉样斑块直径变小,数量减少。
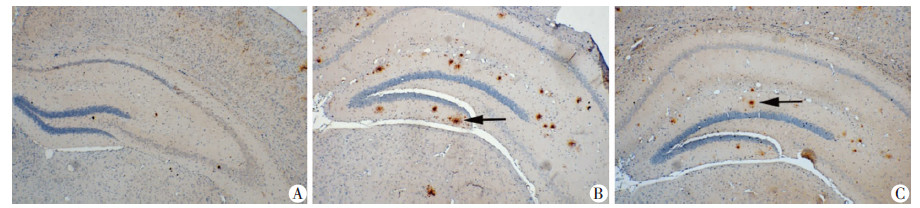 |
| A:野生型+空载病毒组;B:转基因型+空载病毒组;C:转基因型+CBS病毒组 ↑:示老年斑 图 2 各组海马组织内老年斑分布情况(S-P ×40) |
目前,AD的病因及发病机制尚不清楚,治疗也缺乏针对性。Aβ被认为在AD的发病中起关键作用[4]。Aβ由APP经β位淀粉样前体蛋白裂解酶-1(β-site APP cleaving enzyme-1,BACE-1)和γ分泌酶(γ-secretase)酶切产生[5]。当Aβ在脑内异常沉积时,可引发炎症、氧化应激、神经元丧失,并引起Tau蛋白异常磷酸化、轴突损伤、突触丢失最终导致患者失智和失认[6]。因此,减少Aβ的生成可能是治疗AD的途径 之一。H2S作为第3种内源性气体信号分子,在哺乳动物体内发挥重要生理作用。体内的H2S主要由3种 酶合成,分别是CBS、胱硫醚-γ-合酶(cystathionine-γ-lyase,CSE)和3-巯基丙酮酸硫基转移酶(3-mercaptopyruvate sulfur transferase,3MST),其中,CBS和3MST主要在中枢神经系统表达[7, 8]。
1996年日本学者首次发现H2S在中枢神经系统内可以选择性地提高N-甲基-D-天门冬氨酸(N-methyl-D-aspartate,NMDA)受体介导作用并有助于促进海马长时程增强、参与学习记忆调节[9];另有报道指出,与健康成年人相比,AD患者脑组织中H2S水平明显降低[10, 11]。这些研究提示,脑组织中H2S含量减少可能与AD发生具有一定的联系。
本课题组前期研究发现,AD患者血浆内H2S含量较健康人明显降低,且与疾病严重程度呈负相关[12];随后,我们在APP/PS1转基因小鼠脑组织中同样发现H2S水平降低的现象,当外源性补充NaHS后,小鼠认知功能可得到一定改善;之后我们进一步研究发现,NaHS可以通过PI3K/AKT通路降低BACE-1、PS1的mRNA及蛋白表达水平,使APP的代谢向非淀粉样物质途径进行转换,从而减少Aβ产生[3, 13]。
既往研究发现,在AD模型鼠脑组织内Aβ异常沉积所诱导的炎症介质释放可以引起CBS的下调并最终导致H2S合成下降[14]。本课题组前期实验亦证实,CBS在APP/PS1转基因小鼠脑组织内的表达随年龄的增长逐渐下降,而H2S水平的降低呈现相同趋势。我们推测,作为中枢神经系统内重要的H2S合成酶,CBS在脑组织中的表达失调影响了H2S合成,最终通过多种途径参与AD的发生、发展。
为了验证CBS对H2S生成及小鼠认知功能的影响,我们进行了本实验。结果显示,12月龄APP/PS1双转基因小鼠较同窝野生型小鼠认知功能明显减退,且脑组织内Aβ1-42含量及老年斑沉积明显增多,说明双转基因鼠能够较好地模拟出AD的行为学变化及病理特征。接着我们检测到双转基因小鼠脑组织内CBS蛋白及H2S含量较野生型小鼠降低更为明显,当我们向双转基因小鼠脑组织注射CBS过表达慢病毒后,CBS蛋白表达数量增加、H2S含量也相应增多,与此同时,脑组织内Aβ1-42含量及老年斑沉积显著减少,短期内小鼠的空间学习与记忆能力也有所改善。因此我们推测,增加脑组织内CBS表达可以通过提高内源性H2S水平最终达到改善小鼠认知功能的目的。
目前关于H2S与AD相关性的研究均把NaHS作为外源性H2S供体,尚不能准确还原哺乳动物体内生理状态。本实验通过慢病毒注射的方法提高内源性H2S含量,更能反映出模型动物体内CBS表达与H2S含量变化的真实情况,具有较大的参考价值。下一步,我们将进一步研究针对CBS过表达减少Aβ产生的具体机制及可能经过的信号通路。
| [1] | Masters C L, Selkoe D J. Biochemistry of amyloid beta-protein and amyloid deposits in Alzheimer disease[J]. Cold Spring Harb Perspect Med, 2012, 2(6): a006262. |
| [2] | Giuliani D, Ottani A, Zaffe D, et al. Hydrogen sulfide slows down progression of experimental Alzheimer’s disease by targeting multiple pathophysiological mechanisms[J]. Neurobiol Learn Mem, 2013, 104: 82-91. |
| [3] | He X L, Yan N, Zhang H, et al. Hydrogen sulfide improves spatial memory impairment and decreases production of Abeta in APP/PS1 transgenic mice[J]. Neurochem Int, 2014, 67: 1-8. |
| [4] | 王延江, 卜先乐. 阿尔茨海默病的防治研究进展[J]. 第三军医大学学报, 2014, 36(21): 2153-2157. |
| [5] | Iizuka T, Shoji M, Kawarabayashi T, et al. Intracellular generation of amyloid beta-protein from amyloid beta-protein precursor fragment by direct cleavage with beta- and gamma-secretase[J]. Biochem Biophys Res Commun, 1996, 218(1): 238-242. |
| [6] | Ittner L M, Gotz J. Amyloid-beta and tau-a toxic pas de deux in Alzheimer’s disease[J]. Nat Rev Neurosci, 2011, 12(2): 65-72. |
| [7] | Kimura H, Shibuya N, Kimura Y. Hydrogen sulfide is a signaling molecule and a cytoprotectant[J]. Antioxid Redox Signal, 2012, 17(1): 45-57. |
| [8] | Kimura H. Hydrogen sulfide and polysulfides as biological mediators[J]. Molecules, 2014, 19(10): 16146-16157. |
| [9] | Abe K, Kimura H. The possible role of hydrogen sulfide as an endogenous neuromodulator[J]. J Neurosci, 1996, 16(3): 1066-1071. |
| [10] | Kimura Y, Kimura H. Hydrogen sulfide protects neurons from oxidative stress[J]. FASEB J, 2004, 18(10): 1165-1167. |
| [11] | Eto K, Asada T, Arima K, et al. Brain hydrogen sulfide is severely decreased in Alzheimer’s disease[J]. Biochem Biophys Res Commun, 2002, 293(5): 1485-1488. |
| [12] | 刘祥琴, 刘小琦, 蒋萍, 等. 阿尔茨海默病和血管性痴呆患者血浆硫化氢与同型半胱氨酸水平的变化及意义[J]. 中华医学杂志, 2008, 88(32): 2246-2249. |
| [13] | Zhang H, Gao Y, Zhao F, et al. Hydrogen sulfide reduces mRNA and protein levels of beta-site amyloid precursor protein cleaving enzyme 1 in PC12 cells[J]. Neurochem Int, 2011, 58(2): 169-175. |
| [14] | Lee M, Schwab C, Yu S, et al. Astrocytes produce the antiinflammatory and neuroprotctive agent hydrogen sulfide[J]. Neurobiol Aging, 2009, 30(10): 1523-1534. |



