2. 400016 重庆,重庆医科大学附属第一医院:血管外科
2. Department of Vascular Surgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
胆管癌是一种原发于胆管上皮细胞的恶性肿瘤,起病隐匿,生长缓慢,一般诊断时已是中晚期,并且已侵犯周围组织,引起胆道梗阻、胆系感染和肝功能损害[1]。胆管癌早期多无明显的临床症状,多因黄疸就诊,手术是肝外胆管癌的主要治疗手段,但就诊时仅10%~40%患者可以行手术[2, 3]。对于大多数不能手术切除的患者,多行引流管或金属支架置入进行姑息 治疗[4]。尽管经上述治疗可以一定程度地缓解梗阻性黄疸,改善症状,提高生存质量,减缓肝功能的损坏,但是胆管的通畅为暂时性的,不能根本解决肿瘤问题[5]。
近年的临床研究与循证医学证实,为了更有效地治疗胆管癌,预防肿瘤的转移和复发,放射治疗无论作为胆管癌晚期患者姑息综合治疗的一部分,还是作为根治性手术的辅助治疗手段都已显现出一定的价值[6, 7]。高效低毒的放射增敏剂可提高胆管癌的放疗效果,提高患者生活质量,成为肿瘤放射治疗的研究热点[8]。比如有学者利用改善肿瘤微环境、清除自由基和电子、抑制DNA损伤修复等方法提高胆管癌的放射治疗疗效[9]。
新近研究发现,全反式维甲酸衍生物N-(4-羟基苯基)维生素甲酰胺(fenretinide,4-HPR)在体外可抑制多种肿瘤细胞增殖,促进肿瘤细胞凋亡;在体内实验中,4-HPR可抑制肿瘤的形成或复发[10, 11],但关于其放射增敏的研究不多。因此,本研究通过培养人胆管癌QBC939细胞,采用MTT、细胞克隆实验、流式细胞仪等检测4-HPR对胆管癌细胞的抑制作用、放射增敏作用以及对凋亡作用的影响。
1 材料与方法 1.1 材料人胆管癌QBC939细胞株由第三军医大学西南医院惠赠。主要试剂4-HPR购于Sigma公司,RPMI1640培养基、胎牛血清、0.25%胰蛋白酶、磷酸盐缓冲液(PBS)购于Life公司,MTT购于Sigma公司,二甲基亚砜(DMSO)购于Sigma公司。
1.2 方法 1.2.1 细胞培养人胆管癌QBC939细胞用含10%FBS、1%双抗的RPMI1640培养液在37 ℃、5%CO2培养箱内培养,2~3 d传代1次,取对数生长期的细胞进行实验。
1.2.2 照射条件6 MV直线加速器进行不同剂量照射,照射野为20 cm×20 cm,皮源距为100 cm,剂量率2 Gy/min。
1.2.3 MTT检测细胞增殖抑制情况取对数生长期的QBC939细胞,以4 000个/孔的密度接种于96孔板中,每孔200 μL,培养24 h后,弃原培养液,加入含不同浓度的4-HPR培养液,分别为1、2、4、8、16、32、64、128 μmol/L,共8组,另外设空白对照组和不加药的正常对照组,每组设3个复孔,培养24 h后,弃原培养液,每孔加入20 μL MTT溶液,于37 ℃培养箱内继续培养4 h后,弃各孔MTT,加入150 μL DMSO,置摇床低速振荡10 min,用酶标仪(Thermo公司)490 nm 处测光密度值[D(490)],计算抑制率。抑制率=[1- 实验组D(490)值/对照组D(490)值]×100%。计算IC50,采用0.2×IC50作为后续实验的药物浓度。
1.2.4 细胞克隆形成实验取对数生长期细胞消化后制成细胞悬液,取不同数目的细胞接种于6孔板 中培养24 h,设置正常对照组、单纯照射组和4-HPR+照射组,每组3个平行样本,给予0、2.4 μmol/L 4-HPR,继续培养24 h后分别给予X射线0、2、4、6、8 Gy照射,照射后更换培养液,在37 ℃、5%CO2条件下培养14 d 。 当培养皿中出现肉眼可见的克隆时终止培养,用PBS漂洗后,甲醇固定,Giemsa染色后,在显微镜下计数,计数>50个细胞的细胞克隆,计算克隆存活率。采用“多靶单击模型”计算增益比(sensitizer enhancement ratios,SER)。细胞存活分数(SF)=1-[1-exp(-D/D0)]N,准域剂量(Dq)=D0lgN
克隆存活率=处理组克隆数/对照组克隆数×100%。SER=单纯照射组D0值/4-HPR+照射组D0值,其中D代表照射剂量,D0代表平均致死剂量,N代表外推数。
1.2.5 流式细胞术检测细胞凋亡取对数生长期的细胞接种于25 cm2培养瓶中,实验分为4个组,①正常对照组:不做任何处理;②单纯药物组:给予2.4 μmol/L 4-HPR干预24 h;③单纯照射组:给予2 Gy 的X射线照射;④4-HPR+照射组:照射前给予2.4 μmol/L 4-HPR干预24 h。照射后各组细胞继续培养48 h后收集细胞,Annexin V-FITC/PI双染,流式细胞仪检测凋亡率。
1.2.6 Western blot检测QBC939细胞凋亡相关蛋白的表达实验分组同1.2.5,收集不同处理组的细胞,用IP细胞裂解液(碧云天公司)充分裂解,BCA蛋白浓度测定试剂盒(碧云天公司)测定蛋白浓度,加入5×上样缓冲液煮沸,充分变性后,SDS-PAGE电泳,转阴蛋白至PVDF膜(Millipore公司)上,5%脱脂奶/TBST溶液封闭1 h,TBST洗膜后加入一抗:bcl-2 antibody (C-2): sc-7382,1: 500;caspase-3 antibody (E-8): sc-7272,1: 500(Santa Cruz)。4 ℃封闭过夜,洗去一抗,TBST洗3次,二抗anti-mouse IgG,HRP-linked antibody #7076,1: 1 000(CST)室温孵育1 h,TBST洗3次,加入ECL超敏发光液(碧云天公司),暗室中曝光成像。
1.3 统计学方法采用SPSS 19.0统计软件,计量资料比较行t检验。
2 结果 2.1 MTT结果4-HPR对人胆管癌QBC939细胞有明显的抑制作用,并呈剂量依赖性。4-HPR的IC50为12 μmol/L(图 1),并选择0.2×IC50为后续实验浓度。
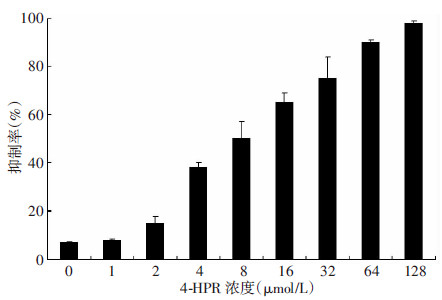 |
| 图 1 4-HPR对QBC939增殖的抑制作用 |
4-HPR对QBC939细胞的放射增敏效应,用SF来比较细胞集落形成的能力,SF高则说明集落形成能力强。4-HPR与不同剂量X射线照射QBC939细胞后,与单纯照射组比较,4-HPR+照射组SF下降,并且随着照射剂量的增加,明显下降(表 1)。采用多靶单击模型拟合的不同处理组QBC939存活曲线见图 2。根据拟合的细胞存活曲线及相关公式,得出相应参数D0、Dq、SER值见表 2,提示4-HPR可使QBC939细胞的放射敏感性增强,其值为1.41。
| 剂量 | 单纯照射组 | 4-HPR+照射组 |
| 0 Gy | 1.000±0.000 | 1.000±0.000 |
| 2 Gy | 0.661±0.005 | 0.481±0.009 a |
| 4 Gy | 0.399±0.011 | 0.183±0.005 a |
| 6 Gy | 0.223±0.006 | 0.078±0.007 a |
| 8 Gy | 0.014±0.004 | 0.005±0.001 a |
| a:P < 0.05,与单纯照射组 | ||
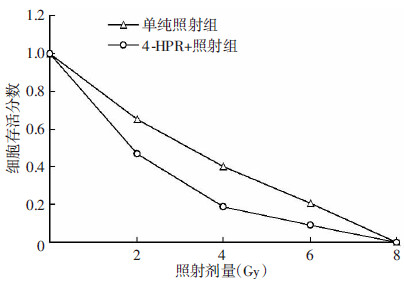 |
| 图 2 根据单击多靶拟合的细胞存活曲线 |
流式细胞仪检测各组细胞经不同处理后的细胞凋亡的改变,结果显示,4-HPR能提高放疗诱导的凋亡(图 3)。
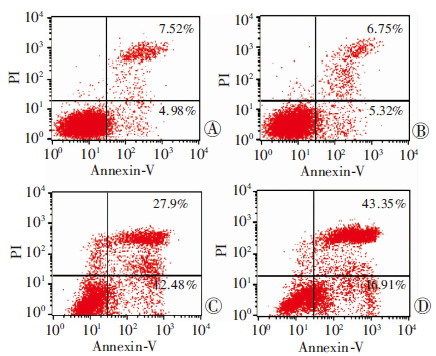 |
| 1:正常对照组;B:单纯药物组;C:单纯照射组;D:4-HPR+照射组 图 3 流式细胞仪检测细胞凋亡的变化 |
Western blot对caspase-3和bcl-2蛋白表达的检测结果显示,单纯药物组和单纯照射组caspase-3的表达明显低于4-HPR+照射组(P < 0.05);单纯药物组和单纯照射组bcl-2的表达明显高于4-HPR+照射组(P < 0.05,图 4,表 3)。
 |
| 1:正常对照组;B:单纯药物组;C:单纯照射组;D:4-HPR+照射组 图 4 4-HPR作用后凋亡相关蛋白caspase-3及bcl-2的 表达情况 |
| 组别 | caspase-3 | bcl-2 |
| 正常对照组 | 0.137±0.022 | 0.695±0.019 |
| 单纯药物组 | 0.135±0.018 a | 0.388±0.020 a |
| 单纯照射组 | 0.435±0.021 a | 0.125±0.018 a |
| 4-HPR+照射组 | 0.745±0.019 | 0.115±0.017 |
| a: P < 0.05,与4-HPR+照射组比较 | ||
目前临床上运用的抗肿瘤药在一定程度上有效抑制了肿瘤的进展,但是这些药物在使用过程中难免会出现恶心、呕吐、头痛、皮肤粘膜干燥或溃疡等副作用[12, 13]。因此,寻求高效且副反应较小的抗肿瘤药物是当前肿瘤治疗研究的热点。
本研究发现,全反式维甲酸衍生物4-HPR对胆管癌QBC939细胞有明显的抑制作用。大量的体外研究发现,4-HPR对乳腺癌、宫颈癌、卵巢癌、子宫内膜癌、肺癌、头颈鳞状细胞癌等肿瘤和多种白血病细胞具有抑制肿瘤细胞增殖与生长的作用[7, 14]。结合4-HPR对胆管癌QBC939细胞具有抑制增殖作用并且呈剂量依赖性,即细胞增殖抑制率随药物浓度增加而增加的特点,说明4-HPR与化疗药物具有同样的治疗作用。
尽管化学药物治疗在胆管癌的综合治疗中占有重要的地位,但单独应用毒副作用大,易产生继发性耐药[15],而放射治疗与化疗联合则可以有效减少化疗药物的剂量,减轻毒副作用,达到协同增加治疗效果,减少副作用的目的[16]。我们通过4-HPR加放射综合治疗发现,4-HPR+照射组的D0、Dq、SF值均比单纯照射组低,QBC939细胞经过4-HPR干预后对X线更敏感,细胞凋亡增多,高于单独照射组。这说明4-HPR附加放射治疗能够增加对胆管癌QBC939细胞的抑制增殖作用和效果。4-HPR的作用机制与化疗药物并不完全相同。抗肿瘤作用主要是诱导肿瘤细胞凋亡[17],而我们进一步使用流式细胞仪检测Annexin-V结果显示,4-HPR能提高放疗诱导的凋亡。这些结果提示,4-HPR加放射主要通过诱导凋亡,从而到达有效抑制肿瘤生长的目的。这些作用也可能与4-HPR可升高神经酞胺的水平作用有关,4-HPR和细胞的神经酞胺水平之间存在时间和剂量依赖性关系[3]。另外也可能与4-HPR通过调控12-脂肪氧化酶的活性、激活丝氨酸棕榈酞转移酶,从而产生更多的活性氧,使诱导生长抑制和DNA损伤的转录因子Gadd 153高表达,它的表达产物直接调节前凋亡基因Bak的表达,在bcl-2的协同作用下引起线粒体释放细胞色素C,进而促进肿瘤细胞凋亡[18]。
有研究表明4-HPR可以通过肿瘤细胞活性氧而影响凋亡[19]。该作用可能主要通过靶点辅酶Q影响线粒体呼吸链而诱导生成活性氧,可以导致线粒体膜电位的破坏,释放载体细胞色素、细胞凋亡起始因子等因子,进一步激活caspase-9进而激活procaspase-3,成为有活性的caspase-3,促使细胞凋亡[20]。bcl-2蛋白家族包括细胞生存的主要调节因子,这些调节因子可以促进或抑制细胞凋亡[21]。细胞凋亡蛋白酶的激活是细胞凋亡的关键环节。细胞凋亡蛋白酶活性的一个关键环节就包括固有的线粒体通路,从细胞色素C易位进入细胞质,继而与细胞凋亡蛋白酶激活因子-1和活化的caspase-9相互作用。活化的细胞凋亡蛋白酶-9可接着激活下游caspase-3或caspase-7,同时,激活下游的caspase-3或caspase-7反过来又诱导细胞凋亡蛋白酶激活因子-1裂解[22]。本研究Western blot检测结果显示,4-HPR+照射组可以增加caspase-3的表达,同时降低bcl-2的表达。此结果表明4-HPR对胆管癌QBC939细胞有放射增敏作用。目前,4-HPR抑制细胞增殖和促进凋亡的机制尚不十分清楚,仍然需要更多的研究来进一步揭示。
总之,我们应用多种方法检测了4-HPR对胆管癌QBC939细胞有抑制和放射增敏作用,该作用机制可能与诱导细胞凋亡有关。4-HPR对QBC939细胞的增敏作用可能为提高胆管癌的临床治疗奠定一定的实验基础。
| [1] | Patel T. Cholangiocarcinoma--controversies and challenges[J]. Nat Rev Gastroenterol Hepatol, 2011, 8(4): 189-200. |
| [2] | O’Donnell P H, Guo W X, Reynolds C P, et al. N-(4-hydroxyphenyl) retinamide increases ceramide and is cytotoxic to acute lymphoblastic leukemia cell lines, but not to non-malignant lymphocytes[J]. Leukemia, 2002, 16(5): 902-910. |
| [3] | Prinetti A, Basso L, Appierto V, et al. Altered sphingolipid metabolism in N-(4-hydroxyphenyl)-retinamide-resistant A2780 human ovarian carcinoma cells[J]. J Biol Chem, 2003, 278(8): 5574-5583. |
| [4] | Lee T H, Moon J H, Park S H. Bilateral metallic stenting in malignant hilar obstruction[J]. Clin Endosc, 2014, 47(5): 440-446. |
| [5] | Razumilava N, Gores G J. Cholangiocarcinoma[J]. Lancet, 2014, 383(9935): 2168-2179. |
| [6] | Simeone A M, Deng C X, Kelloff G J, et al. N-(4-Hydroxyphenyl)retinamide is more potent than other phenylretinamides in inhibiting the growth of BRCA1-mutated breast cancer cells[J]. Carcinogenesis, 2005, 26(5): 1000-1007. |
| [7] | Zou C, Vlastos A T, Yang L, et al. Effect of 4-hydroxyphenylretinamide on human cervical epithelial and cancer cell lines[J]. J Soc Gynecol Investig, 2003, 10(1): 41-48. |
| [8] | Nilsson P J, van-Etten B, Hospers G A, et al. Short-course radiotherapy followed by neo-adjuvant chemotherapy in locally advanced rectal cancer--the RAPIDO trial[J]. BMC Cancer, 2013, 13: 279. |
| [9] | Leyva-Illades D, McMillin M, Quinn M, et al. Cholangiocarcinoma pathogenesis: Role of the tumor microenvironment[J]. Transl Gastrointest Cancer, 2012, 1(1): 71-80. |
| [10] | Golubkov V, Garcia A, Markland F S. Action of fenretinide (4-HPR) on ovarian cancer and endothelial cells[J]. Anticancer Res, 2005, 25(1A): 249-253. |
| [11] | Cuello M, Coats A O, Darko I, et al. N-(4-hydroxyphenyl) retinamide (4HPR) enhances TRAIL-mediated apoptosis through enhancement of a mitochondrial-dependent amplification loop in ovarian cancer cell lines[J]. Cell Death Differ, 2004, 11(5): 527-541. |
| [12] | Cardinale L, Asteggiano F, Moretti F, et al. Pathophysiology, clinical features and radiological findings of differentiation syndrome/all-trans-retinoic acid syndrome[J]. World J Radiol, 2014, 6(8): 583-588. |
| [13] | Tamai K, Nakamura M, Mizuma M, et al. Suppressive expression of CD274 increases tumorigenesis and cancer stem cell phenotypes in cholangiocarcinoma[J]. Cancer Sci, 2014, 105(6): 667- 674. |
| [14] | Chun K H, Kosmeder J W 2nd, Sun S, et al. Effects of deguelin on the phosphatidylinositol 3-kinase/Akt pathway and apoptosis in premalignant human bronchial epithelial cells[J]. J Natl Cancer Inst, 2003, 95(4): 291-302 |
| [15] | Tanaka S, Fukumoto N, Ohno K, et al. Cholangiocarcinoma in a middle-aged patient working at a printing plant[J]. Osaka City Med J, 2014, 60(1): 39-44. |
| [16] | Battal M, Gurbulak B, Bostanci O, et al. Cholangiocarcinoma presenting with hypercalcemia and thrombocytopenia[J]. Case Rep Med, 2014, 2014: 246817. |
| [17] | Connolly R M, Nguyen N K, Sukumar S. Molecular pathways: current role and future directions of the retinoic acid pathway in cancer prevention and treatment[J]. Clin Cancer Res, 2013, 19(7): 1651-1659. |
| [18] | Wang H, Maurer B J, Reynolds C P, et al. N-(4-hydroxyphenyl)retinamide elevates ceramide in neuroblastoma cell lines by coordinate activation of serine palmitoyltransferase and ceramide synthase[J]. Cancer Res, 2001, 61(13): 5102-5105. |
| [19] | Apraiz A1, Idkowiak-Baldys J, Nieto-Rementeria N, et al. Dihydroceramide accumulation and reactive oxygen species are distinct and nonessential events in 4-HPR-mediated leukemia cell death[J]. Biochem Cell Biol, 2012, 90(2): 209-223. |
| [20] | Campisi L, Cummings R J, Blander J M. Death-defining immune responses after apoptosis[J]. Am J Transplant, 2014, 14(7): 1488-1498. |
| [21] | Martinou J C, Youle R J. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J]. Dev Cell, 2011, 21(1): 92-101. |
| [22] | Nateewattana J, Dutta S, Reabroi S, et al. Induction of apoptosis in cholangiocarcinoma by an andrographolide analogue is mediated through topoisomerase Ⅱ alpha inhibition[J]. Eur J Pharmacol, 2014, 723: 148-155. |



