随着新生儿和产科学的发展,虽然早产儿特别是极低体质量儿的生存率明显提高,但早产儿脑瘫的发病率却呈逐年增加趋势[1, 2]。研究表明,脑室周围白质损伤(white matter damage,WMD)是导致早产儿脑瘫的主要原因之一,而少突胶质细胞(oligodendrocyte,OL)主要分布在中枢神经系统白质神经纤维束之间,其成熟分化障碍是WMD形成的关键因素之一[2, 3, 4]。
近年来,常压高浓度氧疗在围生期脑损伤中的作用逐渐受到重视。研究发现,新生儿期高氧(>80%)暴露是导致WMD的危险因素之一,主要表现为少突胶质细胞成熟障碍[5, 6, 7],但其具体机制尚未阐明。Notch是一种高度保守的信号通路,在多种组织器官早期发育和修复过程中对发育细胞的分化、增殖和凋亡起着决定作用[8, 9, 10],而DAPT可阻断Notch信号通路关键酶γ-分泌酶,被广泛用于对Notch通路的探讨[9],目前尚少见Notch信号通路在新生儿期高氧脑损伤中作用的报道。本研究利用Notch信号通路特异性阻断剂DAPT,探讨Notch信号通路在新生鼠高氧脑损伤中的作用,为WMD的预防和干预治疗提供参考。
1 材料与方法 1.1 材料SPF级健康C57BL/10J新生3 d(P3)小鼠64只,体质量1.56~1.60 g,购自重庆医科大学实验动物中心。DAPT(GSI-IX)(Selleck,美国),SYBR Green(碧 云天生物技术研究所,中国),PCR引物合成(Invitrogen,美国),TRIzol(Invitrogen,美国),PrimeScriptRT reagent Kit(大连宝生生物公司,中国),BCA蛋白浓度测定试剂盒(南京凯基生物科技发展有限公司,中国),凯基全蛋白提取试剂盒(南京凯基生物科技发展有限公司,中国),ECL化学发光试剂盒(南京凯基生物科技发展有限公司,中国),β-actin 兔抗小鼠一抗(上海康成生物工程有限公司,中国),髓鞘磷脂蛋白(myelin basic protein,MBP,ab62631)小鼠单克隆抗体(Abcam,美国),Frul488标记山羊抗小鼠二抗(碧云天生物技术研究所,中国),辣根过氧化物酶标记的山羊抗小鼠二抗(北京中杉金桥生物技术有限公司,中国),辣根过氧化物酶标记的山羊抗兔二抗(北京中杉金桥生物技术有限公司,中国),自制有机玻璃氧箱(30 cm×20 cm×15 cm),显微镜及图像采集系统(Olympus公司,日本)。
1.2 方法 1.2.1 动物高氧模型制备及分组新生3 d的C57BL/10J野生小鼠64只,分为空气对照组(C)、空气+DAPT组(C+DAPT)、高氧组(H)、DAPT预处理后高氧暴露组(H+DAPT),每组16只。C+DAPT组和H+DAPT组于高氧暴露前1 h通过单次腹腔注射γ- 分泌酶抑制剂DAPT(10 mg/kg,溶于1%二甲基亚砜),而C组和H组用同样的方法注入等量1%二甲基 亚砜。将H组和H+DAPT组的小鼠和母鼠一起置于 高氧箱中,放入数字测氧仪,通入100%的氧气2.5 L/min,并用测氧仪持续监测氧箱内氧及CO2浓度,始终保持氧箱内氧浓度≥80%,CO2浓度≤5%(用钠石灰吸收CO2);C组及C+DAPT组与各自哺乳母鼠置同室空气中饲养。将H组和H+DAPT组哺乳母鼠在通氧24 h 后与C组和C+DAPT组哺乳母鼠交换,以避免哺乳母鼠因氧中毒导致喂养能力下降。各组环境温度均控制在21~25 ℃,湿度60%~70%,维持12 h日照/夜间循环。高氧暴露48 h后停止通氧,取出置于空气中喂养至生后5 d(P5)和12 d(P12),C组、C+DAPT组在空气中常规饲养。
1.2.2 标本的采集及处理各组分别于P5取4只新生鼠,10%水合氯醛3 mL/kg麻醉后断头处死,取出全脑组织立即置入玻璃匀浆器中与1 mL TRIzol充分匀浆后,转入1.5 mL去酶EP管,-80 ℃超低温冰箱 中保存,用于实时荧光定量检测Notch1、Jagged1、Hes1、 Hes5基因的表达;另48只于P12处死:其中16只分别于4%多聚甲醛固定分离脑组织,置于多聚甲醛液继续固定24 h,制作石蜡切片,用于脑白质区HE染色;16只经4%多聚甲醛,过夜固定,然后依次置入梯度(20%、30%)PBS蔗糖溶液脱水,过夜至沉底,OTC包埋,制成6 μm冰冻切片,用于脑组织免疫荧光检测;剩下16只取全脑组织立即置于液氮中,稍后移入-80 ℃超低温冰箱保存,用于MBP蛋白表达检测。
1.2.3 脑组织病理形态学观察方法石蜡切片经二甲苯常规脱蜡,梯度(100%、95%、80%、70%)酒精水化,蒸馏水漂洗后入苏木精染色10 min,自来水冲洗1 min,1%盐酸乙醇溶液分色,促蓝液返蓝,流水冲洗,入0.5%伊红酒精染色1 min,上行梯度酒精(80%、95%、100%)脱水,二甲苯透明,中性树胶封片。光学显微镜下观察并拍照。
1.2.4 RT-PCR检测Notch1、Jagged1、Hes1及Hes5 mRNA表达时序性变化将各组脑组织匀浆按TRIzol提取组织总RNA,测定RNA浓度和纯度[D(260)和D(280),比值>1.8],所测RNA浓度按逆转录试剂盒说明书逆转录合成cDNA,共20 μL。引物 序列见表 1,RT-PCR反应体系10 μL:cDNA模板1 μL,上下游引物各0.5 μL,SYBR溶液4.5 μL,超纯水3.5 μL。反应条件:94 ℃预变性3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,39个循环;72 ℃延伸5 min。测定目的基因和β-actin PCR产物的Ct值(Ct值是目的基因扩增产物达到所设定阈值时的扩增循环数),基因的相对表达量采用2-△△Ct计算。
| 基因 | 引物序列(5′→3′) | 片段大小(bp) |
| Notch1 | 上游 CCTCAGCACACCGTGTAAGA | 40 |
| 下游 GCGGCACTTGTACTCTGTGA | ||
| Jagged1 | 上游 TGCAGAACGTGAATGGAGAG | 40 |
| 下游 AAAGGCAGTACGATGCGATT | ||
| Hes1 | 上游 GATCAACGCCATGACCTACC | 40 |
| 下游 AAAAACCTTGGCAGCCTCTC | ||
| Hes5 | 上游CTTCTGCGAAGTTCCTGGTC | 40 |
| 下游 GAGGAAACACCTGCAGTTCC | ||
| β-actin | 上游 AGATTACTGCTCTGGCTCCTAGC | 45 |
| 下游 ACTCATCGTACTCCTGCTTGCT |
脑组织冰冻切片用0.5%Triton增加细胞膜通透性,室温10 min,PBS洗3遍,山羊血清37 ℃封闭15 min,甩干,加稀释一抗[单克隆抗小鼠MBP(1 ∶500)],阴性对照以0.01 mol/L PBS代替一抗,4 ℃孵育过夜。次日室温复温30 min,PBS洗3遍,加稀释二抗 [FITC山羊抗小鼠绿光(1 ∶200)]37 ℃孵育60 min,PBS洗3遍,DAPI室温孵育15 min,PBS洗3遍,晾干,滴加抗荧光淬灭封片液封片,荧光显微镜下观察并拍照。MBP(绿色荧光)提示成熟少突胶质细胞,DAPI(蓝色荧光)显示细胞核。
1.2.6 Western blot检测成熟少突胶质细胞的MBP蛋白水平按照试剂盒说明书对各组脑组织总蛋白 进行提取和BCA蛋白质定量;电泳分离后,将目标蛋白条带电转至PVDF膜上,5 g/100 mL脱脂奶粉封闭液封闭2 h,TBST洗膜3次,每次10 min,一抗(MBP 1 ∶800稀释)4 ℃,过夜,TBST洗膜3次,每次10 min,二抗室温孵育2 h(1 ∶4 000稀释),ECL发光法显色,暗室中曝光,照相;Image J图像分析软件分析各蛋白的积分光密度值,以MBP/β-actin的值代表MBP的表达水平。
1.3 统计学分析采用SPSS 19.0统计软件,数据以x±s表示,组间比较行单因素方差分析、LSD检验;图片采用Image J软件分析其相对光密度值及灰度值。
2 结果 2.1 病理形态学改变HE染色后,光镜下观察可见C组新生鼠脑组织结构清晰完整,细胞排列整齐,胞质丰富,胞核居中,核仁清晰,细胞周围间隙致密无水肿;H组脑组织胞质结构不清,胞质嗜伊红染色增强,核固缩,胞体变形缩小,细胞周围间隙增宽;而H+DAPT组新生鼠脑组织细胞损伤程度明显减轻(图 1)。
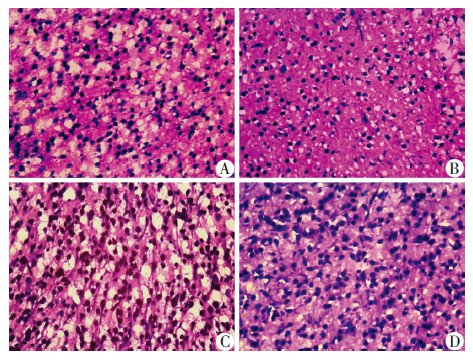 |
| A:C组;B:C+DAPT组;C:H组;D:H+DAPT组 图 1 P12新生小鼠脑白质区病理学观察(HE ×200) |
结果显示,H组Notch1、Jagged1较C组表达增高(P < 0.05);与H组比较,H+DAPT组Notch1及Jagged1 mRNA表达均明显增高(P < 0.05); H组Hes1、Hes5 mRNA表达增高,与C组比较差异有统计学意义(P < 0.05);DAPT干预后,H+DAPT组Hes1、Hes5 mRNA表达均明显降低(P < 0.05,图 2)。
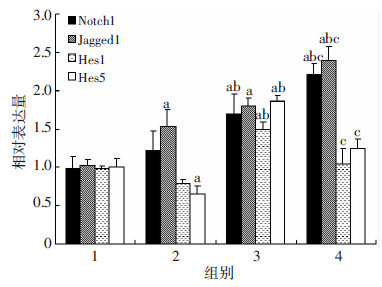 |
|
1:C组;2:C+DAPT组;3:H组;4:H+DAPT组 a:P < 0.05,与C组比较;b: P < 0.05,与C+DAPT组比较;C:P < 0.05,与H组比较 图 2 P3小鼠DAPT预处理高氧暴露48 h后P5脑内Notch 通路相关基因mRNA表达量的比较 (n=4) |
与C组比较,H组MBP阳性细胞数量(绿色荧光)明显降 低(P < 0.05);经DAPT预处理后,H+DAPT组MBP阳性细胞数量明显增多,且其表达数量是H组的3倍(P < 0.05,图 3)。
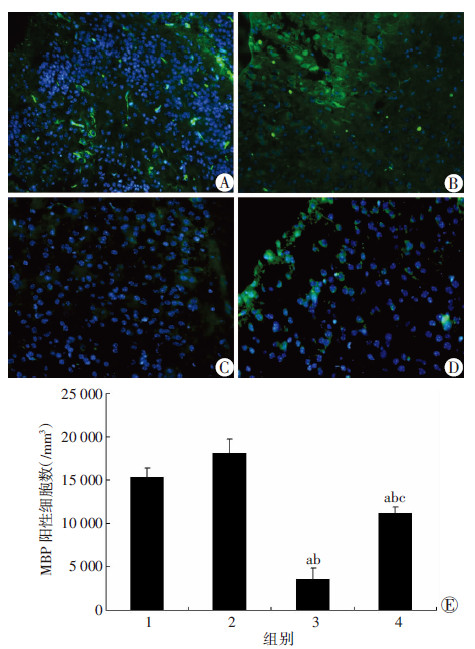 |
| A~D:分别为C组、C+DAPT组、H组、H+DAPT组免疫荧光检测结果(荧光显微镜 ×200);E:相对定量分析结果 1:C组;2:C+DAPT组;3:H组;4:H+DAPT组 a:P < 0.05,与C组比较;b: P < 0.05,与C+DAPT组比较; c: P < 0.05,与H组比较 图 3 P3新生鼠DAPT预处理高氧暴露48 h后P12脑白质区 MBP阳性细胞数变化 (n=4) |
与C组比较,H组及H+DAPT组MBP表达明显下降(P < 0.05);但与H组比较,H+DAPT组MBP蛋白表达增高(P < 0.05,图 4)。
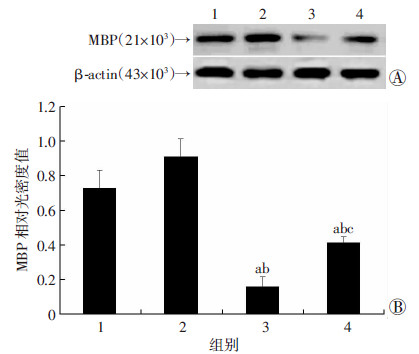 |
|
1:C组;2:C+DAPT组;3:H组;4:H+DAPT组 A:Western blot检测结果;B:半定量分析结果 a:P < 0.05,与C组比较;b: P < 0.05,与C+DAPT组比较;c:P < 0.05, 与H组比较 图 4 P3新生鼠DAPT干预高氧暴露后对P12脑白质MBP 表达的影响 (n=4) |
常压高浓度氧疗广泛应用于新生儿复苏及肺部疾病的治疗[11],以往研究表明常压高浓度氧对未成熟脑具有神经毒性作用,在特定时间窗内可阻碍少突胶质前体细胞的分化、成熟,并导致髓鞘形成障碍,且其损害作用具有成熟依赖性[1, 3, 5]。 少突胶质细胞是中枢神经系统内的主要细胞,表现为包绕轴突、形成绝缘的髓鞘结构、协助神经电信号的跳跃式高效传递,维持和保护神经元的正常功能。Notch作为一种跨膜蛋白受体,与邻近细胞表面配体结合活化后进行跨膜信息传导发挥作用[12, 13],Notch信号激活影响神经干细胞(neural stem cells,NSCs)向少突胶质细胞分化,引起未成熟脑损伤发生。本研究通过预先给予Notch信号特异性抑制剂DAPT,探讨Notch信号通路是否参与新生鼠高氧暴露致少突胶质细胞成熟障碍过程。
本研究选择新生P3小鼠作为处理对象,是因为P3新生小鼠相当于人类妊娠24~32周[2],能够模拟未成熟早产儿从子宫内较低的氧张力环境转换至宫外相对较高的氧张力环境,以及出生后高浓度氧疗的损害作用[14, 15]。本实验结果显示,P3新生鼠高氧暴露48 h后,脑组织发生水肿坏死等脑损害表现,提示高氧可导致未成熟脑损伤。
少突胶质细胞起源于胚胎神经管的神经上皮细胞,脑内NSCs分化为成熟少突胶质细胞大体经历以下几个阶段:神经干细胞、少突胶质祖细胞、少突胶质前体细胞、未成熟少突胶质细胞和成熟少突胶质细胞[16],其中,只有成熟少突胶质细胞具备形成髓鞘能力。MBP是成熟少突胶质细胞特异性表达蛋白,在新生鼠脑白质中表达始于P8,到P12在脑组织中可以被检测到[3]。因此,我们选择在P12检测新生鼠脑白质MBP蛋白表达。本实验结果显示,P12新生鼠高氧暴露后MBP表达明显降低,说明高氧暴露后可导致新生鼠脑白质区成熟少突胶质细胞数量减少和少突胶质细胞成熟障碍,与以往的研究结果一致[4, 5, 6]。
最新研究发现,少突胶质前体细胞能与Notch受体结合,激活下游信号转导,抑制少突胶质细胞成熟分化[11, 14]。本研究亦发现,新生鼠高氧暴露后,脑组织中Notch受体Notch1,配体Jagged1,靶基因Hes1、Hes5 mRNA表达明显增加,我们推测高氧暴露可激活Notch信号转导通路,进而影响少突胶质细胞成熟分化。
DAPT是Notch信号通路上关键酶——γ-分泌酶的特异性抑制剂,能够有效地阻碍Notch信号活化,影响靶基因发挥作用,常用于Notch信号通路的研究[9]。DAPT在P3新生鼠腹腔注射后在脑内浓度48 h达到高峰,因此,我们选择在P5检测脑内Notch信号表达。本实验结果显示,新生鼠DAPT预处理高氧暴露后,P5小鼠脑内Notch1、Jagged1 mRNA表达明显上调,Hes1、Hes5 mRNA表达显著下降。采用DAPT处理后P12新生鼠脑白质成熟少突胶质细胞数量明显增加,提示DAPT阻断了高氧引起的Notch信号激活,干扰下游靶基因(Hes家族)表达,对下游调控的抑制作用减弱,从而诱导少突胶质细胞成熟,故验证了我们关于Notch信号通路可能参与未成熟脑高氧脑损伤引起少突胶质细胞成熟障碍过程的推测,相关的分子机制有待进一步研究。
综上所述,新生期高氧暴露导致新生鼠脑组织内Notch信号表达异常;抑制Notch信号通路使靶基因Hes家族表达下调,导致Notch信号对靶细胞抑制作用减弱,有利于少突胶质细胞的成熟,减少脑损伤发生。Notch信号途径可能是未成熟脑高氧损伤及少突胶质细胞成熟障碍新的分子病理机制。
| [1] | Gerstner B, Buhrer C, Rheinlander C, et al. Maturation-dependent oligodendrocyte apoptosis caused by hyperoxia[J]. J Neurosci Res, 2006, 84(2): 306-315. |
| [2] | Doyle L W, Roberts G, Anderson P J, et al. Outcomes at age 2 years of infants < 28 weeks’ gestational age born in Victoria in 2005[J]. J Pediatr, 2010, 156(1): 49-53. |
| [3] | Ritter J, Schmitz T, Chew L J, et al. Neonatal hyperoxia exposure disrupts axon-oligodendrocyte integrity in the subcortical white matter[J]. J Neurosci, 2013, 33(21): 8990-9002. |
| [4] | Vottier G, Pham H, Pansiot J, et al. Deleterious effect of hyperoxia at birth on white matter damage in the newborn rat[J]. Dev Neurosci, 2011, 33(3/4): 261-269. |
| [5] | Schmitz T, Ritter J, Mueller S, et al. Cellular changes underlying hyperoxia-induced delay of white matter development[J]. J Neurosci, 2011, 31(11): 4327-4344. |
| [6] | Brehmer F, Bendix I, Prager S, et al. Interaction of inflammation and hyperoxia in a rat model of neonatal white matter damage[J]. PLoS One, 2012, 7(11): e49023. |
| [7] | Scheer N, Groth A, Hans S, et al. An instructive function for Notch in promoting gliogenesis in the zebrafish retina[J]. Development, 2001, 128(7): 1099-1107. |
| [8] | Yao L, Kan E M, Kaur C, et al. Notch-1 signaling regulates microglia activation via NF-κB pathway after hypoxic exposure in vivo and in vitro[J]. PLoS One, 2013, 8(11): e78438. |
| [9] | Nasoohi S, Hemmati A A, Moradi F, et al. The γ-secretase blocker DAPT impairs recovery from lipopolysaccharide-induced inflammation in rat brain[J]. Neuroscience, 2012, 210: 99-109. |
| [10] | Park H C, Appel B. Delta-Notch signaling regulates oligodendrocyte specification[J]. Development, 2003, 130(16): 3747-3755. |
| [11] | Castillo A, Sola A, Baquero H, et al. Pulse oxygen saturation levels and arterial oxygen tension values in newborns receiving oxygen therapy in the neonatal intensive care unit: is 85% to 93% an acceptable range?[J]. Pediatrics, 2008, 121(5): 882-889. |
| [12] | Wang S, Sdrulla A D, diSibio G, et al. Notch receptor activation inhibits oligodendrocyte differentiation[J]. Neuron, 1998, 21(1): 63-75. |
| [13] | 王利祥, 华子春. Notch信号通路研究进展[J]. 中国医药生物技术, 2009, 4(3): 224-226. |
| [14] | 陈坤, 蒋朴, 徐颖, 等. Toll样受体4在新生小鼠常压高 氧脑损伤中的作用[J]. 免疫学杂志, 2012, 28(2): 98-103. |
| [15] | 蒋朴, 徐颖, 胡良安, 等. 高浓度氧暴露对N9小胶质细胞功能的影响[J]. 南方医科大学学报, 2012, 32(1): 71-74. |
| [16] | 董乐乐, 于泽, 连建强. 髓鞘碱性蛋白临床意义研究进展[J].包头医学院学报, 2012, 28(6): 139-140. |



