2. 400044 重庆,重庆大学电气工程学院高电压与电工新技术教育部重点实验室
卵巢癌是女性生殖器官三大恶性肿瘤之一,病死率居妇科恶性肿瘤之首。手术、化疗、放疗等传统手段不断改进,但治疗效果改善甚微,因此寻求更为理想、有效的新方法乃是当务之急。近年来,利用磁场的生物学效应治疗肿瘤逐渐引起更多的关注[1]。而脉冲磁场(pused electric-magnetic fields,PEMF)作为一种安全、简便、有效的方式,已在骨质疏松[2]、骨关节炎[3]、高血压[4]等多种疾病的治疗领域中应用。PEMF治疗肿瘤也显示出一定的临床应用前景,但其确切的机制仍不够明确。
研究表明,PEMF能使细胞膜在静息电位的基础上产生新的跨膜电位[6],引起细胞膜上离子通道的改变并影响细胞的代谢活动[7]。Wang等[8]发现PEMF可通过肿瘤细胞的细胞膜作用于胞内的钙信号途径,引起相应的生物学效应。关于PEMF对肿瘤细胞膜结构与功能及钙信号的影响是一个值得深入研究的问题。目前有关PEMF对肿瘤细胞的研究结果不尽相同,与磁场参数、实验条件、方法及肿瘤细胞的种类等密切相关[9]。文献[10]报道8 Hz的PEMF能明显诱导SKOV3细胞的凋亡,结合实验中所采用的陡脉冲磁场发生器所能达到的条件,并从临床应用的安全性出发,本实验拟选用8 Hz、200 mT的低频PEMF作用于体外培养的人卵巢癌SKOV3细胞株,观察PEMF对细胞膜电位和游离Ca2+浓度的影响,并进一步研究其是否影响细胞代谢活动,启动并产生后续的生物学效应,以探讨PEMF对肿瘤细胞的作用机制。
1 材料与方法 1.1 主要材料与实验仪器人卵巢癌SKOV3细胞株由重庆医科大学实验研究中心提供,RPMI1640培养基、胰蛋白酶和新生胎牛血清购自Gibco公司,维拉帕米为上海禾丰制药有限公司产品,Fluo-3/AM荧光探针购自碧云天公司,DiBAC4(3)荧光探针购自Sigma公司。激光共聚焦显微镜、流式细胞仪分别为美国BD公司的FACS-CALIBUR、德国Leica的TCS-SPZ。陡脉冲磁场样机为重庆大学输电装备与系统安全及新技术国家重点实验室自行开发,采用Tektronix TDS3032B实时动态检测脉冲波形,采用脉冲磁场(参数:频率8 Hz;磁场幅值200 mT;宽度10 μs;变化率5×104T/s;脉冲个数28 800;作用时间60 min)进行处理。
1.2 方法 1.2.1 细胞培养人卵巢癌SKOV3细胞株用RPMI1640完全培养基培养 (含10%新生胎牛血清,100 U/mL青霉素和100 U/mL链霉素)置于37 ℃、5%CO2饱和湿度孵育箱常规培养。2~3 d传代1次。
1.2.2 细胞内Ca2+浓度的测定实验分为3组: ①对照组:未接受磁场照射,不加入任何试剂; ②脉冲磁场组(PEMF组):将SKOV3细胞置于脉冲磁场发生器线圈中照射1 h; ③脉冲磁场+维拉帕米组(PEMF+VP组):给予磁场照射1 h,参考文献[11]中的药物干扰浓度,加入维拉帕米50 μmol/L。接种SKOV3细胞悬液(2×105/mL)于共聚焦专用培养皿中,待其贴壁后给予PEMF处理1 h。磁场暴露结束后,用终浓度为5 μmol/L fluo3 AM荧光探针标记细胞内Ca2+,37 ℃避光孵育60 min,PBS缓冲液洗涤3次,将负载好的细胞放在共聚焦显微镜载物台上,扫描参数为:①激发波长488 nm,发射波长530 nm;②扫描方式:XYZ;③扫描密度:1 024×1 024。每组选取3个视野拍照,每个视野圈定10个细胞计算平均荧光强度。采用LSCM定量分析软件进行图像分析与数据处理。
1.2.3 细胞膜电位的测定分组及处理同1.2.2,磁暴结束,加入DiBAC4(3)5 μmol/L,37 ℃避光负载30 min,激光共聚焦显微镜测定荧光强度。激发波长491 nm,发射波长516 nm。
1.2.4 细胞凋亡检测为深入探讨PEMF所引起的Ca2+浓度变化是否引起后续的生物学效应,通过流式细胞技术检测PEMF处理后肿瘤细胞的凋亡情况。于磁暴结束后收集对照组及PEMF组细胞,冷PBS洗涤2次,将细胞悬液依次加入5 μL Annexin V-FITC和10 μL PI。混匀后室温避光孵育15 min,上流式细胞仪分析检测。
1.3 统计学分析采用SPSS 17.0统计软件进行数据分析,实验数据为正态分布,所有数据方差具有齐同性。计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。
2 结果 2.1 磁场暴露对细胞游离Ca2+浓度的影响经PEMF作用1 h后,PEMF组细胞Ca2+荧光强度增高,其值为(122.24±3.87),对照组荧光强度较弱,其值为(91.18±4.91),两组比较差异有统计学意义(P < 0.01)。用维拉帕米干预后细胞荧光强度减弱,其值为(103.82±5.38),与其他2组比较,差异有统计学意义(P < 0.01,图 1)。
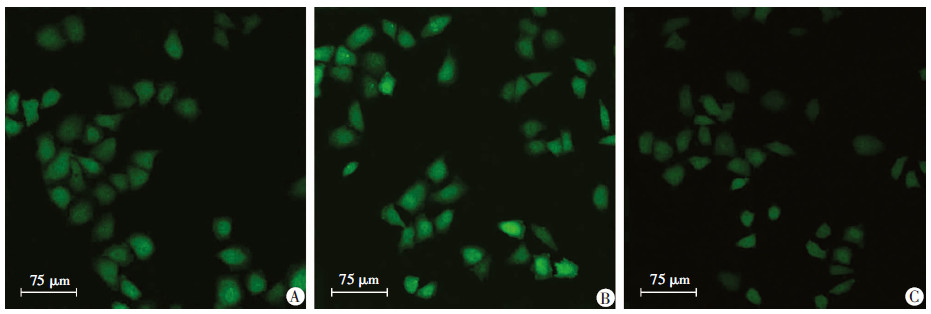 |
| A:对照组;B:PEMF组;C:PEMF+VP组 图 1 PEMF对SKOV3细胞游离Ca2+浓度的影响 (激光共聚焦显微镜) |
PEMF处理SKOV3细胞1 h后,细胞内膜电位平均荧光强度为(155.06±10.13),与对照组(113.07±7.62)比较增高,差异有统计学意义(P < 0.01)。PEMF+VP组荧光强度值为(150.09±7.91),与PEMF组比较,差异无统计学意义(P>0.05),与对照组比较,差异有统计学意义(P < 0.01,图 2)。
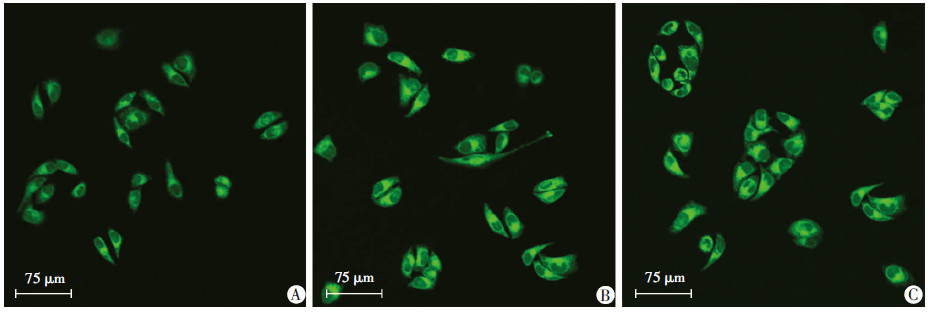 |
| A:对照组;B:PEMF组;C:PEMF+VP组 图 2 PEMF对SKOV3细胞膜电位的影响 (激光共聚焦显微镜) |
PEMF组的总凋亡率为(5.38±0.41)%,与对照组(4.47±0.81)%比较,差异无统计学意义(P>0.05,图 3)。
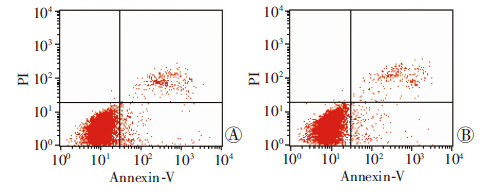 |
| A:对照组;B:PEMF组 图 3 PEMF作用后流式细胞仪检测细胞凋亡情况 |
细胞膜结构与功能的稳态是细胞执行正常生理功能的基础,细胞膜上离子通道的开放,跨膜信号的传导对细胞代谢起着重要的调控作用。细胞膜电位作为细胞膜最重要的生物物理特征之一,维持细胞膜两侧一定的电位梯度,对于多种离子的跨膜流动是必需的[12]。而Ca2+作为最重要的第二信使,在细胞内传导信号并调控一系列生命活动[13],参与细胞的多种病理生理过程[14]。细胞内Ca2+与肿瘤的增殖[15]、凋亡[16]、转移[17]等密切相关。本实验从磁场的生物电效应的角度出发,研究其对肿瘤细胞膜电位及Ca2+的影响,结果显示,PEMF能引起卵巢癌细胞内钙升高及细胞膜去极化,维拉帕米能部分阻断PEMF所引起的钙升高,而对其去极化效应无明显影响;我们还发现在本研究的实验条件下对凋亡没有明显的影响。
Fluo-3/AM为特异性Ca2+荧光探针,产生的荧光强度与Ca2+浓度呈正比,其平均荧光强度的变化反映出Ca2+浓度的变化情况。本实验通过Fluo-3/AM以显示Ca2+强度变化,发现磁场干预后Ca2+荧光强度增强,说明磁场作用引起了细胞内Ca2+浓度增加。胞质内钙的升高主要来源于两个方面:一是细胞外Ca2+内流;一是细胞内钙库的释放。而外钙内流的途径主要分为3类:电压依赖性钙通道、钙库调控钙离子通道、受体门控钙通道[18],电压依赖性钙通道是控制外钙内流的主要途径,分为L、N、T型。为进一步探索PEMF所引致的游离Ca2+浓度的来源,本实验加入了选择性L型钙通道阻滞剂维拉帕米。我们观察到加入维拉帕米后,Ca2+荧光强度较PEMF组减弱,但仍高于对照组,即磁场作用所引起的内钙增加可被维拉帕米部分阻断。因此我们推测:①PEMF所引致的内钙升高激活了电压依赖性钙通道,同时也可能激活了钙库调控钙离子通道及受体门控钙通道,导致钙内流增加;②PEMF所引起的钙内流增加部分源于L型钙离子通道,部分源于N、T型电压依赖性钙通道的开放;③胞内钙库的释放也参与了PEMF所引发的钙升高。究竟是哪一种因素占主导,抑或皆有之,尚需深入研究。
DiBAC4(3)是一种膜电位敏感的亲脂性阴离子荧光染料,根据其在细胞内外的分布,间接反映细胞膜电位的变化。当DiBAC4(3)进入细胞内时,荧光强度增加,表明细胞膜负值减小,出现去极化改变;反之,当DiBAC4(3)进入细胞内减少时,荧光强度减弱,表明细胞膜电位负值增加,发生了超极化。本实验中我们注意到PEMF处理后,DiBAC4(3)荧光强度增强,表明PEMF诱导细胞发生去极化,其原因可能是磁场对运动电荷的洛仑磁力影响细胞膜对带电粒子的通透性,Na+、K+、Ca2+等阳离子内流增多,内向电流使膜内电位负值减小,引起细胞膜去极化。本研究中我们还观察到加入钙通道阻断剂维拉帕米干预后,细胞膜电位荧光强度较PEMF组无明显差异,维拉帕米对PEMF的去极化作用无显著影响,表明PEMF的去极化效应可能主要不是由于Ca2+内流所引起的,即Ca2+内流不是影响PEMF所引起的去极化改变的主要因素。
生物膜具有跨膜信号转导的功能,包括化学信号与电信号,电信号的跨膜转导将引起膜电位的变化。在外加电磁刺激下,细胞膜电位与细胞内钙信号之间存在密切联系。细胞膜去极化可激活电压依赖性钙通道开放,引起钙内流;同时,钙内流也可能影响细胞膜电位,导致去极化。本实验中我们发现PEMF引发了钙内流及细胞膜去极化,而钙内流对细胞膜的去极化效应无明显影响。由此我们认为细胞膜去极化为启动因素,而Ca2+内流为继发事件,即PEMF首先通过作用于细胞膜引起细胞膜发生去极化改变,当去极化达到一定水平后,激活电压依赖性钙离子通道开放,导致细胞外Ca2+内流。
诱导肿瘤细胞凋亡,抑制其生长是肿瘤治疗的主要途径[19]。研究表明,Ca2+与肿瘤细胞的凋亡密切相关[14]。细胞内游离Ca2+的升高被认为是凋亡的启动环节,从而激活DNA内切酶,启动凋亡程序,诱导细胞凋亡[20]。研究发现,暴露于6 mT的静磁场可引起胞内钙升高而诱导人外周血白血病T细胞凋亡[21]。而本实验中,PEMF诱导Ca2+浓度增加,却并未引起凋亡,我们推测其可能的机制主要有两点:①PEMF所引起的Ca2+浓度增加并未达到导致凋亡的Ca2+浓度水平与时间。研究发现,细胞对Ca2+升高的反应,取决于钙信号持续的时间与强度,长时间高浓度的Ca2+升高将诱导细胞凋亡[22];②细胞内各种反馈调节机制又将升高的钙降至静息状态水平,维持细胞内环境稳态。胞内Ca2+浓度升高后,肌质网或内质网钙泵可将Ca2+重新摄回到肌质网或内质网内,同时质膜钙泵也可将升高的Ca2+由胞质内转运至胞外。另外,质膜的Na+-Ca2+交换途径亦可将升高的钙跨膜转运至胞外。由于本实验中所采用的陡脉冲磁场样机存在一定的限制,暂不能同时进行多组磁场参数的干预处理,故不同参数的PEMF处理后细胞内Ca2+、细胞膜电位的变化及其与细胞凋亡的关系尚待进一步研究。
综上所述,本实验通过研究PEMF对卵巢癌细胞内Ca2+及膜电位的影响,对PEMF作用于肿瘤细胞的机制有了初步了解,为基于磁聚焦的高陡度脉冲磁场无创治疗肿瘤技术提供了理论依据。PEMF可通过作用于卵巢癌细胞,使细胞膜发生去极化,从而激活电压依赖型钙通道,引起胞外Ca2+内流及胞内钙升高。PEMF无创治疗肿瘤技术尚处于起步阶段,其诸多领域仍需大量探索与研究。
| [1] | Saliev T, Tachibana K, Bulanin D, et al. Bio-effects of non-ionizing electromagnetic fields in context of cancer therapy[J]. Front Biosci (Elite Ed), 2014, 6:175-184. |
| [2] | Wang Y, Qin Q H. A theoretical study of bone remodelling under PEMF at cellular level[J]. Comput Methods Biomech Biomed Engin, 2012, 15(8):885-897. |
| [3] | Iannitti T, Fistetto G, Esposito A, et al. Pulsed electromagnetic field therapy for management of osteoarthritis-related pain, stiffness and physical function:clinical experience in the elderly[J]. Clin Interv Aging, 2013, 8:1289-1293. |
| [4] | Rikk J, Finn K J, Liziczai I, et al. Influence of pulsing electromagnetic field therapy on resting blood pressure in aging adults[J]. Electromagn Biol Med, 2013, 32(2):165-172. |
| [5] | Crocetti S, Beyer C, Schade G, et al. Low intensity and frequency pulsed electromagnetic fields selectively impair breast cancer cell viability[J]. PLoS One, 2013, 8(9):e72944. |
| [6] | Markov M S. Expanding use of pulsed electromagnetic field therapies[J]. Electromagn Biol Med, 2007, 26(3):257-274. |
| [7] | Balcavage W X, Alvager T, Swez J, et al. A mechanism for action of extremely low frequency electromagnetic fields on biological systems[J]. Biochem Biophys Res Commun, 1996, 222(2):374-378. |
| [8] | Wang T, Nie Y, Zhao S, et al. Involvement of midkine expression in the inhibitory effects of low-frequency magnetic fields on cancer cells[J]. Bioelectromagnetics, 2011, 32(6):443-452. |
| [9] | Sullivan K, Balin A K, Allen R G. Effects of static magnetic fields on the growth of various types of human cells[J]. Bioelectromagnetics, 2011, 32(2):140-147. |
| [10] | 王谦, 吴文超, 陈晓莹, 等. 不同频率脉冲电磁场对人卵巢癌SKOV3细胞增殖、凋亡及迁移的影响[J]. 生物医学工程学杂志, 2012, 29(2):291-295. |
| [11] | 金春华, 赵克森, 刘杰. 虎杖甙对休克大鼠微血管平滑肌细胞内钙、pH和膜电位的影响[J]. 中国病理生理杂志, 1998, 14(3):334. |
| [12] | Jin S M, Lazarou M, Wang C, et al. Mitochondrial membranepotential regulates PINK1 import and proteolytic destabilization by PARL[J]. J Cell Biol, 2010, 191(5):933-942. |
| [13] | Russell J T. Imaging calcium signals in vivo:a powerful tool in physiology and pharmacology[J]. Br J Pharmacol, 2011, 163(8):1605-1625. |
| [14] | Yi M, Zhao Q, Tang J, et al. A theoretical modeling for frequency modulation of Ca(2+) signal on activation of MAPK cascade[J]. Biophys Chem, 2011, 157(1/3):33-42. |
| [15] | Guilbert A, Gautier M, Dhennin-Duthille I, et al. Evidence that TRPM7 is required for breast cancer cell proliferation[J]. Am J Physiol Cell Physiol, 2009, 297(3):C493-C502. |
| [16] | Sun S, Li W, Zhang H, et al. Requirement for store-operated calcium entry in sodium butyrate-induced apoptosis in human colon cancer cells[J]. Biosci Rep, 2012, 32(1):83-90. |
| [17] | Wei C, Wang X, Chen M, et al. Calcium flickers steer cell migration[J]. Nature, 2009, 457(7231):901-905. |
| [18] | Fernandez R A, Sundivakkam P, Smith K A, et al. Pathogenic role of store-operated and receptor-operated Ca(2+) channels in pulmonary arterial hypertension[J]. J Signal Transduct, 2012, 2012:951497. |
| [19] | Pathania D, Millard M, Neamati N. Opportunities in discovery and delivery of anticancer drugs targeting mitochondria and cancer cell metabolism[J]. Adv Drug Deliv Rev, 2009, 61(14):1250-1275. |
| [20] | Uguz A C, Naziroglu M, Espino J, et al. Selenium modulates oxidative stress-induced cell apoptosis in human myeloid HL-60 cells through regulation of calcium release and caspase-3 and -9 activities[J]. J Membr Biol, 2009, 232(1/3):15-23. |
| [21] | Ahmadianpour M R, Abdolmaleki P, Mowla S J, et al. Static magnetic field of 6 mT induces apoptosis and alters cell cycle in p53 mutant Jurkat cells[J]. Electromagn Biol Med, 2013, 32(1):9-19. |
| [22] | Apati A, Janossy J, Brozik A, et al. Effects of intracellular calcium on cell survival and the MAPK pathway in a human hormone-dependent leukemia cell line (TF-1)[J]. Ann N Y Acad Sci, 2003, 1010:70-73. |



