青光眼、视网膜血管阻塞、糖尿病性视网膜病变等视网膜缺血性疾病均会导致神经节细胞的死亡。视网膜作为中枢神经系统的一部分,神经节细胞凋亡是不可再生的。如何保护视网膜神经节细胞是眼科研究中重要的课题。已有报道在中枢神经系统中大麻素对神经细胞有保护作用,也有研究提出激活内源性大麻素CB1受体可以对大鼠视网膜有神经保护作用。我们着重研究人和动物模型的大麻素功能性表达的差异,以期评价用小鼠做模型动物对人类视网膜大麻素神经保护研究的意义。
大麻素(cannabinoids)是从桑科植物大麻中发现的,而我们机体本身就有大量内源性的大麻素表达。大麻素通过结合大麻素受体,发挥其下游的作用。内源性大麻素(endocannabinoid,eCB),即大麻素受体的内源性配体,在神经保护方面有重要的作用[1]。大麻素的受体(cannabinoid receptor)分为CB1和CB2这两个亚型,CB1受体作为第一个被克隆的大麻素受体,在神经系统的特定区域有高表达。同时,在不同种属如小鼠、大鼠、金鱼、蝾螈、猴子、鸡视网膜中,CB1受体在外网状层和内网状层均有表达[2]。在脊椎动物中,CB1受体可以影响双极细胞的钙通道活性和神经节细胞突触递质的传递[3]。有研究提出激活内源性大麻素CB1受体可以对视网膜产生神经保护作用[4]。在青光眼动物模型上的相关研究表明,CB1受体激动剂可以抵抗神经节细胞的兴奋性谷氨酸毒性作用,缓解由高眼压造成的神经节细胞数目的减少[5]。在本研究中,我们采用膜片钳技术和免疫荧光的方法,对人和小鼠视网膜上CB1受体的分布情况及激活大麻素受体后对神经节细胞的GABA电流调控进行研究。本研究不仅可以为视网膜神经节细胞的神经保护方法提供新思路,也可为今后用动物模型的方法研究人的视网膜疾病提供理论依据。
1 材料与方法 1.1 材料 1.1.1 材料来源动物来源:3~5周雄性C57小鼠10只,由武汉大学人民医院动物中心提供,批准号:SCXK鄂20140004;人视网膜来源:取角膜移植术后正常供体眼球4只(由武汉大学人民医院眼库提供)。相关操作获得医院伦理委员会批准。
1.1.2 主要试剂和仪器γ-氨基丁酸(γ-amino-butyric acid,GABA);大麻素受体激动剂 WIN55212-2(CB1受体激动剂);SR141716A(特异性CB1受体拮抗剂),以上药品均购自Sigma公司。小鼠抗CB1多克隆抗体(Abnova公司); FITC标记的驴抗小鼠IgG(谷歌生物公司,1 ∶100稀释);冰冻切片机(德国Leica公司);正置荧光显微镜(日本Olympus公司);微电极拉制仪(日本Narishige公司);组织切片机(Stoelting公司);EPC 10放大器(德国 HEKA公司);快速加药系统(Picrospritzer,美国General Valve公司);CCD摄像机(Photometrics CoolSNAPTM ES2)。
1.2 方法将角移术后的正常眼球,迅速解剖去除眼前节,去除玻璃体,取部分视网膜用于薄片膜片钳研究,剩余的眼杯转移至10倍眼球体积的4%多聚甲醛中室温固定12 h。更换新鲜固定液,继续固定12 h。视网膜样本经梯度蔗糖脱水后,OCT包埋速冻。取垂直视网膜面,以14 μm厚度进行冰冻切片。染色前5% BSAT室温封闭2 h。加以BSAT适当稀释的一抗(CB1,1 ∶200),湿盒中4 ℃冰箱过夜。PBST缓慢摇动清洗3次,每次10 min。滴加BSAT稀释的FITC标记驴抗鼠二抗,室温避光孵育1.5 h。PBST避光摇动清洗3次,每次10 min。DAPI染核30 min,PBST洗涤后封片。避光晾干,封片后对视网膜组织进行观察,正置荧光显微镜采集成像。
分别取角膜移植术后24 h内的人或3~5周雄性C57小鼠眼球,浸入持续充氧低温保存的细胞外液。去除眼球内的玻璃体,剪下一小块视网膜倒扣在微孔滤膜上(美国Millipore公司,孔径0.22 μm)(神经节细胞向下),加入少量Ringer’s,用手动切片机(Stoelting公司)将视网膜切成100~150 μm厚的薄片。采用全细胞膜记录模式,将玻璃微电极吸附于细胞膜上,形成高阻封接后,负压吸破膜片,记录整个细胞膜上的离子通道电流。玻璃微电极用微电极拉制仪行两步拉制而成。记录电极入水后阻抗为5~7 MΩ,破膜后串联电阻为 5~20 MΩ。采用HEKA EPC10放大器,2 kHz低通滤波后用Patchmaster和Igor进行数据采集和分析。细胞外液Ringer’s成分(μmol/L):140 NaCl,5 KCl,2 CaCl2,20 HEPES,1 MgCl2,10 Glucose,用NaOH 调 pH 7.3~7.4,渗透压295~305 mOsm/L。细胞内液成分(μmol/L):145 CsCl,10 HEPES,0.5 EGTA,4 ATP,1 GTP (用CsOH调 pH 7.3)。
1.3 统计学分析实验数据以Patchmaster和IGOR软件处理,计量资料以 ±s表示,以SPSS 16.0软件进行统计学分析,分别对上升时间、下降时间和峰值等进行t检验。为定量分析反应动力学、激活、失活的速度用拟合时间常 数τ计量,曲线拟合用最小方差法,你和方程为:A(t)= A×exp[-(t-k)/τ]+y0,A为电流幅值,y0为补偿值,τ为拟合时间常数,方程为单指数函数。
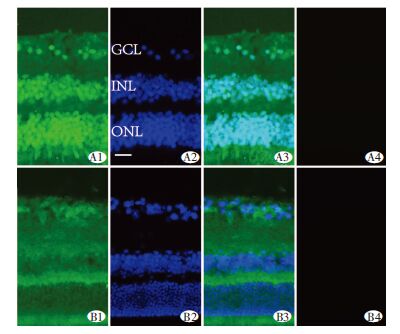
2 结果 2.1 免疫荧光染色检测视网膜大麻素受体表达结果对人和C57小鼠视网膜垂直冰冻切片进行免疫荧光染色双标,观察CB1受体与DAPI标记的细胞共定位的情况(图 1)。CB1受体的荧光信号(绿色)广泛分布于视网膜。在人的视网膜的荧光染色上,CB1 受体免疫荧光信号较强,且与视网膜DAPI蓝色信号有重叠。可见CB1受体在人视网膜神经节细胞层(ganglion cell layer,GCL)、内核层(inner nuclear layer,INL)和外核层(outer nuclear layer,ONL)的细胞胞体均有表达;但在小鼠视网膜CB1受体的荧光染色和DAPI没有明显重叠,CB1荧光主要分布在视网膜的内丛状层(inner plexiform layer,IPL)和外丛状层(outer plexiform layer,OPL)。在省去CB1一抗的情况下,视网膜完全没有荧光染色,提示观察到的CB1的荧光染色不是来自于视网膜的自发荧光,或非特异性染色。
|
| A1~A4、B1~B4:分别为人和小鼠视网膜免疫荧光标记;A1、B1:视网膜的CB1表达;A2、B2:DAPI为标示细胞核的蓝色荧光染料;A3、B3:显示了CB1受体在视网膜神经元上共表达的情况;A4、B4:为省去一抗后的阴性对照;GCL:神经节细胞层,INL:内核层,ONL:外核层 图 1 大麻素受体在人和小鼠视网膜的表达 |
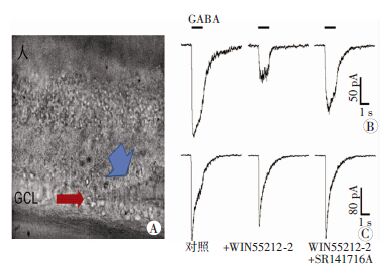
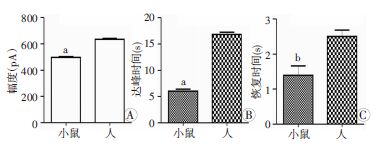
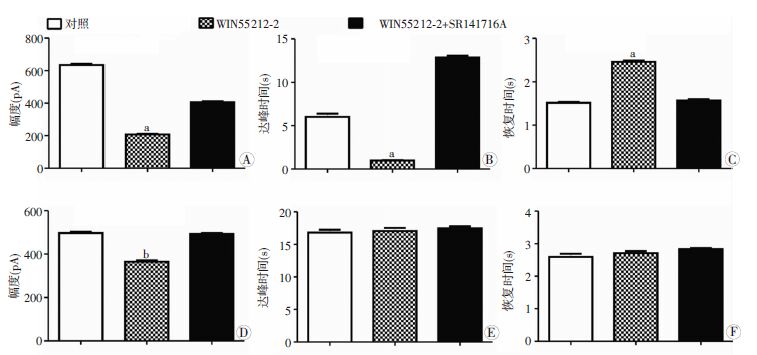
在显微镜下视网膜的分层结构层次清楚。图 2A中显示的是明场条件下电极正在钳制的一个神经节细胞。我们记录100 μmol/L GABA 诱导的电流(IGABA),与孵育大麻素受体激动剂WIN55212-2 后或同时孵育激动剂和拮抗剂(WIN 55212-2+SR141716A)的情况下所得GABA电流进行比较(图 2B、C)。当比较了人和小鼠神经节细胞上的GABA电流差异后,我们发现人和鼠的GABA电流幅度、达峰时间及下降时间均有显著性差异(P<0.05,图 3)。此外,大麻素受体的激动剂WIN55212-2对人和鼠的GABA电流都有抑制性作用。在孵育2 μmol/L WIN55212-2后,GABA电流较人和小鼠正常对照组电流幅度均有显著减小(P<0.05),且大麻素受体拮抗剂可以翻转该作用(图 4)。这表明WIN55212-2能特异性的抑制GABA电流。
|
| A:明场下拍摄的电极钳制的神经节细胞,红色箭头指向节细胞,蓝色箭头指向记录电极;B、C:分别为在人和小鼠视网膜神经节细胞上记录的100 μmol/L GABA诱导的全细胞电流,在孵育2 μmol/L WIN 55212-2 作用下的IGABA,以及在同时孵育2 μmol/L WIN 55212-2+4 μmol/L SR141716A作用下的GABA电流,钳制电压为-60 mV 图 2 WIN55212-2对人和小鼠视网膜神经节细胞GABA电流的抑制性作用 |
|
| A:电流幅度;B:电流达峰时间;C:电流恢复时间;a:P<0.01,b:P<0.05,与人比较 图 3 人和小鼠视网膜神经节细胞上记录的GABA电流观察 (小鼠n=6,人 n=4) |
|
| A~C:分别为人视网膜神经节细胞在孵育WIN以后的GABA电流幅度、达峰时间、恢复时间(n=4);D~F:分别为小鼠视网膜神经节细胞在孵育WIN以后的GABA电流幅度、达峰时间、恢复时间(n=6);a:P<0.01,b:P<0.05,与对照比较 图 4 孵育WIN55212-2对人和小鼠GABA电流的作用 |
进一步,我们对GABA电流的动力学即达峰时间和下降时间进行分析。电流动力学拟合公式为:A(t)= A×exp[-(t-k)/τ]+y0,A为电流幅值,y0为补偿值,τ为拟合时间常数,方程为单指数函数。统计结果显示,对小鼠而言,WIN55212-2激活大麻素受体后对GABA电流的反应动力学并无明显影响(n=6,P>0.05);但是我们发现在人视网膜神经节细胞上,WIN55212-2在减小GABA电流幅度的同时,还显著改变了GABA电流的反应速度。GABA电流达峰时间较正常对照组明显延长(n=4,P<0.05),电流的恢复时间也较正常组有明显缩短(n=4,P<0.05,图 4)。
3 讨论
内源性大麻素在中枢神经系统(CNS)中广泛表达[6],大麻素通过激活G蛋白耦联的大麻素受体,产生细胞内的级联反应,如抑制腺苷酸环化酶(cAMP),关闭K+通道[7],从而调控神经元的功能[8]。在视网膜中同样也有大麻素受体的表达[9]。当大麻素在 CNS神经保护作用研究日益深入的同时,在视网膜中 的研究仍然非常有限。有研究表明激活内源性大麻素CB1受体可以对视网膜产生 神经保护作用[4]。在青光 眼动物模型上发现,CB1受体激动剂可以减少神经节细胞的兴奋性谷氨酸毒性作用,缓解由高眼压造成的神经节细胞数目的减少[5]。研究大麻素在神经节细胞上功能性表达是阐明大麻素保护性作用的关键。为此,我们开展了旨在针对大麻素的功能性表达及对视觉信号调制作用的研究。我们选择了在神经节细胞上,观察大麻素受体激动后对γ-氨基丁酸(GABA)电流的调制作用。γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种重要的抑制性神经递质,通过激活GABA受体产生抑制性的突触后电流[10]。视网膜神经节细胞上的GABA 受体介导了视觉抑制性信号的输入,在调节视觉信号的信噪比(S/N),产生神经节细胞拮抗性中心周围感受野等有重要的作用[11]。研究大麻素受体对GABA电流的调制有利于我们了解大麻素是如何参与视网膜基本视觉信号的调节作用。
在大鼠视网膜神经节细胞上也观察到了CB1受体的表达[13],分布情况和我们在小鼠上观察到的分布情况非常类似。有研究显示激活视网膜的CB1受体后,可通过对离子通道的抑制作用来调控对光信号的加工和处理[12]。在大鼠神经节细胞上,WIN55212-2可抑制神经节细胞K+外流[14, 15],并可呈浓度依赖性地压抑高电压激活的钙离子通道电流[16]。在我们实验中,我们观察到激活CB1受体对人和小鼠神经节细胞的GABA电流均有抑制作用。 由于我们用的是外源性的GABA,所以观察到的大麻素对神经节细胞GABA电流幅度的抑制作用不可能是通过突触前抑制,即突触前的无长突细胞的CB1受体被激活后,导致突触前GABA囊泡释放减少[17];更可能是大麻素作用在突触后细胞即神经节细胞本身。我们还观察到激活大麻素受体可降低人视网膜神经节细胞GABA电流的反应速度,而小鼠神经节细胞GABA电流的反应速度没有明显改变,提示人和小鼠在对光反应信号通路上有种属差异性。具体原因和机制急需进行下一步的研究。
通过对人和小鼠视网膜神经节细胞的GABA电流的对比研究,可对今后通过动物模型研究人类疾病起到指导性作用。我们的结果也有助于理解视觉信息在视网膜的加工及处理,以期阐明大麻素受体系统对视网膜神经元保护的机制。
| [1] | Giacoppo S, Mandolino G, Galuppo M, et al. Cannabinoids: new promising agents in the treatment of neurological diseases[J]. Molecules, 2014, 19(11): 18781-18816. |
| [2] | Straiker A, Stella N, Piomelli D, et al. Cannabinoid CB1 receptors and ligands in vertebrate retina: localization and function of an endogenous signaling system[J]. Proc Natl Acad Sci U S A, 1999, 96(25): 14565-14570. |
| [3] | Middleton T P, Protti D A. Cannabinoids modulate spontaneous synaptic activity in retinal ganglion cells[J]. Vis Neurosci, 2011, 28(5): 393-402. |
| [4] | Xie S, Furjanic M A, Ferrara J J, et al. The endocannabinoid system and rimonabant: a new drug with a novel mechanism of action involving cannabinoid CB1 receptor antagonism——or inverse agonism——as potential obesity treatment and other therapeutic use[J]. J Clin Pharm Ther, 2007, 32(3): 209-231. |
| [5] | Nucci C, Gasperi V, Tartaglione R, et al. Involvement of the endocannabinoid system in retinal damage after high intraocular pressure-induced ischemia in rats[J]. Invest Ophthalmol Vis Sci, 2007, 48(7): 2997-3004. |
| [6] | Hashimotodani Y, Ohno-Shosaku T, Kano M. Endocannabinoids and synaptic function in the CNS[J]. Neuroscientist, 2007, 13(2): 127-137. |
| [7] | Araya K A, David-Pessoa-Mahana C, Gonzalez L G. Role of cannabinoid CB1 receptors and Gi/o protein activation in the modulation of synaptosomal Na+, K+-ATPase activity by WIN55, 212-2 and delta(9)-THC[J]. Eur J Pharmacol, 2007, 572(1): 32-39. |
| [8] | Yazulla S. Endocannabinoids in the retina: from marijuana to neuroprotection[J]. Prog Retin Eye Res, 2008, 27(5): 501-526. |
| [9] | McMahon D G, Iuvone P M, Tosini G. Circadian organization of the mammalian retina: from gene regulation to physiology and diseases[J]. Prog Retin Eye Res, 2014, 39: 58-76. |
| [10] | Li Z W, Zhang J, Ouyang C H, et al. Potentiation by WIN 55, 212-2 of GABA-activated currents in rat trigeminal ganglion neurones[J]. Br J Pharmacol, 2009, 158(8): 1904-1910. |
| [11] | Yang X L, Gao F, Wu S M. Modulation of horizontal cell function by GABA(A) and GABA(C) receptors in dark- and light-adapted tiger salamander retina[J]. Vis Neurosci, 1999, 16(5): 967-979. |
| [12] | Schlicker E, Timm J, Gothert M. Cannabinoid receptor-mediated inhibition of dopamine release in the retina[J]. Naunyn Schmiedebergs Arch Pharmacol, 1996, 354(6): 791-795. |
| [13] | 汪书越, 李玲竹, 苗艳颖, 等. 大麻素受体在大鼠视网膜中的表达和分布[J]. 中国眼耳鼻喉科杂志, 2014, 14(4): 205-210. |
| [14] | Wang X H, Wu Y, Yang X F, et al. Cannabinoid CB1 receptor signaling dichotomously modulates inhibitory and excitatory synaptic transmission in rat inner retina[J]. Brain Struct Funct, 2014, [Epub ahead of print]. |
| [15] | Zhang C Q, Wu H J, Wang S Y, et al. Suppression of outward K+ currents by WIN55212-2 in rat retinal ganglion cells is independent of CB1/CB2 receptors[J]. Neuroscience, 2013, 253: 183-193. |
| [16] | Lalonde M R, Jollimore C A, Stevens K, et al. Cannabinoid receptor-mediated inhibition of calcium signaling in rat retinal ganglion cells[J]. Mol Vis, 2006, 12: 1160-1166. |
| [17] | Katona I, Freund T F. Endocannabinoid signaling as a synaptic circuit breaker in neurological disease[J]. Nat Med, 2008, 14(9): 923-930. |



