2 271000 山东 泰安,解放军第88医院全军肝病诊治中心
2Diagnosis and Treatment Center for Liver Diseases, No. 88 Hospital of PLA, Tai’an, Shandong Province, 271000, China
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是终末期肝病的重要原因。机体的免疫状态对HBV感染的结局起决定作用[1]。抗HBV免疫以细胞免疫为主,IL-12、IL-1B、IL-17在抗HBV免疫应答中处于核心环节[2, 3, 4]。HBeAg血清学转换是抗病毒疗效满意应答的标志,越早实现HBeAg血清学转换,肝癌发生率 越低[5, 6],但目前无论干扰素还是核苷类似物抗病毒治疗应答率仅20%~40%[7]。遗传因素是疾病发生的重要因素之一[8],核苷类似物抗病毒治疗获得HBeAg血清学转换人群的遗传背景尚缺乏深入的研究。本研究通过IL-12A、IL-1B、IL-17A基因多态性与HBeAg血清学转换的关联研究,以探讨慢性乙型肝炎恩替卡韦抗病毒治疗HBeAg血清学转换的遗传背景,旨在为更好地预测疗效和制定个体化的治疗方案提供依据。
1 资料与方法 1.1 一般情况选取2010年10月至2011年8月第三军医大学西南医院全军感染病研究所门诊慢性乙型肝炎患者109例,其中男性80例,女性29例,年龄(32.9±11.5)岁。给予恩替卡韦0.5 mg/d抗病毒治疗。所有患者签署书面知情同意书。本研究经第三军医大学西南医院伦理委员会批准同意。
1.2 纳入标准和排除标准纳入标准:①符合全国慢性乙型病毒性肝炎诊断标准[6];②HBsAg阳性超过6个月,HBeAg阳性,抗- HBe阴性;③谷丙转氨酶(ALT)>2×ULN以上;④HBV DNA >1×10 5IU/L。排除标准:①重叠感染HAV、HCV、HDV、HEV、HIV、CMV、EBV;②合并严重内科疾病或精神疾病;③器官、骨髓移植术后;④接受过糖皮质激素、免疫抑制药物、化疗药物等治疗。
1.3 随访及应答类型界定每3个月进行肝功能、乙肝标志物、HBV DNA检测,进行HBeAg血清学转换评估,治疗24个月时的应答情况作为判定应答与否的标准。发生HBeAg血清学转换者为应答组;未发生HBeAg血清学转换者为无应答组。
1.4 血清学检测全自动电化学发光免疫分析仪(Architect i2000 免疫发光检测系统,Abbott公司,美国)测定HBsAg、HBsAb、HBeAg、HBeAb和HBcAb;LightCycler 荧光定量 PCR 仪(480,Roche 公司,瑞士)测定血清HBV DNA;全自动生化分析仪(日立7020)测定血清ALT水平。
1.5 SNP位点基因分型EDTA抗凝管收集患者全血标本。取抗凝血细胞200 μL,用QuickGene全血DNA试剂盒(QuickGene-810,FUJIFILM,日本)自动提取全血DNA,提取的DNA保存于-20 ℃备用。采用Haploview计算LD模块,选取代表性的SNP位点,其中选取IL-12A rs568408、IL-1B rs1143623、IL-17A rs8193036为待测SNP位点。位点信息:rs568408[G/A,3′-UTR_exon7,MAF(HapMap-HCB) 0.122];rs1143623[C/G,5′-flanking,MAF(HapMap-HCB)0.386]; rs8193036[C/T,5′-flanking,MAF (HapMap-HCB) 0.310]。iMLDR进行基因分型(iMLDR多重SNP分型试剂盒,上海天昊生物科技有限公司,上海)。步骤如下:①样本标准化:DNA样本稀释到工作浓度5~10 ng/μL。②多重PCR反应:多重PCR引物混合物1 μL以及2×PCR Master mix 5 μL 与1 μL样本 DNA,3 μL ddH2O混匀。③引物设计:先用Smart Primer Designer 设计,然后再用Check Multiplex Primers核对,确保引物之间不冲突。④引物序列,rs568408上游:5′-AAAAAGCGAGGTCCCTCCA-AAC-3′,下游:5′-CCCTTCTTAGCAATTCATTCATGAA-AAC-3′;rs1143623上游:5′-TTGCTGCTTGAATGGGTGAATG-3′,下游:5′-AAAAATCAGAAGGCTGCTTGGAGA-3′;rs8193036上游:5′-CCCTGCATGCTACCAAGC-AACT-3′,下游:5′-CCCTGCATGCTACCAAGCAACT-3′。PCR循环程序:95 ℃ 2 min;94 ℃ 20 s,65~0.5 ℃/循 环40 s,72 ℃ 90 s,11个循环;94 ℃ 20 s,59 ℃ 30 s,72 ℃ 90 s,24个循环;72 ℃ 2 min;4 ℃保存。多重 PCR产物纯化:在PCR产物中加入试剂盒中的 ExoⅠ/SAP酶1 μL,37 ℃ 1 h,75 ℃灭活15 min。 ⑤双连接反应:10×连接缓冲液2 μL、高温连接酶0.2 μL、连接引物混合1 μL与纯化后多重PCR产物3 μL、ddH2O 3.8 μL混匀。连接程序:94 ℃ 1 min,56 ℃ 4 min,38个循环;4 ℃保存。双反应引物rs568408RG:TCTCTCGG-GTCAATTCGTCCTTCACAGT AAATGTCAAAAATACTTG-ATCAGAGGTCTC;rs568408RA:TGTTCGTGGGCCGGATTAGTCACAGTAAATGTCAAAAATACTTGATCAGA -GGTCTT;rs568408RP:ATGTGGATGTAATGTCCCATCCTTCTTTTTTTTT;rs1143623RG:TTCCGCGTTCGGACTGATATGCACAGAGGCTCACTCCCTAGC;rs1143623RC:TACGGTTATTCGGGCTCCTGTGCACAGAGGCTCACTC-CCTAGG;rs1143623RP:ATAATGCAGAGCGAGCACG-ATACCTTTTTTT;rs8193036RG:TCTCTCGGGTCAATTCGTCCTTCACAGTAAATGTCAAAAATACTTGATCAG-AGGTCTC;rs8193036RA:TGTTCGTGGGCCGGATTAG-TCACAGTAAATGTCAAAAATACTTGATCAGAGGTCTT;rs8193036RP:ATGTGGATGTAATGTCCCATCCTTCTTT- TTTTTT。⑥连接产物上ABI 3130XL测序仪:取0.5 μL 稀释后的连接产物,与0.5 μL Liz 500 Size Standard,9 μL Hi-Di混匀,95 ℃变性5 min后上ABI 3130XL测序仪。⑦ABI 3130XL测序仪上收集的原始数据采用GeneMapper 4.1(Applied Bio-systems,USA)进行分析。
1.6 统计学分析采用SPSS 18.0统计软件,Kolmogorov-Smirnov检验正态分布;正态分布资料以x±s表示,t检验比较差异;非正态分布资料以中位数(Q25~Q75)表示,非参数检验比较差异;χ2检验比较频率。在线SNP分析工具SNPStats(http://bioinfo.iconcologia.net/snpstats/start.htm)分析等位基因频率、基因型频率、Hardy-Weinberg 平衡校验、包含Codominant(共显性)、Dominant(显性)、Recessive(隐性)在内的多种遗传模型分析,相关因素校正分析等,取P值最小值为最佳遗传模式。
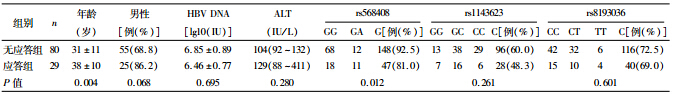
2 结果 2.1 治疗24个月时应答组与无应答组的基线比较109例慢性乙型肝炎患者经24个月的恩替卡韦治疗,29例获得HBeAg血清学转换(应答组),80例未获得HBeAg血清学转换(无应答组),总体应答率26.6%。两组的基线特征比较见表 1。两组之间,仅年龄分布存在显著差异(P=0.004),治疗前ALT水平、HBV DNA水平、性别比例等均无统计学差异(P>0.05)。因此,年龄作为一个干扰因素纳入校正分析,并对IL-12A rs568408位点与24个月HBeAg血清学转换应答进行Kaplan-Meire LogRank分析[OR=2.34(43.414~52.586),P=0.036],说明不同基因型之间年龄存在差异,也证明在本研究中年龄存在差异是合理的。rs568408在109例患者中没有观察到AA基因型。分别按照全部病例、无应答组、应答组进行Hardy-Weinberg平衡校验结果显示,rs568408、rs1143623、rs8193036均符合Hardy-Weinberg分布(全部病例:rs568408 P=0.60;rs1143623 P=1.00; rs8193036 P=0.81;应答组:rs568408 P=0.55; rs1143623 P=0.72;rs8193036 P=0.64;无应答组:rs568408 P=1.00;rs1143623 P=1.00;rs8193036 P=0.81)。
在校正了年龄因素后,对3个候选SNP位点的分析发现仅IL-12A rs568408与HBeAg消失、HBeAg血清学转换存在关联,以共显性模型关联最为显著,GA基因型发生 HBeAg血清学转换的易感性显著高于GG基因型[OR=0.31(0.11~0.91),P=0.038;OR=3.72(1.34~10.32),P=0.012]。无论何种遗传模式,均未发现IL-1B rs1143623基因型和IL-17A rs8193036 基因型与HBeAg消失、HBeAg血清学转换存在关联。rs1143623以显性模型差异最显著[OR=1.99(0.72~5.44),P=0.17];rs8193036以隐性模型差异最显著 [OR=1.54(0.32~7.33),P=0.60]。本研究发现IL-1B rs1143623与HBV DNA抑制相关,以隐性模型差异最为显著[OR=4.47(1.35~14.84),P=0.01]。无论何种遗传模式,未发现rs568408、rs8193036与HBV DNA抑制相关,也未发现3个候选SNP位点与ALT复常存在关联(表 2)。
HBeAg血清学转换是慢性乙型肝炎抗病毒治疗应答程度的核心评价,也是能否停药的重要标志。不同个体的遗传背景可影响自身对药物治疗的反应性,HLA基因多态性与干扰素抗病毒治疗应答存在关联,深入探讨HBeAg血清学转换的遗传背景对慢性乙型肝炎的个体化治疗具有一定的临床意义。目前尚缺乏慢性HBV感染免疫相关重要细胞因子IL-12、IL-1B、IL-17等基因多态性与慢性乙型肝炎应答的关联研究,特别是核苷类似物治疗。本研究以慢性HBV感染中关键的细胞因子基因多态性为切入点,以HBeAg血清学转换作为应答评判标准,通过病例-对照遗传关联研究探讨核苷类似物治疗慢性乙型肝炎应答差异的遗传背景,为个体化治疗提供新的思路。
恩替卡韦抗病毒治疗慢性乙型肝炎应答率高,变异率低[9],可以减少慢性乙型肝炎患者肝癌的发病率和逆转肝纤维化或肝硬化的发生[10],是推荐应用的一线抗HBV药物之一[11]。本研究选取治疗24个月为HBeAg血清学转换判定的时间节点,可以涵盖90%以上的HBeAg血清学转换病例。Luo等[12]在长期的恩替卡韦治疗随访研究中发现1、2、3年的病毒学应答率分别是85.2%、89.9%、92.9%;ALT复常率分别为78.4%、88.4%、71.4%;HBeAg血清学转换率在随访1、2、3年分别是15.9%、21.7%和21.4%。
本研究发现IL-12A rs568408与HBeAg血清学转换显著关联。IL-12A编码IL-12的p35亚基。IL-12能诱导Th1细胞分化,促进γ干扰素产生,并在固有免疫和获得免疫之间建立起重要联系[13],处于Th1免疫过程的中心地位[14]。研究发现IL-12与细胞毒T淋巴细胞对HBV感染肝细胞的溶细胞破坏和γ干扰素抗病毒效果有关[15],是参与诱导免疫反应与病毒性感染(特别是HBV)中的一个主要细胞因子。血清IL-12水平可作为HBV感染的细胞免疫评估标记,IL-12水平升高是HBeAg血清学转换的促进因素[16]。IL-12A rs568408 位于保守区,它可能影响了外显子剪切增强子以及 miRNA 的结合,从而影响IL-12水平的表达。研究发现IL-12A rs568408与子宫癌[17]、骨肉瘤[18]、哮喘[19]等存在着遗传关联。Wu等[20]研究发现IL-12B-10993 C/G基因型能预测体外HBcAg刺激外周血单个核细胞分泌更高水平的IL-12,高水平的血清IL-12与早期自发HBeAg血清学转换相关。本研究发现rs568408与HBeAg血清学转换显著关联,提示其不同的基因型可能通过影响IL-12分泌水平而导致HBeAg血清学转换率的差异。
本研究发现IL-1B rs1143623与HBV DNA抑制相关,IL-1B主要由巨噬细胞产生,它具有免疫调节、引起全身反应等生物学活性。Yang等[21]发现IL-1B在慢性HBV感染中扮演着重要的炎症与免疫调节作用。研究发现IL-1B rs1143623基因变异可以增加患慢性牙周炎、直肠癌的风险[22, 23]。IL-17主要由活化的T细胞产生,是T细胞诱导的炎症反应的早期启动因子,可以通过促进释放前炎性细胞因子来放大炎症反应。研究发现IL-17A水平升高预示慢性HBV感染的长期化[24]。Wang等[25]研究证实了IL-17表达和炎症活动程度的慢性HBV和肝纤维化之间存在显著的正相关关系。携带IL-17A rs8193036变异基因型会增加小儿哮喘风险[26]。本研究未发现IL-1B和IL-17A的SNP位点与恩替卡韦治疗HBeAg血清学转换存在关联,提示IL-1B和IL-17A在HBeAg血清学转换中发挥的作用可能不如IL-12更为关键。
尽管本研究纳入的研究对象数量相对较少,亦未对IL-12A rs568408多态性与HBeAg血清转换关联的机制进行深入研究,但是IL-12A基因多态性与慢性乙型肝炎恩替卡韦抗病毒治疗HBeAg血清学转换存在关联这一结果提示重要免疫相关基因的宿主遗传差异可能在慢性乙型肝炎抗病毒治疗应答中扮演重要角色。长期的随访观察,多中心、大样本的前瞻性研究和针对IL-12A rs568408的机制研究有助于进一步确认本研究结果。本研究弥补了既往研究以干扰素作为治疗手段的不足,对探讨慢性乙型肝炎的个体化治疗具有一定的临床意义。
| [1] | Webster G J, Bertoletti A. Control or persistence of hepatitis B virus: the critical role of initial host-virus interactions[J]. Immunol Cell Biol, 2002, 80(1): 101-105. |
| [2] | Grzegorzewska A E, Wobszal P M, Sowinska A, et al. Association of the interleukin-12 polymorphic variants with the development of antibodies to surface antigen of hepatitis B virus in hemodialysis patients in response to vaccination or infection[J]. Mol Biol Rep, 2013, 40(12): 6899-6911. |
| [3] | Kim S S, Cheong J Y, Lee D, et al. Interleukin-1β and interleukin-1 receptor accessory protein gene polymorphisms are associated with persistent hepatitis B virus infection[J]. Hepatogastroenterology, 2012, 59(113): 190-197. |
| [4] | Lafdil F, Miller A M, Ki S H, et al. Th17 cells and their associated cytokines in liver diseases[J]. Cell Mol Immunol, 2010, 7(4): 250-254. |
| [5] | Chen Y C, Chu C M, Liaw Y F. Age-specific prognosis following spontaneous hepatitis B e antigen seroconversion in chronic hepatitis B[J]. Hepatology, 2010, 51(2): 435-444. |
| [6] | 中华医学会肝病学分会、中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J]. 中华肝脏病杂志, 2011, 19(1): 13-24. |
| [7] | Baltayiannis G, Karayiannis P. Treatment options beyond IFNalpha and NUCs for chronic HBV infection: expectations for tomorrow[J]. J Viral Hepat, 2014, 21(11): 753-761. |
| [8] | Rannala B. Finding genes influencing susceptibility to complex diseases in the post-genome era[J]. Am J Pharmacogenomics, 2001, 1(3): 203-221. |
| [9] | Yokosuka O, Takaguchi K, Fujioka S, et al. Long-term use of entecavir in nucleoside-naive Japanese patients with chronic hepatitis B infection[J]. J Hepatol, 2010, 52(6): 791-799. |
| [10] | Hosaka T, Suzuki F, Kobayashi M, et al. Long-term entecavir treatment reduces hepatocellular carcinoma incidence in patients with hepatitis B virus infection[J]. Hepatology, 2013, 58(1): 98-107. |
| [11] | European Association For The Study Of The Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection[J]. J Hepatol, 2012, 57(1): 167-185. |
| [12] | Luo J, Li X, Wu Y, et al. Efficacy of entecavir treatment for up to 5 years in nucleos(t)ide-naive chronic hepatitis B patients in real life[J]. Int J Med Sci, 2013, 10(4): 427-433. |
| [13] | Trinchieri G. Interleukin-12 and the regulation of innate resistance and adaptive immunity[J]. Nat Rev Immunol, 2003, 3(2): 133-146. |
| [14] | Hsieh C S, Macatonia S E, Tripp C S, et al. Pillars article: development of TH1 CD4+ T cells through IL-12 produced by Listeria-induced macrophages. 1993. Science 260(5107): 547-549[J]. J Immunol, 2008, 181(7): 4437-4439. |
| [15] | Rigopoulou E I, Suri D, Chokshi S, et al. Lamivudine plus interleukin-12 combination therapy in chronic hepatitis B: antiviral and immunological activity[J]. Hepatology, 2005, 42(5): 1028-1036. |
| [16] | He D, Yan G, Wang Y. Serum levels of interleukin-12 in various clinical states with hepatitis B virus infection[J]. Cell Immunol, 2012, 272(2): 162-165. |
| [17] | Chen X, Han S, Wang S, et al. Interactions of IL-12A and IL-12B polymorphisms on the risk of cervical cancer in Chinese women[J]. Clin Cancer Res, 2009, 15(1): 400-405. |
| [18] | Wang J, Nong L, Wei Y, et al. Association of interleukin-12 polymorphisms and serum IL-12p40 levels with osteosarcoma risk[J]. DNA Cell Biol, 2013, 32(10): 605-610. |
| [19] | Chen T, Liang W, Gao L, et al. Association of single nucleotide polymorphisms in interleukin 12 (IL-12A and -B) with asthma in a Chinese population[J]. Hum Immunol, 2011, 72(7): 603-606. |
| [20] | Wu J F, Wu T C, Chen C H, et al. Serum levels of interleukin-10 and interleukin-12 predict early, spontaneous hepatitis B virus e antigen seroconversion[J]. Gastroenterology, 2010, 138(1): 165-172.e1-172.e3. |
| [21] | Yang C Y, Kuo T H, Ting L P. Human hepatitis B viral e antigen interacts with cellular interleukin-1 receptor accessory protein and triggers interleukin-1 response[J]. J Biol Chem, 2006, 281(45): 34525-34536. |
| [22] | Wu X, Offenbacher S, Lopez N J, et al. Association of interleukin-1 gene variations with moderate to severe chronic periodontitis in multiple ethnicities[J]. J Periodontal Res, 2015, 50(1): 52- 61. |
| [23] | Kutikhin A G, Yuzhalin A E, Volkov A N, et al. Correlation between genetic polymorphisms within IL-1B and TLR4 genes and cancer risk in a Russian population: a case-control study[J]. Tumour Biol, 2014, 35(5): 4821-4830. |
| [24] | Arababadi M K, Pourfathollah A A, Jafarzadeh A, et al. Serum Levels of IL-10 and IL-17A in Occult HBV-Infected South-East Iranian Patients[J]. Hepat Mon, 2010, 10(1): 31-35. |
| [25] | Wang L, Chen S, Xu K. IL-17 expression is correlated with hepatitis B-related liver diseases and fibrosis[J]. Int J Mol Med, 2011, 27(3): 385-392. |
| [26] | Wang J Y, Shyur S D, Wang W H, et al. The polymorphisms of interleukin 17A (IL-17A) gene and its association with pediatric asthma in Taiwanese population[J]. Allergy, 2009, 64(7): 1056-1060. |