急性髓系白血病(acute myeloblastic leukemia,AML)是成人急性白血病最常见的类型,研究表明处在静止期的AML干细胞是导致AML难治和复发及治疗失败的最重要因素[1, 2]。体内AML干细胞比例高的患者常提示不良预后[3],杀伤AML干细胞是治疗AML最有效、最根本的手段。从白血病患者体内提取AML干细胞很难满足体外实验细胞量的需求,KGlα细胞是一株耐药AML细胞株,研究显示从KGlα细胞中分选CD34+CD38-细胞可作为AML干细胞进行相应的研究[4, 5]。
Disulfiram(DS)在临床上作为抗酗酒药已经有60多 年历史[6],同时也是一类金属螯合剂,能够结合铜(Cu)并转运入细胞内,研究显示DS联合Cu(DS/Cu)对实体肿瘤细胞及白血病细胞具有细胞毒作用以及对传统化疗药具有增敏作用[7, 8],同时也发现DS对一些实体肿瘤干细胞具有细胞毒性作用[9, 10],但是关于它是否能够杀伤白血病干细胞的研究甚少。本实验旨在研究DS/Cu能否诱导AML干细胞凋亡并探讨其分子机制,为DS/Cu在白血病治疗提供更多的科学依据。 1 材料与方法 1.1 药物和试剂
Disulfiram、二甲亚砜(DMSO)、葡萄糖醛酸铜、N-乙酰半胱氨酸(NAC)、DCFH-DA购自Sigma公司;IMDM培养基、胎牛血清购自Gibco公司;rhIL-3、rhIL-6、rhSCF、rhFlt3和rhG-CSG因子购自Peprotech公司,细胞磁珠分选试剂盒购自美天旎公司;AnnexinV/FITC细胞凋亡检测试剂盒购自BD公司;兔抗人IgG、兔抗人TNF-α单克隆抗体、鼠抗Actin抗体、鼠抗及兔抗(二抗)购自Proteintech公司;Go Taq qPCR Master Mix试剂盒购自Promega公司;qRT-PCR引物由Invitrogen公司合成;EasyScriptTM RT逆转录试剂盒购自全式金生物公司。 1.2 细胞株和培养条件
KG1α细胞购自天津血研所,培养参照文献[5]进行。 1.3 磁珠分选细胞及培养
按磁珠分选要求,取约2×108个细胞重悬于600 μL的MASC分离液,添加200 μL FcR阻滞剂封闭细胞表面Fc受体,再添加200 μL CD34 Multisort MicroBeads及10 μL CD38-FITC抗体,在4~8 ℃的暗室孵育10 min,离心去上清并500 μL MACS分离液重悬细胞,在磁场中用磁珠分离柱分选收集CD34+KG1α细胞,1 mL MACS分离液重悬细胞并添加20 μL Multisort释放剂,4 ℃孵育10 min,离心去上清并 40 μL MASC分离液重悬细胞,再添加60 μL MACS Multisort 终止剂及100 μL Anti-FITC MicroBeads,4 ℃孵育30 min,再在磁场中用磁珠分离柱分选获取CD34+CD38-KG1α细胞。分选后细胞培养参照文献[5]进行。 1.4 药物处理分组
设空白对照组、DS单药组(5 μmol/L)、DS/Cu组 (5 μmol/L/0.5 μmol/L)及DS/Cu+NAC组(5 μmol/L /0.5 μmol/L/ 10 mmol/L)4组。进一步证实TNF-α作用时,予以TNF-α mAb(2 μg/mL)和IgG(2 μg/mL)预处理AML干细胞2 h,设空白对照组、DS/Cu组、 TNF-α mAb组、TNF-α mAb+DS/Cu组、IgG组及 IgG+DS/Cu 6组。 1.5 流式细胞术检测 1.5.1 流式细胞术检测细胞免疫表型
用抗人CD34-APC、CD38-PE的单克隆抗体标记KG1α细胞中CD34+CD38-细胞,然后上机检测CD34+CD38-KG1α细胞比例。 1.5.2 流式细胞术检测细胞凋亡
收集实验处理的细胞,用冰PBS洗涤2次,然后用1×的Binding Buffer重悬,细胞密度约为1×106/mL,取100 μL细胞悬液至5 mL离心管中,加入5 μL的FITC- Annexin V,在25 ℃避光孵育15 min,再添加400 μL的Binding Buffer后上机检测。 1.5.3 流式细胞术检测ROS
按照1 ∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。收集实验处理的细胞,PBS洗涤后重悬于含DCFH-DA的培养基中,细胞密度为106~2×107/mL,37 ℃下孵育20 min 后用无血清细胞培养液洗涤3次后PBS重悬,细胞密度为105~106/mL,DCF的荧光光谱和 FITC非常相似,用FITC参数检测DCF的平均荧光强度,计算ROS相对变化率:ROS相对变化率=测试组/空白对照组。 1.6 qRT-PCR检测
收集细胞,参照TRIzol的说明书提取细胞总RNA。检测RNA样品浓度及纯度,合格后按全式金生物公司 EasyScriptTM RT逆转录试剂盒说明书逆转录为 cDNA。从GenBank中检索出待测基因的mRNA序列,经Primer Premier5.0 软件分别设计TNF-α、CD40、TNFRSF11B、TNFRSF1B、HRK及β-actin上游引物和 下游引物,并进行BLAST分析,β-actin为内参基因。不同的样本均需设置复孔(3个)及阴性对照(无模板)。引物由Invitrogen生物公司合成。qRT-PCR反应按Promega公司Go Taq qPCR Master Mix试剂盒说明书进行,总体系20 μL。使用ABI7300荧光定量PCR仪扩增仪进行扩增操作。qRT-PCR引物序列见表 1。
| 基因 | 上游(5′-3′) | 下游(5′-3′) |
| TNF-α | ACCTCTCTCTAATCAGCCCTCT | GGGTTTGCTACAACATGGGCTA |
| CD40 | TTGGGGTCAAGCAGATTGCTA | GCAGATGACACATTGGAGAAGA |
| TNFRSF11B | GTGTGCGAATGCAAGGAAGG | CCACTCCAAATCCAGGAGGG |
| TNFRSF1B | GTGCCTCACTTGCCTGCCGATAA | GCCTGTGGCTGGTTCCGAGTGGG |
| HRK | AATTGTAAAGAGCTGATGGTGGA | AGTCTCAGAGTTCACATCGCAAG |
收集并用PBS洗涤细胞后,用RIPA裂解液裂解细胞获取总蛋白,用Bradford法测定蛋白溶度。取等量蛋白样本在10% SDS-PAGE凝胶上进行电泳,然后转置到PVDF膜上,用5%的BSA室温封闭1 h后,分别加入1 ∶500的TNF-α抗体和1 ∶4 000的Actin抗体,4 ℃过夜,洗膜后二抗孵育1 h,再次洗膜后与ECL发光液反应1 min,在Tanon 5200显像仪成像。 1.8 统计学方法
采用SPSS 13.0软件进行统计学分析,两组间均数的比较使用两独立样本t检验方法;多组间均数比较使用单因素方差分析方法进行统计,在方差分析显著的情况下采用方差齐性分析进行多重比较,方差不齐情况下采用近似F检验代替方差分析后采用Dunnett’s T3方法进行多重比较;计量资料用 x±s表示。 2 结果 2.1 白血病干细胞模型建立
KG1α细胞经过抗人CD34-APC、CD38-PE双抗标记,流式细胞术检测CD34+CD38-亚群细胞比例,分选前CD34+CD38-亚群细胞占KG1α细胞比例为(64.73±2.01)%,经MACS分选后CD34+CD38- KG1α细胞比例为(95.37±1.84)%(图 1)。
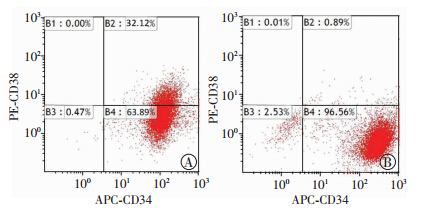 |
| A:分选前;B:分选后图 1 MACS分选前后KG1α细胞CD34和CD38抗原表达 |
设置空白对照、DS单药(5 μmol/L)、DS/Cu(5 μmol/L /0.5 μmol/L)、DS/Cu+NAC(5 μmol/L/0.5 μmol/L+10 mmol/L)4组,各组药物处理CD34+CD38-KGlα 24 h后,流式细胞术检测凋亡细胞比例,结果显示空白对照组、DS单药组及DS/Cu组凋亡细胞比例分别为(6.65±0.64)%、(11.87±1.30)%和(27.43±1.65)%(图 2),DS单药组和DS/Cu组诱导AML干细胞凋亡的比例明显高于空白对照组(P=0.01和P<0.01),此外,DS/Cu组诱导AML干细胞凋亡的比例也显著高于DS单药组(P=0.00)。加入ROS清除剂NAC后,DS/Cu诱导的AML干细胞凋亡比例由(27.43±1.65)%下降到(12.37±0.85)%,差异具有统计学意义(P<0.01)。
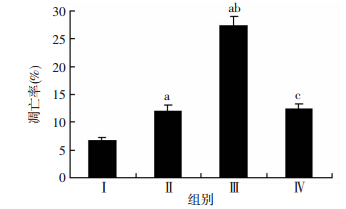 |
| Ⅰ:空白对照组;Ⅱ:DS单药组;Ⅲ:DS/Cu组;Ⅳ:DS/Cu+NAC组 a: P<0.05,与空白对照组比较;b: P<0.05,与DS单药组比较;c:P<0.05,与DS/Cu组比较 图 2 流式细胞术检测不同药物处理24 h后对AML干细胞凋亡率的影响 |
上述各组药物处理CD34+CD38-KGlα 24 h后,流式细胞术检测ROS水平。结果显示空白对照组、DS单药组、DS/Cu组及DS/Cu+NAC组ROS水平分别为 (359.67±32.50)、(497.38±36.85)、(1 008.93±83.72)、 (413.95±70.90),DS单药组及DS/Cu组ROS水平较空白对照组上升了(1.39±0.12)倍、(2.81±0.11)倍(P=0.03和P<0.01,图 3);DS/Cu组诱导AML干细胞ROS水平显著高于DS单药组(P=0.00)。加入NAC能显著抑制DS/Cu诱导的ROS蓄积,差异有统计学意义(P<0.01)。
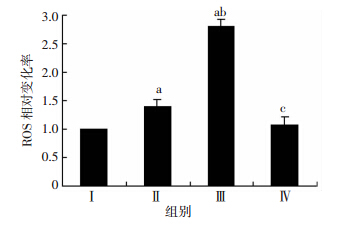 |
| Ⅰ:空白对照组;Ⅱ:DS单药组;Ⅲ:DS/Cu组;Ⅳ:DS/Cu+NAC组 a: P<0.05,与空白对照组比较;b: P<0.05,与DS单药组比较;c: P<0.05,与DS/Cu组比较 图 3 流式细胞术检测不同药物处理24 h后AML干细胞ROS相对变化水平 |
上述各组药物处理CD34+CD38-KGlα 24 h后,qRT-PCR验证与调节凋亡相关的基因TNF-α、CD40、TNFRSF11B、TNFRSF1B、HRK的mRNA水平,结果显示DS组及DS/Cu组相比于空白对照组能上调上述基因(P<0.05),且DS/Cu组较DS组上调更明显(P<0.05),予以NAC抑制ROS蓄积挽救细胞凋亡后,相比于DS/Cu组,在DS/Cu+NAC组中TNF-α依然高表达(P=0.73),而CD40、TNFRSF11B、TNFRSF1B、HRK基因水平明显下调(P<0.05)(图 4);Western blot检测细胞内TNF-α的表达,结果同样显示DS组及DS/Cu组均可明显上调TNF-α蛋白表达水平,其中联合组上调更明显;加入ROS抑制剂NAC后不能抑制DS/Cu引起的TNF-α表达水平的上调(图 5)。
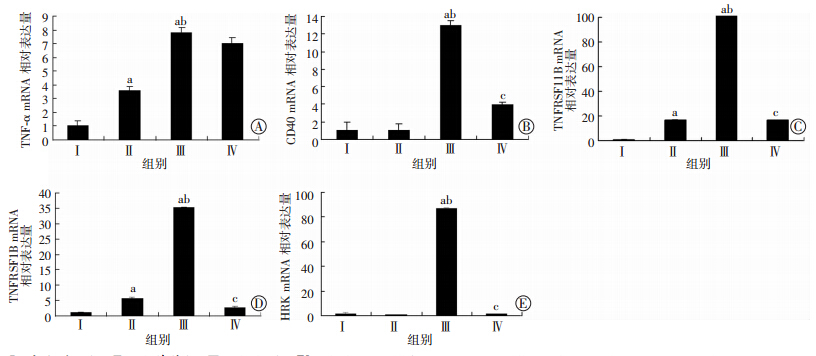 |
| Ⅰ:空白对照组;Ⅱ:DS单药组;Ⅲ:DS/Cu组;Ⅳ:DS/Cu+NAC组;A:TNF-α;B:CD40;C:TNFRSF11B;D:TNFRSF1B;E:HRK a: P<0.05,与空白对照组比较; b: P<0.05,与DS单药组比较; c: P<0.05,与DS/Cu组比较 图 4 不同药物处理组AML干细胞24 h后凋亡相关基因表达 |
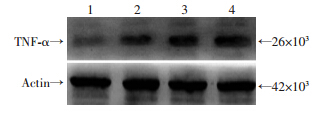 |
| 1:空白对照组;2:DS单药组;3:DS/Cu组;4:DS/Cu+NAC组 图 5 不同药物处理24 h后对AML干细胞TNF-α蛋白 表达影响 |
先予以中和抗体TNF-α mAb(2 μg/mL)及对照抗体IgG(2 μg/mL)预处理CD34+CD38-KGlα 细胞2 h,设置空白对照组、DS/Cu组、TNF-α mAb组、TNF-α mAb+DS/Cu组、IgG组、IgG+DS/Cu组(溶度同前),不同处理作用CD34+CD38-KG1α细胞24h,流式细胞术检测各组细胞ROS水平,结果显示6组细胞ROS水平依次为(355.33±35.23)、(985.33±120.97)、(280.00±23.07)、(451.33±44.66)、(328.00±30.27)、(1145.33±59.50),TNF-α mAb+DS/Cu组相比DS/Cu的ROS变化比率由(2.78±0.25)倍下降到(1.28±0.17)倍,差异有统计学意义(P=0.00),而IgG+DS/Cu组相比DS/Cu组差异无统计学意义(P=0.23),并且TNF-α mAb及IgG组相比空白对照组的 ROS水平也无显著性差异(P=0.09和P=0.50,图 6)。
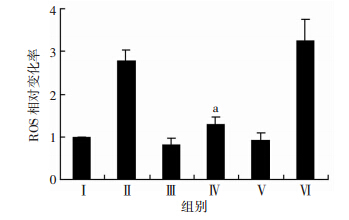 |
| Ⅰ:空白对照组;Ⅱ:DS/Cu组;Ⅲ:TNF-α mAb组; Ⅳ: TNF-α mAb+DS/Cu组;Ⅴ:lgG组;Ⅵ:lgG+DS/Cu组 a: P<0.05,与DS/Cu组比较 图 6 不同预处理后流式细胞术检测DS/Cu作用AML干细胞24 h后ROS相对变化水平 |
研究表明AML患者存在一小群表型为CD34+CD38-的AML干细胞,它具有处于细胞静止期,对传统的化疗药不敏感,有多药耐药及有骨髓微环境保护的特点[11, 12, 13],所以AML干细胞是AML治疗失败及复发的主要原因,即使行造血干细胞移植也不能完全清除AML干细胞[3, 14]。因此,开发可以杀伤AML干细胞的新型药物是治疗AML行之有效的策略[15, 16]。而开发一个新药需要耗费大量的人力、财力以及时间,而从已有的药物中开发具有抗肿瘤活性药物这一经济实惠的捷径越来越受到科研工作者的青睐。
含有硫醇基的Disulfiram是一个乙醛脱氢酶抑制剂。我们前期实验证明Disulfiram联合Cu可以诱导血液系统肿瘤细胞ROS的蓄积,通过激活下游JNK及抑制NF-κB、Nrf2通路有效的杀伤肿瘤细胞[8, 17]。同时,在AML干细胞中,我们也发现DS/Cu可以通过抑制NF-κB及激活JNK通路抑制细胞增殖及诱导细胞凋亡[18]。本研究进一步对DS/Cu诱导AML干细胞凋亡的相关分子机制进行探讨,结果表明DS及DS/Cu 同样能够引起AML干细胞的ROS蓄积诱导其凋亡,而且DS/Cu比单药DS诱导的ROS蓄积及凋亡更明显,予以NAC预处理后抑制DS/Cu诱导的ROS蓄积,AML干细胞的凋亡也明显被抑制,说明ROS水平升高也是DS/Cu杀伤AML干细胞的重要机制。
TNF-α是一种促炎细胞因子,并且具有很好抗肿瘤活性[19],能够介导不同的信号通路能够诱导细胞的增殖、存活以及凋亡[20]。研究表明TNF-α能够诱导白血病细胞的ROS的蓄积导致细胞凋亡,此外,文献[21, 22, 23, 24]报道CD40、TNFRSF11B、TNFRSF1B、HRK等也可以影响肿瘤细胞的ROS蓄积或凋亡。上述基因在单药DS及DS/Cu诱导CD34+CD38-KG1α细胞ROS产生时明显上调,联合组上调均比单药组明显,加入ROS清除剂NAC后TNF-α依然高表达,而CD40、TNFRSF11B、TNFRSF1B、HRK基因水平在抑制ROS后明显下调,表明TNF-α是ROS产生的上游基因,其他基因的表达是受ROS调控。在加入中和抗体TNF-α mAb后,DS/Cu诱导的ROS蓄积及凋亡能够被抗体抑制,进一步验证了DS/Cu是通过上调TNF-α表达诱导ROS蓄积杀伤AML干细胞的分子机制。有研究发现DS能够抑制TNF-α的分泌[25],这与本实验结果不一致,其原因可能是文献[25]采用ELISA方法检测为分泌型sTNF-α,而本实验检测是跨膜型mTNF-α蛋白的表达;此外,药物作用于不同细胞对TNF-α的释放影响也可能存在不同[26]。对于TNF-α诱导ROS蓄积机制,可能是依赖于线粒体途径的氧化呼吸链的电子传递实现的[27]。
本研究结果显示DS/Cu对AML干细胞具有杀伤作用,其机制可能是通过上调TNF-α的表达诱导ROS的蓄积实现的。下一步应进行体内试验验证,进一步明确DS/Cu诱导AML干细胞凋亡的作用及机制。
| [1] | Dohner H, Estey E H, Amadori S, et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet[J]. Blood, 2010, 115(3): 453-474. |
| [2] | Buss E C, Ho A D. Leukemia stem cells[J]. Int J Cancer, 2011, 129(10): 2328-2336. |
| [3] | van-Rhenen A, Feller N, Kelder A, et al. High stem cell frequency in acute myeloid leukemia at diagnosis predicts high minimal residual disease and poor survival[J]. Clin Cancer Res, 2005, 11(18): 6520-6527. |
| [4] | Kim S J, Jang J E, Cheong J W, et al. Aurora A kinase expression is increased in leukemia stem cells, and a selective Aurora A kinase inhibitor enhances Ara-C-induced apoptosis in acute myeloid leukemia stem cells[J]. Korean J Hematol, 2012, 47(3): 178-185. |
| [5] | Liu Y, Chen F, Wang S, et al. Low-dose triptolide in combination with idarubicin induces apoptosis in AML leukemic stem-like KG1a cell line by modulation of the intrinsic and extrinsic factors[J]. Cell Death Dis, 2013, 4: e948. |
| [6] | Sauna Z E, Shukla S, Ambudkar S V. Disulfiram, an old drug with new potential therapeutic uses for human cancers and fungal infections[J]. Mol Biosyst, 2005, 1(2): 127-134. |
| [7] | Guo X, Xu B, Pandey S, et al. Disulfiram/copper complex inhibiting NFkappaB activity and potentiating cytotoxic effect of gemcitabine on colon and breast cancer cell lines[J]. Cancer Lett, 2010, 290(1): 104-113. |
| [8] | Xu B, Shi P, Fombon I S, et al. Disulfiram/copper complex activated JNK/c-jun pathway and sensitized cytotoxicity of doxorubicin in doxorubicin resistant leukemia HL60 cells[J]. Blood Cells Mol Dis, 2011, 47(4): 264-269. |
| [9] | Choi S A, Choi J W, Wang K C, et al. Disulfiram modulates stemness and metabolism of brain tumor initiating cells in atypical teratoid/rhabdoid tumors[J]. Neuro Oncol, 2014, pii: nou305. [Epub ahead of print] |
| [10] | Chiba T, Suzuki E, Yuki K, et al. Disulfiram eradicates tumor-initiating hepatocellular carcinoma cells in ROS-p38 MAPK pathway-dependent and -independent manners[J]. PLoS One, 2014, 9(1): e84807. |
| [11] | Raaijmakers M H, de-Grouw E P, van-der-Reijden B A, et al. ABCB1 modulation does not circumvent drug extrusion from primitive leukemic progenitor cells and may preferentially target residual normal cells in acute myelogenous leukemia[J]. Clin Cancer Res, 2006, 12(11 Pt 1): 3452-3458. |
| [12] | Wang G P, Qi Z H, Chen F P. Treatment of acute myeloid leukemia by directly targeting both leukemia stem cells and oncogenic molecule with specific scFv-immunolipoplexes as a deliverer[J]. Med Hypotheses, 2008, 70(1): 122-127. |
| [13] | Lane S W, Scadden D T, Gilliland D G. The leukemic stem cell niche: current concepts and therapeutic opportunities[J]. Blood, 2009, 114(6): 1150-1157. |
| [14] | Shlush L I, Zandi S, Mitchell A, et al. Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia[J]. Nature, 2014, 506(7488): 328-333. |
| [15] | Horton S J, Huntly B J. Recent advances in acute myeloid leukemia stem cell biology[J]. Haematologica, 2012, 97(7): 966-974. |
| [16] | Roboz G J. Current treatment of acute myeloid leukemia[J]. Curr Opin Oncol, 2012, 24(6): 711-719. |
| [17] | Zha J, Chen F, Dong H, et al. Disulfiram targeting lymphoid malignant cell lines via ROS-JNK activation as well as Nrf2 and NF-kB pathway inhibition[J]. J Transl Med, 2014, 12: 163. |
| [18] | 王诗韵, 查洁, 董慧娟, 等. DS/Cu对急性髓系白血病干细胞增殖与凋亡影响及其机制的探讨[J]. 中华肿瘤防治杂志, 2013, 20(6): 411-415. |
| [19] | Rasmussen J W, Martinez E, Louka P, et al. Zinc oxide nanoparticles for selective destruction of tumor cells and potential for drug delivery applications[J]. Expert Opin Drug Deliv, 2010, 7(9): 1063-1077. |
| [20] | Dash S K, Ghosh T, Roy S, et al. Zinc sulfide nanoparticles selectively induce cytotoxic and genotoxic effects on leukemic cells: involvement of reactive oxygen species and tumor necrosis factor alpha[J]. J Appl Toxicol, 2014, 34(11): 1130-1144. |
| [21] | Horie T, Dobashi K, Iizuka K, et al. Interferon-gamma rescues TNF-αlpha-induced apoptosis mediated by up-regulation of TNFR2 on EoL-1 cells[J]. Exp Hematol, 1999, 27(3): 512-519. |
| [22] | Rizvi F, Heimann T, Herrnreiter A, et al. Mitochondrial dysfunction links ceramide activated HRK expression and cell death[J]. PLoS One, 2011, 6(3): e18137. |
| [23] | Bou-Khzam L, Hachem A, Zaid Y, et al. Soluble CD40 ligand impairs the anti-platelet function of peripheral blood angiogenic outgrowth cells via increased production of reactive oxygen species[J]. Thromb Haemost, 2013, 109(5): 940-947. |
| [24] | Kim J Y, Park Y J, Kim K J, et al. Osteoprotegerin causes apoptosis of endothelial progenitor cells by induction of oxidative stress[J]. Arthritis Rheum, 2013, 65(8): 2172-2182. |
| [25] | Marikovsky M, Ziv V, Nevo N, et al. Cu/Zn superoxide dismutase plays important role in immune response[J]. J Immunol, 2003, 170(6): 2993-3001. |
| [26] | Pang Q, Dou L, Pan X, et al. Methylene chloride protects against cecal ligation and puncture-induced acute lung injury by modulating inflammatory mediators[J]. Int Immunop-harmacol, 2010, 10(8): 929-932. |
| [27] | Wallach D, Boldin M, Varfolomeev E, et al. Cell death induction by receptors of the TNF family: towards a molecular understanding[J]. FEBS Lett, 1997, 410(1): 96-106. |



