2.201620上海,东华大学化工与生物工程学院;
3.400037 重庆,第三军医大学新桥医院骨科;
2.College of Chemistry and Chemical Engineering and Biological Engineering, Donghua University, Shanghai, 201620;
3.Department of Orthopaedics, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China;
椎间盘退变是引起腰背痛的主要原因之一,由于发病率较高,造成了严重的社会负担[1]。椎间盘退变主要起源于髓核的退变,因此,修复退变的髓核被认为是治疗椎间盘退变的关键。以组织工程为基础的髓核置换术可以从病因学的角度修复退变的髓核并促进髓核的再生,被认为是将来可能用于治疗椎间盘退变的方案[2, 3]。水凝胶由于结构与髓核相似,具有潜在的亲水性和细胞相容性,被认为是髓核组织工程良好的支架材料[4]。但是,水凝胶的浓度对组织工程髓核性能的影响尚没有共识。本课题组研制了一种葡聚糖/明胶复合水凝胶,其中葡聚糖和明胶均为天然材料,具有细胞相容性好的优点。本研究通过观察不同浓度的葡聚糖/明胶复合水凝胶的性能及对构建组织工程髓核的影响,筛选兼具良好力学稳定性和细胞相容性的葡聚糖/明胶复合水凝胶,探讨其作为组织工程髓核支架材料的可行性。
1 材料与方法 1.1 实验材料与主要试剂巴马香猪3只(第三军医大学基础医学部实验动物教研室),明胶(Mw60000)、葡聚糖(Mw100000)、高碘酸钠(NaIO4)、乙二醇(EG)、乙二胺(ED)、二氯乙烷(EDC)、胶原酶、CCK-8、MTT试剂(美国Sigma公司),透析袋(上海经科宏达科技公司)。
1.2 实验仪器真空干燥箱(上海恒科技有限公司),扫描电镜(S3400N型,日本日立公司),生物材料动态力学试验机(ElectroForce 3100型,美国BOSE公司),酶标仪(Model 550,Bio-Rad公司),倒置显微镜(LSM 510,德国Zeiss公司)。
1.3 葡聚糖/明胶水凝胶的制备制备氧化葡聚糖以及氨基化明胶。制备10%的葡聚糖溶液,加入NaIO4水溶液,反应6 h后加入EG,得到氧化葡聚糖溶液。在明胶溶液中加入ED,随后加入EDC,搅拌过夜得到氨基化明胶溶液。冷冻干燥后得到氧化葡聚糖和氨基化明胶。
配置10%氧化葡聚糖、20%氨基化明胶的溶液,按照氧化葡聚糖 ∶氨基化明胶(%)=3 ∶5的比例混合,将浓度分别调整为6%、8%、10%、12%、14%,加入模具(r=5 mm,h=4 mm)中,37 ℃中反应10 min后得到的葡聚糖/明胶复合水凝胶。
1.4 SEM观察水凝胶内部形态取不同浓度的葡聚糖/明胶复合水凝胶支架材料冻干。固定于样品台上,表面喷金后置于扫描电镜下观察。采用软件ImageJ 1.47v测量材料电镜照片孔径大小(n=3)。
1.5 水凝胶孔隙率检测水凝胶在PBS中浸泡24 h,冻干,用游标卡尺精确测量支架样品的体积(V)。测量干样品的质量(W1),以及浸泡在无水乙醇(密度为ρ)中2 h后的质量(W2)。样品的孔隙率(P)计算公式为P=[(W2-W1)ρ]/V(n=3)。
1.6 水凝胶力学性能检测取不同浓度的葡聚糖/明胶复合水凝胶支架样本,在PBS中浸泡24 h,测量样品的厚度,将样品置于生物材料动态力学试验机的平台上,按照1 mm/min的速率进行压缩测试。通过应力-应变曲线计算样本的断裂强度、断裂伸长及杨氏模量(n=3)。
1.7 髓核细胞的分离和培养巴马香猪(1月龄,体质量4~5 kg)麻醉后在无菌条件下切取胸腰段椎间盘,置于培养皿中用PBS冲洗3次,沿水平面切开椎间盘,取出髓核组织,剪碎至1 mm3 大小,用0.2%胶原酶于37 ℃消化30 min,经100目的滤网过滤,离心弃上清,髓核细胞采用DMEM/F12培养液(10%胎牛血清、1%双抗)于37 ℃、5%CO2孵箱中培养,每3天换液1次。当细胞融合度达到80%~90%,用0.25%的胰蛋白酶消化传代。取P1代作为种子细胞。
1.8 CCK-8法检测水凝胶表面髓核细胞相容性将不同浓度的水凝胶在48孔板中成胶,将P1代髓核细胞按1×104/cm2接种到水凝胶的表面,加入培养基,每2天换液1次。分别于1、4、7 d加入含10% CCK-8的新鲜无血清培养基,37 ℃孵育3 h,然后用酶标仪测定波长450 nm处的光密度值[D(450)](n=3)。
1.9 MTT染色观察水凝胶内三维培养髓核细胞活性取P1代髓核细胞,胰酶消化后离心,弃去上清,将不同浓度的氧化葡聚糖、氨基化明胶溶液与细胞混合,充分吹打均匀,细胞接种密度为5×106 /mL。细胞悬液迅速加入24孔板中,37 ℃孵育10 min,成胶后加 入培养基,每天换液1次。于第7天弃去培养基,加入含1 mg/ml MTT的无血清培养基溶液,孵育15 min,倒置显微镜下观察,然后用酶标仪测定D(450)值(n=3)。
1.10 Real-time PCR检测不同浓度水凝胶内髓核细胞特异性基因aggrecan和type Ⅱ collagen表达培养7 d后,将细胞-水凝胶混合物取出,研磨后用TRIzol试剂盒提取RNA并检测其质量后,制备
cDNA。加入待测基因引物(上海生工)和荧光标志物SYBRGreen(TOYOBO公司),行Real-time PCR检测(PCR System 7500,Applied Biosystems)。引物序列:aggrecan上游 5′-AGTCCACTGAGATCCTCTACTC-3′,下游5′-CCAAGAAGAAGGCCAACAAGGC-3′,产物长度91 bp; type Ⅱ collagen上游5′-CAGGATGGGCAG-AGGTATAATG-3′,下游5′-GAGGCAGTCTTTCAGGTC-TTC-3′,产物长度123 bp;GAPDH上游5′-ACCTCCACTACATGGTCTACA-3′,下游5′-ATGACAAGCTTCCCGTTCTC-3′,产物长度91 bp。使用2-ΔΔCt法对基因相对表达量进行计算。
采用SPSS 14.0统计软件行单因素方差分析,数据以x±s表示。
2 结果 2.1 水凝胶内部形态结构对水凝胶内部结构进行电镜扫描结果显示:不同浓度的葡聚糖/明胶复合水凝胶具有三维、多孔的结构,除了6%和8%的水凝胶孔径大小无明显差异外,其他各组的孔径随着水凝胶浓度的升高而降低,低浓度的水凝胶结构较为松散,高浓度的水凝胶结构较为均质、紧密(图 1)。
2.2 水凝胶孔隙率不同浓度水凝胶的孔隙率为95.5%~98.3%,孔隙率随着水凝胶的浓度下降有升高的趋势,但差异不显著(P>0.05,图 2)。其中10%组的孔隙率为(97.2±0.4)%。
 |
| A:6%组;B:8%组;C:10%组;D:12%组;E:14%组;F:不同浓度水凝胶孔径分析结果 a:P<0.05,与6%组比较;b:P<0.05,与8%组比较;c:P<0.05,与10%组比较;d:P<0.05,与12%组比较 图 1 扫描电镜下观察不同浓度葡聚糖/明胶复合水凝胶支架材料的结构和孔径分析 |
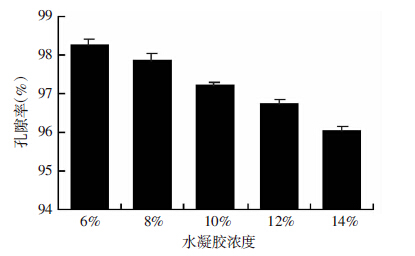 |
| 图 2 液体浸泡法检测不同浓度葡聚糖/明胶复合水凝胶的孔隙率 |
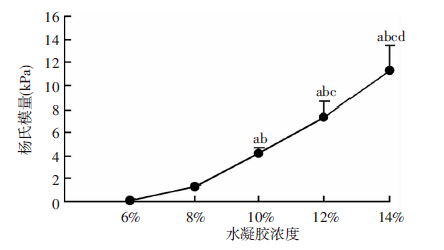
4组水凝胶的应力-应变曲线见图 3。水凝胶的杨氏模量随着浓度的升高而升高(0.135~11.366 kPa),除了6%组与8%组之间的差异不明显(P>0.05),其他各组间的差异具有显著性(P<0.05)。其中10%组水凝胶的杨氏模量为(4.271±0.553)kPa。
 |
| a:P<0.05,与6%组比较;b:P<0.05,与8%组比较; c:P<0.05,与10%组比较;d:P<0.05,与12%组比较 图 3 应力-应变曲线评价不同浓度葡聚糖/明胶复合水凝胶的杨氏模量 |
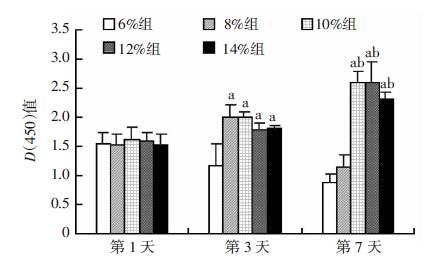
CCK-8法检测的不同浓度水凝胶细胞相容性见图 4。细胞在水凝胶表面接种1 d后,各组间的细胞增殖无统计学差异(P>0.05)。随着培养时间的延长,第4天时,浓 度为8%~14%的水凝胶表面细胞增殖活性差异无显著性(P>0.05),但是6%的水凝胶表面细胞增殖活性明显降低。培养第7天时,浓度为6%、8%水凝胶表面细胞增殖活性较10%、12%、14%组显著降低(P<0.05),10%、12%、14%组的细胞增殖活性差异无显著性(P>0.05)。
 |
| a:P<0.05,与6%组比较;b:P<0.05,与8%组比较 图 4 CCK-8法检测猪髓核细胞在水凝胶表面的增殖活性 |
活细胞与异丙醇代谢生成黑色的甲瓒晶体。培养7 d后,水凝胶内的髓核细胞活性在浓度为10%~14%的范围内随着浓度的升高而降低,而6%、8%组内的髓核细胞活性较其他各组显著降低(P<0.05)。其中10%组的水凝胶内细胞活性最高(图 5、6)。
 |
| A~E:分别为6%、8%、10%、12%、14%组(×40,);F~J:分别为6%、8%、10%、12%、14%组(×200) 图 5 MTT染色法检测不同浓度葡聚糖/明胶复合水凝胶内三维培养髓核细胞的活性 |
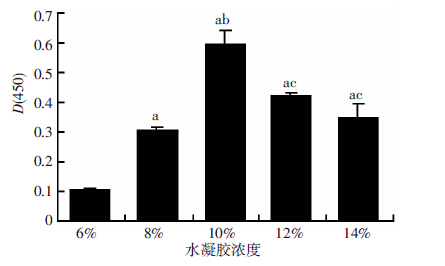 |
| a:P<0.05,与6%组比较;b:P<0.05,与8%组比较;c:P<0.05,与10%组比较 图 6 不同浓度葡聚糖/明胶复合水凝胶内三维培养髓核细胞活性分析 |
Real-time PCR检测水凝胶内部细胞髓核特异性基因表达。培养7 d后,浓度为10%水凝胶内部三维培养的髓核细胞aggrecan表达显著高于其他各组,而12%、14%组显著高于6%、8%组(P<0.05)。type Ⅱ collagen的表达在浓度10%、12%组中差异无显著性,但高于14%组(P<0.05),此3组的表达均高于6%、8%组(P<0.05,图 7)。
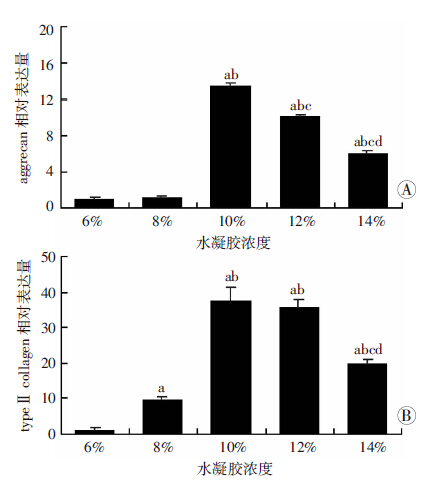 |
| a:P<0.05,与6%组比较;b:P<0.05,与8%组比较; c:P<0.05,与10%组比较;d:P<0.05,与12%组比较 图 7 Real-time PCR检测不同浓度葡聚糖/明胶复合水凝胶内三维培养髓核细胞的aggrecan(A)、typeⅡ collagen(B)的表达 |
近年来,水凝胶作为支架材料在制备组织工程骨[5]、软骨[6]、骨骼肌[7]、神经[8]等得到了广泛的研究。海藻酸盐[9]、壳聚糖[10]、胶原[11]等材料制备的水凝胶更是在髓核组织工程领域中得到了广泛的运用。同时,越来越多新材料的不断涌现为水凝胶将来应用于髓核组织工程带来了新的希望。在新材料不断受到关注的同时,关于水凝胶的浓度、交联密度、弹性模量等物理特性在构建组织工程髓核中所发挥的作用的研究尚不够深入,这些物理特性可能对内部三维培养的髓核细胞产生重要的影响,进一步影响水凝胶在组织工程髓核的应用[12]。本文以葡聚糖/明胶复合水凝胶为支架材料构建组织工程髓核,其中葡聚糖是一种与GAG相似的多糖类物质,具有较高的细胞相容性和亲水性[13];明胶作为一种胶原的衍生物,具有细胞黏附的位点,另外明胶带正电荷的特性尤其有利于细胞的粘附[14]。氧化葡聚糖和氨基化明胶通过Schiff交联结合形成水凝胶,在前期研究中我们发现该水凝胶具有原位接种、可注射、良好的生物相容性等优点,具备应用于髓核组织工程的潜力,但是力学性能较低,降解速率快,限制了其进一步的应用[15]。本实验以此水凝胶为模型,研究不同浓度葡聚糖/明胶复合水凝胶的性能以及支架浓度对构建组织工程髓核的影响,探索适用于组织工程髓核的水凝胶浓度。
SEM结果显示,随着浓度的升高,水凝胶的孔径和孔隙率下降。孔径和孔隙率对于种子细胞具有重要作用,因为高孔径、孔隙率可以为内部细胞提供养分供应和代谢物质交换的通道。由于类软骨细胞三维培养所需的支架孔径应大于40 μm,所以虽然高浓度的水凝胶孔径、孔隙率相对较低,但是已达到了组织工程髓核的要求。因为椎间盘是脊柱的应力吸收系统,为脊柱提供了力学的稳定性,髓核作为椎间盘内部的主要物质,承担了椎间盘绝大部分的压应力[16],所以力学性能对于髓核组织工程的应用至关重要[17]。因此,组织工程髓核应具有一定的刚度,保证植入体内的组织工程髓核可以在应力作用下保持三维结构的完整性,以利于新组织的形成。通过力学测试我们发现,该水凝胶的杨氏模量和断裂应力都随着水凝胶浓度的升高而升高,其中10%、12%组水凝胶与髓核的杨氏模量(5.39 ± 2.56)kPa较为接近。细胞相容性检测提示,6%、8%的水凝胶表面细胞增殖活性较低,水凝胶表面的细胞分别在培养第4、7天迅速减少,在培养中可以发现6%、8%组的水凝胶在培养第4、7天结构完整性被破坏,部分水凝胶随换液丢失,这是可能由于低浓度的水凝胶结构交联密度过低、结构过于疏松以及降解速率快造成的,导致了表面黏附的细胞丢失。
我们将髓核细胞原位接种至水凝胶中,观察三维培养下髓核细胞的生物学行为。研究发现,葡聚糖/明胶水凝胶浓度的升高会降低其内部的细胞活性,进一步引起了髓核特异性基因的表达下降,不利于新生的胞外基质形成,这与前面所发现的高浓度水凝胶的低孔径和低孔隙率可能有着密切的关系。但是低浓度的水凝胶(6%、8%组)由于结构过于疏松,在培养7 d后发生了明显的结构破坏,不能为组织再生提供完整的模板,导致了细胞的数量下降,aggrecan、type II collagen的表达量也随之降低。这与细胞相容性检测中所发现的现象一致,说明低浓度的水凝胶松散的结构不利于构建组织工程髓核。各组中,浓度为10%的水凝胶兼具了稳定的力学结构以及良好的细胞相容性,有利于内部细胞的增殖以及特异性基因的表达,促进胞外基质的合成。
本研究表明,较低浓度的葡聚糖/明胶复合水凝胶虽然具有较高孔径和孔隙率,但是其较差的力学性能和较快的降解速度限制了其应用,不适用于组织工程髓核的应用。而较高浓度的水凝胶,虽然细胞相容性相对较低,但是较高的交联密度和力学强度使得它具有稳定的力学结构,有利于内部细胞的长期培养,但是较低的孔径和孔隙率不利于内部细胞的营养供应和物质交换。另外,过高浓度的水凝胶可能会导致成胶速度过快,不利于水凝胶的注射,限制了在微创手术中的应用。所以选择一个适中的浓度,使水凝胶兼具有良好的细胞相容性和稳定的力学结构,对于水凝胶在组织工程应用非常重要。本研究中的葡聚糖/明胶复合水凝胶是一种三维、多孔的支架,选择适宜的浓度可使该水凝胶兼具良好的力学性能和细胞相容性,在髓核组织工程中具有应用前景,为其在椎间盘退变治疗中的临床应用奠定了基础。
| [1] | Pellise F, Balague F, Rajmil L, et al. Prevalence of low back pain and its effect on health-related quality of life in adolescents[J]. Arch Pediatr Adolesc Med, 2009, 163(1): 65-71. |
| [2] | Schoenfeld A J. Adjacent segment degeneration after lumbar spinal fusion: risk factors and implications for clinical practice[J]. Spine J, 2011, 11(1): 21-23. |
| [3] | Silva-Correia J, Miranda-Goncalves V, Salgado A J, et al. Angiogenic potential of gellan-gum-based hydrogels for application in nucleus pulposus regeneration: in vivo study[J]. Tissue Eng Part A, 2012 18(11/12): 1203-1212. |
| [4] | Francisco A T, Mancino R J, Bowles R D, et al. Injectable laminin-functionalized hydrogel for nucleus pulposus regeneration[J]. Biomaterials, 2013, 34(30): 7381-7388. |
| [5] | Castillo-Diaz L A, Saiani A, Gough J E, et al. Human osteoblasts within soft peptide hydrogels promote mineralisation in vitro[J]. J Tissue Eng, 2014, 5: 2041731414539344. |
| [6] | Choi B, Kim S, Lin B, et al. Cartilaginous extracellular matrix-modified chitosan hydrogels for cartilage tissue engineering[J]. ACS Appl Mater Interfaces, 2014, 6(22): 20110-20121. |
| [7] | Pereira T, Armada-da-Silva P A, Amorim I, et al. Effects of Human Mesenchymal Stem Cells Isolated from Wharton’s Jelly of the Umbilical Cord and Conditioned Media on Skeletal Muscle Regeneration Using a Myectomy Model[J]. Stem Cells Int, 2014, 2014: 376918. |
| [8] | McMurtrey R J. Patterned and functionalized nanofiber scaffolds in three-dimensional hydrogel constructs enhance neurite outgrowth and directional control[J]. J Neural Eng, 2014, 11(6): 066009. |
| [9] | Chou A I, Nicoll S B. Characterization of photocrosslinked alginate hydrogels for nucleus pulposus cell encapsulation[J]. J Biomed Mater Res A, 2009, 91(1): 187-194. |
| [10] | Sasson A, Patchornik S, Eliasy R, et al. Hyperelastic mechanical behavior of chitosan hydrogels for nucleus pulposus replacement-experimental testing and constitutive modeling[J]. J Mech Behav Biomed Mater, 2012, 8: 143-153. |
| [11] | Mercuri J, Addington C, Pascal R 3rd, et al. Development and initial characterization of a chemically stabilized elastin-glycosaminoglycan-collagen composite shape-memory hydrogel for nucleus pulposus regeneration[J]. J Biomed Mater Res A, 2014, 102(12): 4380-4393. |
| [12] | Vinatier C, Guicheux J, Daculsi G, et al. Cartilage and bone tissue engineering using hydrogels[J]. Biomed Mater Eng, 2006, 16(4 Suppl): S107-S113. |
| [13] | Kopecek J. Hydrogel biomaterials: a smart future?[J]. Biomaterials, 2007, 28(34): 5185-5192. |
| [14] | Geng X Mo, X, Fan L, et al. Hierarchically designed injectable hydrogel from oxidized dextran, amino gelatin and 4-arm poly (ethylene glycol)-acrylate for tissue engineering application[J]. J Mater Chem, 2012, 22(48): 25130-25139. |
| [15] | Mo X, Iwata H, Matsuda S, et al. Y. Soft tissue adhesive composed of modified gelatin and polysaccharides[J]. J Biomater Sci Polym Ed, 2000, 11(4): 341-151. |
| [16] | Silva-Correia J, Correia S I, Oliveira J M, et al. Tissue engineering strategies applied in the regeneration of the human intervertebral disk[J]. Biotechnol Adv, 2013, 31(8): 1514-1531. |
| [17] | Smith L J, Gorth D J, Showalter B L, et al. In vitro characterization of a stem-cell-seeded triple-interpenetrating-network hydrogel for functional regeneration of the nucleus pulposus[J]. Tissue Eng Part A, 2014, 20(13/14): 1841-1849. |



