多发性硬化(multiple sclerosis,MS)是一种中枢神经系统(central nervous system,CNS)自身免疫性疾病,减轻炎症反应对控制疾病发生发展具有重要临床意义[1]。目前有研究表明,MS及实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)在脱髓鞘、炎细胞浸润等典型病理改变发生前,首先存在着少突胶质细胞凋亡,凋亡的少突胶质细胞直接激活小胶质细胞,此病理改变称“激活前损伤区”[2]。持续激活的小胶质细胞通过分泌一系列细胞因子成为后续的T、B淋巴细胞浸润的扳机点,可能是炎症反应发生的使动因素[3]。本课题组早期研究发现,增加EAE中的自噬水平,可通过清除受损线粒体抑制疾病早期的少突胶质细胞凋亡。研究证实自噬对T细胞具有前存活和前死亡的双重作用,是自身免疫及炎症反应的重要介导者[4]。还有研究发现在离体培养的单核细胞中,抑制自噬会导致炎症细胞因子IL-1β的分泌增加,从而促使T、B淋巴细胞的激活[5, 6]。由此推测自噬对EAE中炎症反应的发生、发展都可能存在着一定的调节作用。本实验初步探讨自噬与EAE炎症反应的可能联系,旨在为多发性硬化的治疗寻求新的靶点。
1 材料与方法 1.1 材料与试剂自噬抑制剂3甲基腺嘌呤(3-Methyladenine,3-MA)、 完全弗氏佐剂、兔抗小鼠多克隆微管相关蛋白1轻链3B(LC3B)抗体(Sigma公司),兔抗小鼠Iba-1多克隆抗体、兔抗小鼠IL-1β多克隆抗体(武汉三鹰生物技术有限公司),山羊抗兔IgG-HRP(Santa Cruz公司),髓鞘少突胶质细胞糖蛋白MOG35-55(西安联美生物科技有限公司),卡介苗购自中国生物制品研究所,百日咳菌液由中国药品生物制品检定所赠送。
1.2 实验动物80只雌性C57BL/6小鼠(8~10周龄),购自重庆医科大学动物实验中心。所有小鼠在相同环境下喂养,饲养及实验过程符合《实验室动物饲养和使用条例》。
1.3 实验性自身免疫性脑脊髓炎模型的建立MOG35-55多肽2.0 mg/L溶于PBS (0.01 mmol/L,pH 7.2)中,与完全弗氏佐剂CFA(含卡介苗10 g/L)等体积混合成乳浊液,于小鼠四肢皮下注射(0.2 mL/只),并于免疫后0 h和48 h腹腔注射百日咳菌稀释液(15 μL/kg)。
1.4 动物处理及标本采集实验组动物分为正常对照组、EAE模型组和EAE+ 3-MA组。正常对照组、EAE模型组和EAE+3-MA组自免疫后0 d开始腹腔注射3-MA(100 nmol/μL,2 μL/d)。分别于3、7、16、30 d麻醉处死,取脑白质、脊髓腰膨大和颈膨大段组织。
1.5 神经功能评分观察正常对照组、EAE模型组和EAE+3-MA组动物每日体质量变化及活动情况,参照五分评分法[7]对各组小鼠进行神经功能评分。0分:正常,无发病;1分:动物尾部无力;2分:双后肢无力;3分:双后肢麻痹;4分:双后肢加前肢瘫痪;5分:濒死或死亡。症状介于两者之间取均值,达到或超过1级为临床发病。
1.6 Western blot检测LC3B、IL-1β表达新鲜脑脊髓组织经RIPA裂解液裂解提取全蛋白,BCA法测定蛋白浓度,经电泳、转膜、封闭后加入LC3B、IL-1β和β-actin一抗(1:1 000),4 ℃孵育过夜;加入二抗(山羊抗兔)37 ℃孵育2 h,加入ECL显影液,凝胶成像仪成像,Quantity One软件分析蛋白表达水平。
1.7 免疫组化检测小胶质细胞激活情况石蜡切片常规脱蜡、脱水、修复,山羊血清封闭,加入IBA1多抗(1:100)4 ℃孵育过夜;滴加兔SABC试剂盒检测试剂,DAB显色,苏木精复染,盐酸酒精分化,碳酸锂返蓝,于光镜下观察。
1.8 统计学分析采用SSPS 17.0统计软件,数据以 ±s表示,多组间比较行单因素方差分析,方差齐时两两比较行LSD检验,方差不齐时行Tamhane检验。
2 结果 2.1 神经功能评分正常小鼠无发病。EAE小鼠最早于免疫后9 d开始发病,大多数集中在12~16 d发病,并于16~20 d达到疾病高峰。与EAE模型组相比,EAE+3-MA组小鼠发病时间提前,神经功能评分增高,疾病严重程度加重(P < 0.05,图 1)。
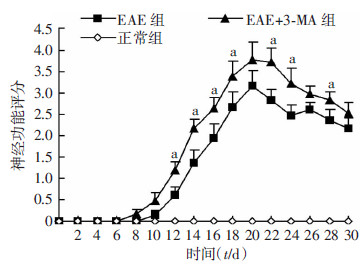 |
| a: P < 0.05,与同时间点EAE组比较 图 1 免疫后不同时间各组小鼠神经功能评分 |
Western blot检测结果显示,与正常对照组相比,EAE小鼠脑白质LC3-Ⅱ/LC3-Ⅰ水平在免疫后3 d无明显差异(P>0.05),免疫后7 d显著降低,16 d达最低,30 d时有所升高,但仍低于正常水平(P < 0.05,图 2)。
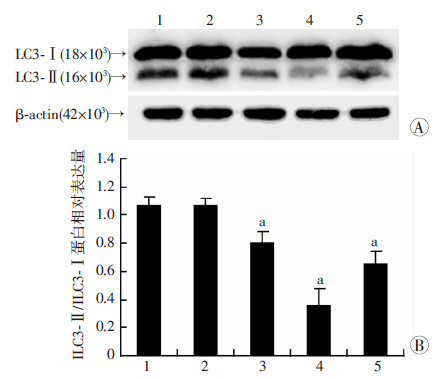 |
| 1:正常对照组;2:EAE免疫后3 d组;3:EAE免疫后7 d组;4:EAE免疫后16 d组;5:EAE免疫后30 d组A:Western blot检测;B:半定量分析a:P<0.05,与正常对照组比较 图 2 各组小鼠脑白质LC3-Ⅱ/LC3-Ⅰ的表达变化 |
免疫组织化学法标记小胶质细胞标记物Iba-1示小胶质细胞激活情况。结果显示,EAE免疫后7 d即有小胶质细胞激活,形态上表现为胞体变大,呈高度分枝状,细胞计数示与正常对照组[(1.6±0.5)个/HP]相比,EAE模型组激活的小胶质细胞个数明显增加[(20.2±2.8)个/HP,P < 0.01],而同时间点EAE+
3-MA组脑白质小胶质细胞激活数[(27.6±3.5)个/HP]高于EAE组(P < 0.05,图 3)。
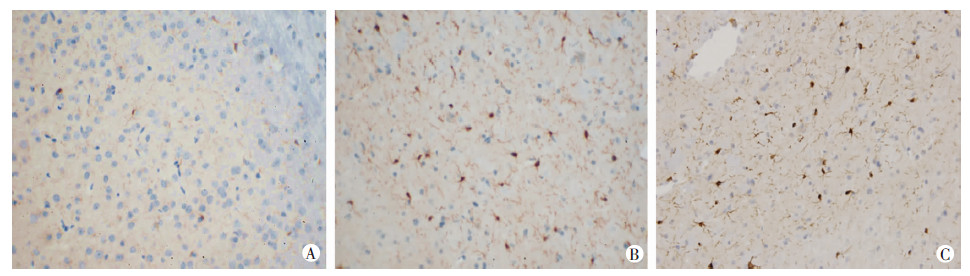 |
| A:正常对照组;B:EAE模型组;C:EAE+3-MA组 图 3 免疫组化观察各组小鼠小胶质细胞激活情况(IHC ×400) |
HE染色观察免疫后16 d疾病高峰期及30 d慢性期EAE小鼠脑白质炎细胞浸润情况。正常小鼠无明显炎细胞浸润,EAE小鼠免疫16 d可见大量炎细胞浸润在血管周围,呈典型“血管袖套样改变”,30 d时血管周围及脑实质仍有炎细胞浸润,但程度较急性期明显减轻。EAE+3-MA组炎细胞浸润程度均较同时间点EAE模型组加重。炎性浸润评分示与正常对照组(0.20±0.45)相比,EAE模型组16 d(2.80±0.84)、EAE+3-MA组16 d(3.30±0.45)、EAE模型组30 d(1.40±0.55)均明显升高(P < 0.01);与EAE模型组30 d组相比,EAE+3-MA组30 d(2.60±0.55)评分增高(P < 0.05,图 4)。
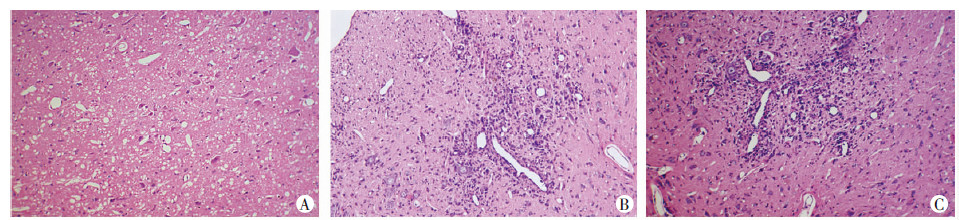 |
| A:正常对照组;B:EAE模型组16d;C:EAE+3-MA组 16d;D:EAE模型组 30d;E:EAE+3-MA组 30d 图 4 HE染色观察各组小鼠脑组织炎症浸润情况(×200) |
免疫后16、30 d,与正常对照组相比,EAE模型组IL-1β表达增高(P < 0.05),而EAE+3-MA组小鼠的IL-1β表达水平均较同时间点EAE模型组高(P < 0.05,图 5)。
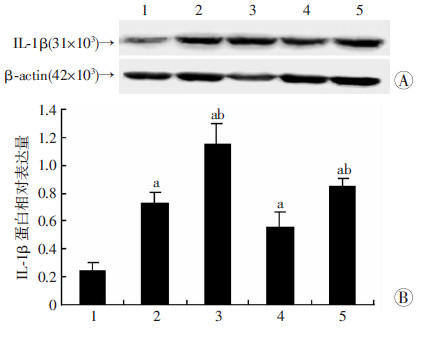 |
| 1:正常对照组;2:EAE模型组16 d;3:EAE+3-MA组16 d;4:EAE模型组30 d;5:EAE+3-MA组30 d A:Western blot检测;B:半定量分析a:P < 0.05,与正常对照组比较;b:P < 0.05,与同时间点EAE组比较 图 5 Western blot检测各组小鼠脑白质IL-1β的表达变化 |
多发性硬化一般认为是由T细胞介导的免疫反应而导致的脱髓鞘事件。新近研究发现,在MS患者复发前,最早出现的病理改变为少突胶质细胞凋亡,凋亡的少突胶质细胞通过表达αB-Crystallin可直接激活、聚集小胶质细胞,而此时并没有炎细胞浸润、白质脱髓鞘、轴突损伤等典型病理改变,称“激活前损伤 区”[8]。当小胶质细胞持续激活时,可通过释放TNF-α、 IL-1等多种细胞因子和趋化因子、蛋白分解酶、ROS、NOS等参与MS损伤形成过程,成为后续T、B淋巴浸润的使动因素[9, 10]。EAE是研究MS的经典模型。本课题组早期研究发现,在EAE免疫后3 d,即存在着线粒体损伤[11],损伤的线粒体通过释放ROS、cyt-c 导致少突胶质细胞发生凋亡,从而激活小胶质细胞。线粒体自噬是细胞清除体内损伤线粒体以及维持自身稳态的一种重要调节机制。在本课题组早期研究中,增加EAE中的自噬水平,可以有效阻止线粒体凋亡的发生。这可能会抑制疾病早期小胶质细胞的激活。此外,一系列研究证实,自噬也是免疫和炎症的重要介导者,它对T细胞有着前存活和前死亡的双重作用,自噬相关基因5(autophagy associated gene,Atg5)缺陷的T细胞受刺激后不能进行有效地增殖[12, 13]。同时,在MS患者及EAE小鼠的T细胞中,都发现存在着Atg5的升高[14],提示自噬与MS/EAE的T细胞免疫存在着一定相关性。而自噬与自身免疫的另一重要联系为自噬能调节细胞因子的分泌。研究证实,在LPS刺激下的离体培养的单核细胞中,抑制自噬会导致细胞的内源性促炎因子ROS、线粒体DNA无法清除,从而使IL-1β分泌的增加[5, 6]。IL-1β可促使ICAM-1的增加,导致炎细胞浸润;同时会使Th17细胞因子IL-17、IL-23 的分泌增加,导致T淋巴细胞的激活。这给我们自噬参与MS/EAE炎症调节的另一提示。
本研究表明,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ的表达在免疫后7 d即有降低,并在疾病高峰期(16 d)降至最低,30 d时仍处于较低水平。Dasgupta等[15]也证实在EAE慢性期LC3-Ⅱ/LC3-Ⅰ表达降低。3-MA是自噬抑制剂。对正常对照组、EAE模型组、EAE+3-MA组、EAE+PBS组进行检测,免疫组化染色结果显示EAE免疫后7 d(疾病早期)即有小胶质细胞的激活,EAE+3-MA组EAE小鼠小胶质细胞激活数量高于EAE模型组(P < 0.05)。Western blot检测结果显示,与正常对照组比较,免疫后16 d(急性期)及30 d(缓解期)EAE模型组高表达IL-1β(P < 0.05),而EAE+3-MA组IL-1β表达水平均高于同时间点EAE模型组(P < 0.05)。HE染色结果显示免疫后16 d及30 d EAE+3-MA组小鼠炎细胞浸润情况较同时间点EAE模型组加重(P < 0.05)。
自噬在EAE中的研究鲜有报道,本实验提出在EAE早期,即存在着自噬水平的降低,并贯穿疾病全程。进一步抑制自噬水平,可以促使疾病早期小胶质细胞激活,增高病程中IL-1β的表达水平及炎细胞浸润情况,加重神经功能缺损,所以EAE自噬水平的降低是导致疾病炎症反应发生发展的可能原因。这为治疗MS提供了新的临床思路和治疗策略。但本实验尚不能明确自噬降低的原因,有待进一步的研究。
| [1] | Proudfoot A E, de-Souza A L, Muzio V. The use of chemokine antagonists in EAE models[J]. J Neuroimmunol, 2008, 198(1/2): 27-30. |
| [2] | van-der-Valk P, Amor S. Preactive lesions in multiple sclerosis[J]. Curr Opin Neurol, 2009, 22(3): 207-213. |
| [3] | Bsibsi M, Holtman I R, Gerritsen W H, et al. Alpha-B-crystallin induces an immune-regulatory and antiviral microglial response in preactive multiple sclerosis lesions[J]. J Neuropathol Exp Neurol, 2013, 72(10): 970-979. |
| [4] | Bhattacharya A, Eissa N T. Autophagy and autoimmune crosstalks[J]. Front Immunol, 2013, 4: 88. |
| [5] | Nakahira K, Haspel J A, Rathinam V A, et al. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasomes[J]. Nat Immunol, 2011, 12(3): 222-230. |
| [6] | Peral-de-Castro C, Jones S A, Ni-Cheallaigh C, et al. Autophagy regulates IL-23 secretion and innate T cell responses through effects on IL-1 secretion[J]. J Immunol, 2012, 189(8): 4144-4153. |
| [7] | Chong W P, Horai R, Mattapallil M J, et al. IL-27p28 inhibits central nervous system autoimmunity by concurrently antagonizing Th1 and Th17 responses[J]. J Autoimmun, 2014, 50: 12-22. |
| [8] | van-Noort J M, van-den-Elsen P J, van-Horssen J, et al. Preactive multiple sclerosis lesions offer novel clues for neuroprotective therapeutic strategies[J]. CNS Neurol Disord Drug Targets, 2011, 10(1): 68-81. |
| [9] | van-Horssen J, Singh S, van-der-Pol S, et al. Clusters of activated microglia in normal-appearing white matter show signs of innate immune activation[J]. J Neuroinflammation, 2012, 9: 156. |
| [10] | van-Noort J M, Bsibsi M, Gerritsen W H, et al. Alphab-crystallin is a target for adaptive immune responses and a trigger of innate responses in preactive multiple sclerosis lesions[J]. J Neuropathol Exp Neurol, 2010, 69(7): 694-703. |
| [11] | Feng J, Tao T, Yan W, et al. Curcumin inhibits mitochondrial injury and apoptosis from the early stage in EAE mice[J]. Oxid Med Cell Longev, 2014, 2014: 728751. |
| [12] | Bell B D, Leverrier S, Weist B M, et al. FADD and caspase-8 control the outcome of autophagic signaling in proliferating T cells[J]. Proc Natl Acad Sci U S A, 2008, 105(43): 16677-166782. |
| [13] | Pua H H, Dzhagalov I, Chuck M, et al. A critical role for the autophagy gene Atg5 in T cell survival and proliferation[J]. J Exp Med, 2007, 204(1): 25-31. |
| [14] | Ben-Sasson S Z, Hu-Li J, Quiel J, et al. IL-1 acts directly on CD4 T cells to enhance their antigen-driven expansion and differentiation[J]. Proc Natl Acad Sci U S A, 2009, 106(17): 7119-7124. |
| [15] | Dasgupta A, Zheng J, Perrone-Bizzozero N I, et al. Increased carbonylation, protein aggregation and apoptosis in the spinal cord of mice with experimental autoimmune encephalomyelitis[J]. ASN Neuro, 2013, 5(1): e00111. |



