甲氨蝶呤(methotrexate,MTX)是一种叶酸拮抗剂,通过抑制叶酸代谢途径中的二氢叶酸还原酶达到抗细胞增殖的作用[1]。大剂量的MTX常用于肿瘤、白血病的治疗,最新的儿童急性淋巴性白血病诊疗方案提出甲氨蝶呤使用剂量为2~5 g/(m2·24 h),患者血清浓度可高达20 μmol/L[2, 3, 4]。常用检测方法主要有高效液相色谱法、荧光偏振免疫法、酶放大免疫法[3, 4, 5, 6, 7]。近年来MTX用于类风湿关节炎(rheumatoid arthritis,RA)、干燥综合征、银屑病关节炎等系统性自身免疫性疾病的治疗,常用剂量为5~20 mg/周,患者服药后24 h内血清MTX浓度最高为20 nmol/L,两者浓度相差了近1 000倍[3, 4, 5, 6, 7, 8, 9]。传统的检测方法很难检出,现常用高效液相色谱质谱法检测[9, 10],但色谱质谱法样本前处理较复杂,操作步骤也相对繁琐[11],且色谱质谱仪造价昂贵,检测成本高,不适合与大样本检测及基层开展。因此,建立一种稳定、快速、简便、成本低的MTX检测方法具有重要意义。本实验将NH2活性生物素(NH2-reactive biotin,BNHS)与MTX单抗IgG化学连接,采用亲和素-HRP酶标记系统,建立放大竞争酶联免疫吸附法,可用于检测人体血清中MTX浓度。以期为监测MTX在患者体内的代谢、分布、吸收提供简便、有效的方法。 1 材料与方法 1.1 材料 1.1.1 试剂
NH2活性生物素(NH2-reactive biotin,BNHS)、MTX单抗IgG(武汉Elabscience公司),辣根过氧化物酶标记的链亲和素SA-HRP(美国Sigma公司),MTX标准品(中国药品生物制品研究所),标记缓冲液(Labeling Buffer,LB)、四甲基联苯胺TMB(重庆予之生物公司)。 1.1.2 设备
洗板仪(BIOTEK ELX50)、酶标仪(BIOTEK ELX800)、恒温孵育箱(上海仪器厂 lw600)。 1.1.3 样本来源
实验用口服MTX的RA患者血清为患者检测完肝肾功后血清。 1.2 方法 1.2.1 NH2活性生物素标记MTX单抗IgG
取 1 mg MTX单抗IgG于1.5 mL离心管中,并加入0.5 mL LB;加入15 μL BNHS和475 μL LB至离心管中,37 ℃ 恒温箱中避光温育30 min。加入适量0.5 mL LB至离心管中,并轻吹打混匀,12 000×g离心10 min。 加0.2 mL LB至离心管中,轻吹打。将滤芯倒转放置于另一个离心管中,6 000×g离心10 min。
1.2.2 BA-c ELISA的测定步骤 用CBS溶液溶解MTX,100 μL包被96孔酶标板,4 ℃下放置过夜。次日用SPBST溶液250 μL 37 ℃封闭2 h,加入NH2活性生物素标记MTX单抗IgG 50 μL和MTX溶液或者待检血清50 μL 37 ℃温育。用300 μL PBST洗液洗涤3次,再加入SA-HRP 100 μL 37 ℃温育30 min,用300 μL PBST洗液洗涤3次,加入TMB避光37 ℃温育15 min,加入50 μL终止液终止反应,450 nm测定光密度值[D(450)]。
将BNHS标记MTX单抗IgG以10倍比稀释后,C0为储备液浓度,C为倍比稀释后工作液浓度。应用直接ELISA的方法,测定标记后抗体与包被于酶标板上的MTX反应浓度,MTX包被浓度为2 μg/mL,用空白SPBST溶液做对照,结果说明BNHS标记MTX单抗IgG可特异性与MTX结合(图 1)。
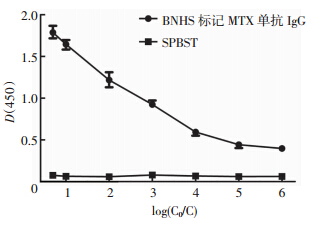 |
| 图 1 BNHS标记MTX单抗IgG滴度测定 |
分别以8、4、2、1 μg/mL和0.5 μg/mL的MTX抗原包被96孔酶标板,加入10倍比稀释的将BNHS标记MTX单抗IgG溶液,C0为储备液浓度,C为倍比稀释后 工作液浓度,采用直接ELISA方法,检测反应光密度值,结果显示:1.0 μg/mL的抗原为最优包被浓度,在此包被浓度下,光密度值下降,最快的抗体稀释度为103~104 。 2.3 BNHS标记MTX单抗IgG抗体与SA-HRP反应浓度及反应时间、温度确定
实验最佳条件为:BNHS标记MTX单抗IgG抗体稀释度为3 200倍,SA-HRP最佳稀释度为2倍,反
应温度为37 ℃,反应时间30 min。
2.4 标准曲线建立2.4 标准曲线建立
对所获得的标准曲线采用四参双Log曲线拟合法(图 2A),由于在0.1~10 ng/mL,曲线为良好的线性关系,且此段的斜率最大,根据Log(A)对Log(C)进行回归分析,得到一条直线(图 2B),由图 2B可以得出:
y=-0.477 2x-0.147 2,R2=0.990 2。
 |
| A:四参双Log曲线;B:标准曲线图 2 MTX BA-cELISA的标准曲线 |
测定30份空白SPBST溶液,运用四参双Log曲线拟合法计算,均值 为 0.110 ng/mL,标准差SD为0.009 ng/mL,以 +3SD为最低检测限,理论上本方法的检测下限为0.137 ng/mL,但考虑到实际检测工作的需要和可能的误差,我们将本方法的检测下限设定为0.2 ng/mL。对标准曲线的零标准重复10次测定,均值 为0.097 ng/mL,标准差SD为0.005 ng/mL, -2SD为测定灵敏度,检测灵敏度为0.087 ng/mL。 2.5.2 准确度
将MTX添加到SPBST溶液中,配置0.2、1、2.5、5、7.5、10 ng/mL MTX溶液,设5个重复,以回收率和RSD确定其准确度。结果见表 1。
原始浓度 (ng/mL) | 回收浓度值 (ng/mL) | 回收率 (%) | RSD (%) |
| 0.2 | 0.205±0.017 | 102.3±7.4 | 7.2 |
| 1 | 1.051±0.166 | 105.1±14.9 | 14.2 |
| 2.5 | 2.498±0.431 | 99.9±15.4 | 15.4 |
| 5 | 4.711±0.279 | 94.2±5.0 | 5.3 |
| 7.5 | 7.809±1.356 | 104.1±16.2 | 15.6 |
| 10 | 11.276±2.233 | 112.8±20 | 17.7 |
以批间、批内差异来确定本方法的精密度,分别设1、2.5、5、7.5 ng/mL 4个水平的待测样本,同一样本分别测5个批次,每个批次分别测5次。结果见表 2。
原始浓度 (ng/mL) | 批间差异 | 批内差异 | ||
| 测得浓度值 (ng/mL) | RSD (%) | 测得浓度值 (ng/mL) | RSD (%) | |
| 1 | 0.99±0.11 | 9.5 | 1.00±0.04 | 3.3 |
| 2.5 | 2.40±0.27 | 9.9 | 2.41±0.24 | 8.7 |
| 5 | 4.66±0.39 | 7.6 | 4.83±0.23 | 4.3 |
| 7.5 | 7.64±0.57 | 6.7 | 7.89±0.73 | 8.3 |
检测32例口服MTX的RA患者血清中MTX含量,将患者血清稀释10倍后,测得26有效血药浓度0.4~3.35(2.4±0.27)ng/mL,有6例患者血清中未检测出MTX。 3 讨论
ELISA是一种简便、灵敏度及特异度高的检测方法,广泛用于各种血药浓度检测。传统双抗夹心ELISA法可检测MTX的血药浓度为μg/mL数量级[7, 8, 9, 10, 11, 12],可用于大剂量MTX使用患者的血药浓度检测。小剂量治疗量的自身免疫性疾病患者血清中MTX浓度为ng/mL数量级,传统的ELISA检测方法无法检测MTX小剂量治疗量患者血清中药物浓度[13, 14, 15, 16]。 生物素-亲和素之间的亲和常数可达1015L/mol,且一个亲和素分子可标记多个酶分子[12],因而可提高反应体系的灵敏度,与常规双抗夹心ELISA法相比可将线性范围及检测限向下扩展2~3个数量级[16]。因此本研究采用生物素-亲和素偶联放大竞争酶联免疫吸附法测定甲氨蝶呤,并对该方法检测效能进行评估。
本研究将NH2活性生物素与MTX单抗IgG化学连接,采用亲和素-HRP酶标系统,建立了放大竞争ELISA法。本方法的检测灵敏度为0.087 ng/mL,较之前的方法检测灵敏度、检测下限、检测范围向下扩展了3个数量级。且本实验的四参双Log曲线拟合法(R2=0.996 2)。本实验回收率平均为103.0%;RSD平均为13.5%,小于15%,表明本方法具有较高的准确度。平均批内差异为6.5%,平均批间差异为8.3%,均小于10%,表明本方法具有较好的精密度。检测口服MTX的RA患者血清中MTX血药浓度0.4~3.35 ng/mL,与其他报道基本相符[9, 10]。因此,本实验所建立的生物素-亲和素偶联放大竞争酶联免疫吸附法可用于临床MTX血药浓度的检测。
| [1] | Wei Y, Luo L, Ding Y, et al. Highly sensitive determination of methotrexate at poly (l-lysine) modified electrode in the presence of sodium dodecyl benzene sulfonate[J]. Bioelectrochemistry, 2014, 98: 70-75. |
| [2] | Bhojwani D, Sabin N D, Pei D, et al. Methotrexate-induced neurotoxicity and leukoencephalopathy in childhood acute lymphoblastic leukemia[J]. J Clin Oncol, 2014, 32(9): 949-959. |
| [3] | 唐罗丽. 高剂量甲氨蝶呤对治疗儿童急性淋巴细胞白血病的疗效及预后影响[J]. 临床合理用药杂志, 2014, 7(12): 14-15. |
| [4] | Xu W Q, Zhang L Y, Chen X Y, et al. Serum creatinine and creatinine clearance for predicting plasma methotrexate concentrations after high-dose methotrexate chemotherapy for the treatment for childhood lymphoblastic malignancies[J]. Cancer Chemother Pharmacol, 2014, 73(1): 79-86. |
| [5] | 王军, 宋森花, 郑云艳, 等. 大剂量甲氨蝶呤在治疗急性淋巴细胞白血病中血药浓度监测的意义[J]. 华南国防医学杂志, 2014, 28(3): 215-217. |
| [6] | 张诗海, 孙丽. 高效液相色谱法测量患儿血清甲氨蝶呤浓度[J]. 国际检验医学杂志, 2014, 35(13): 1762-1763. |
| [7] | 张媛媛, 徐康康. 三种检测方法测定甲氨蝶呤血药浓度的比较分析[J]. 安徽医药, 2014, 18(2): 357-360. |
| [8] | Zhu Z, Wu H, Wu S, et al. Determination of methotrexate and folic acid by ion chromatography with electrochemical detection on a functionalized multi-wall carbon nanotube modified electrode[J]. J Chromatogr A, 2013, 1283: 62-67. |
| [9] | Mo X, Wen Y, Ren B, et al. Determination of erythrocyte methotrexate polyglutamates by liquid chromatography/tandem mass spectrometry after low-dose methotrexate therapy in Chinese patients with rheumatoid arthritis[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 907: 41-48. |
| [10] | Schiff M H, Jaffe J S, Freundlich B. Head-to-head, randomised, crossover study of oral versus subcutaneous methotrexate in patients with rheumatoid arthritis: drug-exposure limitations of oral methotrexate at doses≥15 mg may be overcome with subcutaneous administration[J]. Ann Rheum Dis, 2014, 73(8): 1549-1551. |
| [11] | 任秀华, 杜光, 刘东. 液相色谱串联质谱法测定人血浆中甲氨蝶呤的血药浓度及其临床应用[J]. 中国医院药学杂志, 2014, 34(10): 801-804. |
| [12] | Hermanson G T. Chapter 11 - (Strept)avidin-Biotin Systems[M]// Hermanson G T. Bioconjugate Techniques. 3rd ed. Boston: Academic Press, 2013: 465-505. |
| [13] | 臧亮, 王东, 邓雪莲, 等. ISO15189在酶联免疫检测性能验证方法的探讨[J]. 中国输血杂志, 2014, 27(7): 689-691. |
| [14] | Wang L, Zhang L J, Lv W, et al. Determination of organophosphorus pesticides based on biotin-avidin enzyme-linked immunosorbent assay[J]. Chinese J Anal Chem, 2011, 39(3): 346-350. |
| [15] | 贾国超, 职爱民, 李梦琴, 等. 氟罗沙星残留检测间接竞争ELISA试剂盒的研制[J]. 中国农业科学, 2014, 47(11): 2251-2261. |
| [16] | 张晟, 罗弟祥, 刘怡, 等. 生物膜干涉技术、HPLC及ELISA在抗体定量检测中的比较分析[J]. 免疫学杂志, 2014, 30(4): 338-341. |



