逼尿肌过度活动症(detrusor overactivity,DO)是一种常见的临床问题,主要表现为尿频、尿急和夜尿增加[1]。它的发病机制尚不清楚,治疗困难。膀胱流出道部分梗阻是引起DO的主要原因,其机制可能涉及肌源性和神经源性的改变[2]。 也有研究表明细胞间通讯的改变在DO的形成中发挥着重要的作用,相比于正常组,DO组细胞间通讯的功能及CX43的表达明显增加[3, 4]。CX43作为一种磷蛋白,其不同的磷酸化修饰状态会影响细胞间通讯的功能[5, 6],但是CX43的磷酸化修饰的改变是否在DO的形成中起作用仍然未知。
蛋白磷酸酶(PP)1和PP2A是体内广泛分布的丝氨酸/苏氨酸蛋白磷酸酶,执行着真核细胞内超过90%的丝氨酸/苏氨酸的去磷酸化功能。PP1和PP2A可能会和CX43形成一种蛋白复合体调节CX43的去磷酸化[6]。本研究目的在于探索CX43蛋白磷酸化修饰的改变在DO中的作用以及PP1和PP2A对CX43蛋白磷酸化修饰的影响。 1 材料与方法 1.1 主要试剂
多克隆CX43抗体(Zymed),单克隆CX43抗体(Zymed),PP1抗体(Santa),PP2A抗体(BD),二抗(武汉博士德),荧光二抗(碧云天),DAPI(碧云天),BSA(Biosharp),胰酶抑制剂(Sigma),Ⅱ型胶原酶 (Sigma),D-Hanks液(武汉博士德),胎牛血清(Gibco),改良型RPMI-1640培养基(HyClone),6羧基二乙酸荧光素(6-CFDA)(Sigma),碱性磷酸酶(NEB)。 1.2 动物及分组
雌性SD大鼠60只,体质量150~180 g,由第三军医大学大坪医院实验动物中心提供。按照随机数字表法将60只SD大鼠分为正常组和模型组,正常组20只,模型组40只。 1.3 膀胱流出道部分梗阻模型的建立
模型组的建立参照我们之前的方法[3]略有修改:2%的戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,下腹部备皮,将PE50导管蘸取适量甘油后经尿道外口插入膀胱内,于大鼠下腹部正中切开一约2 cm切口,暴露膀胱颈部,仔细分离膀胱颈部,3-0丝线结扎膀胱颈部,结扎的松紧度以牵拉导管有一定阻力为准,拔出导管,腹腔内给予庆大霉素0.5 mg/kg,逐层缝合关闭腹部切口。正常组除未给予膀胱颈部的结扎外,其余操作均与模型组方法相同。 1.4 尿动力学验证DO模型
建模6周后进行尿动力学检测。20%乌拉坦腹腔注射麻醉,剂量为1 g/kg。大鼠仰卧位固定四肢,75%酒精对尿道外口及下腹部进行消毒,将长约15 cm的PE50导管经尿道插入膀胱,轻压大鼠下腹部,排出膀胱内残余的尿液,导管经三通管与压力传感器及微量灌注泵相连,微量灌注泵以10 mL/h的速度将37 ℃生理盐水泵入膀胱内,于RM6240C型多道生理信号采集处理系统上记录膀胱的压力曲线,参数设定为:压力模式,扫描速度10 s/div,灵敏度12.5 cmH2O,直流,频率100 Hz。尿动力学检测若出现明显的非排空性收缩则认为建模成功。 1.5 Western blot检测
大鼠断颈处死,将取出的膀胱组织先用PBS清洗1遍,加入预冷的RIPA裂解液中,尽量剪碎,转入匀浆器中冰上研磨。4 ℃,12 000 r/min离心15 min,吸取上清液,即为膀胱组织的总蛋白。RC-DC法测定蛋白浓度。蛋白变性后经12%的SDS-PAGE凝胶电泳分离,将蛋白转到PVDF膜上。3% BSA封闭2 h。4 ℃,一抗孵育过夜。洗膜3次,每次10 min。二抗室温下孵育1 h。洗膜4次,每次10 min。ECL化学发光试剂盒于凝胶成像仪中检测蛋白的表达情况。 1.6 免疫荧光染色
膀胱组织进行冰冻切片,切片厚度为5 μm,4%多聚甲醛固定30 min,PBS漂洗3次,每次5 min。封闭液封闭2 h。4 ℃,一抗孵育过夜。PBS漂洗3次,每次10 min。荧光二抗孵育1 h。PBS漂洗3次,每次10 min。DAPI染核10 min。PBS漂洗3次,每次10 min。封片剂封片。激光共聚焦荧光显微镜下观察。Image-Pro Plus软件分析荧光强度。 1.7 膀胱平滑肌细胞的原代分离
大鼠膀胱取出后放入D-Hanks液中,仔细剥离黏膜层及浆膜层后,置于配有BSA(2 mg/mL)、胰酶抑制剂(2 mg/mL)、Ⅱ型胶原酶(2 mg/mL)的D-Hanks液中,尽量剪碎,37 ℃消化30~40 min,吹打约200次,加入含血清的培养基终止消化,离心去上清,加入培养液,继续吹打进一步释放细胞[7],200目筛子过滤后将细胞转入激光共聚焦培养皿中培养24 h待用。 1.8 荧光淬灭恢复实验(FRAP)
细胞取出后PBS清洗1遍,加入10 μg/mL的6-CFDA 1 mL,37 ℃孵箱中孵育30 min,PBS清洗3遍,正常组和DO组加入培养液,DO+AP组加入含AP(10 U/mL)的培养液[8],上机待测。镜下选取视野并确定淬灭细胞,获得淬灭前细胞的图像,对目标细胞进行淬灭,监测从淬灭开始的5 min内的荧光强度变化。每个样本取6个视野进行FRAP实验,以6个样本的平均值作为该样本的实验结果。荧光恢复率计算公式为:(5 min时的荧光强度-淬灭时荧光强度)/(淬灭前荧光强度-淬灭时荧光强度)。 1.9 统计学分析
数据处理采用SPSS 16.0软件进行统计学分析,结果以x±s表示。两组间比较采用t检验,3组间比较采用单因素方差分析。
2 结果
2.1 DO模型的建立
对模型组的40只大鼠进行了膀胱出口梗阻的结扎,经尿动力学检测,共23只大鼠被纳入DO组。 2.2 CX43蛋白不同磷酸化修饰状态的表达
CX43蛋白是一种磷蛋白,图 1中的3个条带分别代表其不同的磷酸化修饰状态,P0为CX43蛋白未磷酸化的条带,P1和P2为其磷酸化后的条带。为探索CX43蛋白不同的磷酸化修饰对DO的作用,我们检测正常组和DO组的CX43蛋白的表达 情况。实验证实,DO组的P0(P<0.05)、P1(P<0.05)、P2(P<0.05)蛋白的表达均高于正常组(图 1)。
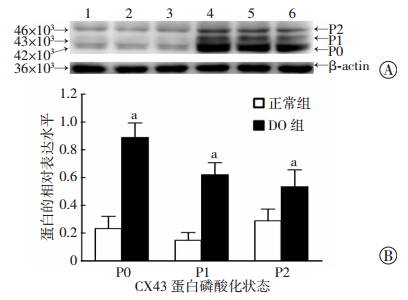 |
| A:Western blot检测结果 1~3:正常组;4~6:DO组;B:半定量分析结果 a:P<0.05,与正常组比较 图 1 Western blot检测正常组和DO组的CX43蛋白磷酸 化修饰水平的变化 |
与正常组相比,DO组膀胱中的PP1蛋白表达变化无统计学差异(P>0.05),而PP2A蛋白的表达明显降低(P<0.05)(图 2)。
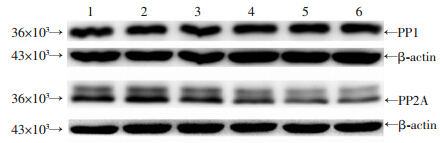 |
| 1~3:正常组;4~6:DO组 图 2 Western blot检测正常组和DO组的PP1、PP2A 的表达变化 |
免疫荧光双染进一步验证CX43、PP1和PP2A蛋白的表达变化并进行定位。如图 3,DO组CX43蛋白的表达高于正常组(P<0.05),PP2A的表达低于正常组(P<0.05),PP1的表达两组间无统计学差异(P> 0.05)。此外,共定位发现细胞膜上CX43与PP1、PP2A 的表达位置相同。
 |
| 图 3 免疫荧光双染检测正常组和DO组的CX43、PP1和PP2A蛋白的表达变化并进行共定位 |
FRAP实验是通过高强度的激光照射目标细胞,使该细胞荧光分子淬灭,而周边的未淬灭细胞的荧光分子会通过缝隙连接扩散到目标细胞,借助低强度的激光进行扫描可以获得目标区域荧光信号的变化。用荧光恢复率表示细胞间的GJIC。FRAP实验证实DO组细胞间通讯的功能强于正常组(P<0.05),去磷酸化后的DO+AP组的GJIC明显低于正常组和DO组(P<0.05,图 4),按照GJIC由强到弱的排序为:DO组>正常组>DO+AP组,这说明CX43蛋白的磷酸化修饰水平的升高可能会增强GJIC功能。
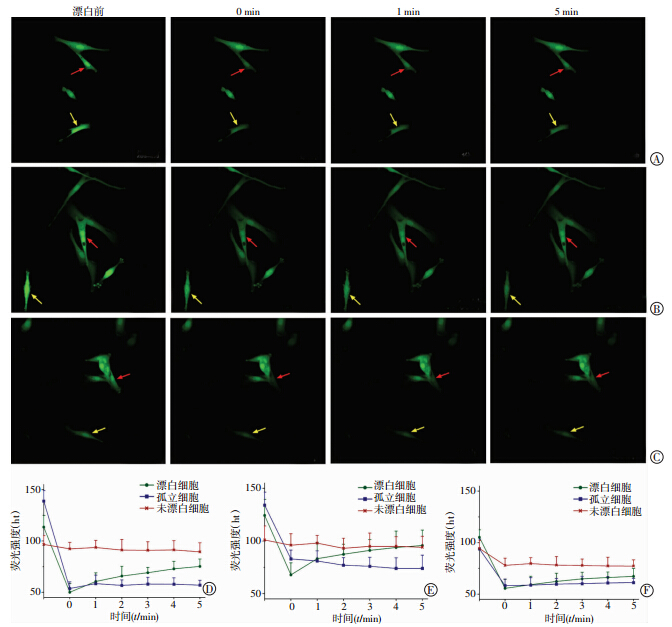 |
| A:正常组;B:DO组;C:DO+AP组 黄色箭头:孤立细胞;红色箭头:漂白细胞;D:正常组统计分析;E:DO组统计分析;F:DO+ AP组统计分析 图 4 FRAP检测正常组、DO组、DO+AP组的GJIC (激光共聚焦显微镜×400) |
膀胱是一个具有功能合胞体特性的器官,其在排尿的过程中能够通过逼尿肌的协同收缩进而达到排尿的目的,逼尿肌间的这种协同收缩是在多种因素的参与下实现的,这些因素包括神经因素、内分泌因素及细胞间通讯的因素等[5]。Brading[9]研究发现,离体的膀胱在排除了神经及内分泌因素的影响后,仍然具有协同收缩的特性,这表明细胞间的通讯可能在膀胱逼尿肌的协同收缩中发挥着重要的作用[10]。
缝隙连接是存在于相邻细胞膜上的一种连接通道结构,可以允许相对分子质量小于1×103的物质(离子、第二信使等)通过,从而实现电信号和化学信号在细胞间的传递即细胞间通讯[11, 12]。缝隙连接由相邻细胞膜上的两个连接子相互锚定构成,而每个连接子又是由6个亚单位-连接蛋白(connexon,Cx)组成,目前已发现21种Cxs,不同的Cxs是根据其相对分子质量的大小进行命名[13]。Cxs的表达存在组织特异性[14, 15],膀胱组织中主要表达的连接蛋白是CX43[3]。
CX43蛋白是一种磷蛋白,共有3种状态(P0、P1和P2),P0为非磷酸化的CX43蛋白,P1和P2是在非磷酸化的CX43蛋白的丝氨酸位点分别加入1个和2个磷酸基团,P1和P2的磷酸化是在CX43蛋白到达细胞膜之前完成的,可能参与了CX43蛋白从内质网到组装成连接子的整个过程,但是其对GJIC的影响仍然有待与进一步阐明[17]。有研究发现,心肌中的CX43蛋白磷酸化修饰水平的升高会增强细胞间通讯的功能,进而增加心肌的兴奋性[5]。因此我们提出假设: CX43的磷酸化修饰水平的升高在可能在DO的形成中发挥着重要的作用。首先我们通过Western blot实验证实:CX43蛋白的磷酸化修饰和非磷酸化修饰的蛋白均增加。进而我们对GJIC进行了检测,结果显示DO组GJIC强于正常组,而在加入碱性磷酸酶后其GJIC明显降低,这说明磷酸化修饰的CX43蛋白在膀胱的GJIC中发挥着重要的作用。这些证据证明了我们的假设:CX43的磷酸化修饰水平的升高在可能在DO的形成中发挥着重要的作用。
PP1和PP2A是体内广泛分布的丝氨酸/苏氨酸蛋白磷酸酶,执行着真核细胞内超过90%的丝氨酸/苏氨酸的去磷酸化功能,那么PP1和PP2A在DO中的CX43蛋白的磷酸化水平上调发挥怎样的作用呢?本研究证实,DO组PP2A的表达较正常组明显降低,这说明PP2A的表达水平降低可能在CX43蛋白的磷酸化水平上调中发挥着重要的作用。免疫双染证实细胞膜上的CX43蛋白与PP1、PP2A表达位置相同,这说明膀胱中的PP1、PP2A可能与CX43蛋白在细胞膜上形成蛋白复合体[5],进而在调控CX43蛋白的磷酸化中发挥着重要的作用。
综上,本研究通过Western blot、免疫双染和FRAP实验证实: CX43蛋白磷酸化水平的上调可能在DO的发病过程中发挥着重要的作用,而这种磷酸化水平的上调可能与PP2A蛋白的表达降低有关。这为DO的发病机制研究和寻找可能的治疗方案提供了理论依据。
| [1] | Kumar V, Cross R L, Chess-Williams R, et al. Recent advances in basic science for overactive bladder[J]. Curr Opin Urol, 2005, 15(4): 222-226. |
| [2] | Greenland J E, Brading A F. The effect of bladder outflow obstruction on detrusor blood flow changes during the voiding cycle in conscious pigs[J]. J Urol, 2001, 165(1): 245-248. |
| [3] | Li L, Jiang C, Hao P, et al. Changes of gap junctional cell-cell communication in overactive detrusor in rats[J]. Am J Physiol Cell Physiol, 2007, 293(5): C1627-C1635. |
| [4] | Drake M J, Hedlund P, Harvey I J, et al. Partial outlet obstruction enhances modular autonomous activity in the isolated rat bladder[J]. J Urol, 2003, 170(1): 276-279. |
| [5] | Ai X, Pogwizd S M. Connexin 43 downregulation and dephosphorylation in nonischemic heart failure is associated with enhanced colocalized protein phosphatase type 2A[J]. Circ Res, 2005, 96(1): 54-63. |
| [6] | Beardslee M A, Lerner D L, Tadros P N, et al. Dephosphorylation and intracellular redistribution of ventricular connexin43 during electrical uncoupling induced by ischemia[J]. Circ Res, 2000, 87(8): 656-662. |
| [7] | Zhong X, Deng J, He P, et al. Reverse mode of the sodium/calcium exchanger subtype 3 in interstitial cells of Cajal from rat bladder[J]. Urology, 2013, 82(1): 254. e7-254.e12. |
| [8] | Alexander R D, Morris P C. A proteomic analysis of 14-3-3 binding proteins from developing barley grains[J]. Proteomics, 2006, 6(6): 1886-1896. |
| [9] | Brading A F. A myogenic basis for the overactive bladder[J]. Urology, 1997, 50(6A Suppl): 57-67, 68-73. |
| [10] | Fry C H, Sui G P, Severs N J, et al. Spontaneous activity and electrical coupling in human detrusor smooth muscle: implications for detrusor overactivity?[J]. Urology, 2004, 63(3 Suppl 1): 3-10. |
| [11] | Leithe E, Sirnes S, Omori Y, et al. Downregulation of gap junctions in cancer cells[J]. Crit Rev Oncog, 2006, 12(3/4): 225-256. |
| [12] | Harris A L. Connexin channel permeability to cytoplasmic molecules[J]. Prog Biophys Mol Biol, 2007, 94(1/2): 120-143. |
| [13] | Sohl G, Willecke K. Gap junctions and the connexin protein family[J]. Cardiovasc Res, 2004, 62(2): 228-232. |
| [14] | Oyamada M, Oyamada Y, Takamatsu T. Regulation of connexin expression[J]. Biochim Biophys Acta, 2005, 1719(1/2): 6-23. |
| [15] | Saez J C, Berthoud V M, Branes M C, et al. Plasma membrane channels formed by connexins: their regulation and functions[J]. Physiol Rev, 2003, 83(4): 1359-1400. |
| [16] | Lorentz R, Shao Q, Huang T, et al. Characterization of gap junction proteins in the bladder of Cx43 mutant mouse models of oculodentodigital dysplasia[J]. J Membr Biol, 2012, 245(5/6): 345-355. |
| [17] | Musil L S, Goodenough D A. Biochemical analysis of connexin43 intracellular transport, phosphorylation, and assembly into gap junctional plaques[J]. J Cell Biol, 1991, 115(5): 1357-1374. |



