角膜移植手术是治疗角膜盲患者唯一有效的方法[1]。据临床资料统计显示,88%的角膜植片可维持1年[2],仅55%的角膜植片可维持5年[3]。其中1/3的角膜移植手术失败均缘于角膜移植排斥反应,而在高危型角膜移植术后,排斥反应率达到50%以上[4]。先前的研究认为CD4+T细胞在角膜移植排斥反应中具有关键作用[5]。其中,IL-2/IL-2R/PI3K/mTOR介导的信号通路对CD4+T细胞的增殖和分化具有关键重要,IL-2R的α链(CD25)被认为是激活的T细胞的表面标志和早期排斥反应诊断的标准[6]。相反地,研究表明IL-2/CD25/JAK/STAT5介导的信号通路可诱导Treg细胞分化,上调FOXP3表达,进而维持免疫耐受[7]。因此,CD25在角膜移植排斥反应中是一把双刃剑。FOXP3是分化的Treg细胞的特异性标志,FOXP3表达水平可间接反映Treg细胞功能[8]。最近的研究指出抗炎分子IL-10也能诱导Treg细胞分化,上调FOXP3表达,升高的FOXP3下调IL-2表达,最终调节CD25水平[9]。综上所述,FOXP3的表达受到CD25与IL-10的调节,而CD25对角膜移植排斥反应具有重要作用。先前大量的实验着重于对单个分子在角膜移植排斥反应中作用的探讨,而因子之间的相互作用却研究得甚少。本实验通过RNAi干扰技术探讨CD25siRNA基因治疗对大鼠穿透性角膜移植排斥反应的作用,以及检测术后植片中IL-10和FOXP3含量变化规律。
1 材料与方法 1.1 实验材料健康成年清洁级SD大鼠作为受体,雌性,体质量200~220 g,购自重庆医科大学实验动物中心;健康成年清洁级Wistar大鼠作为供体,雌性,体质量200~220 g,购自北京医科大学实验动物中心。动物均符合国家医用动物使用标准。CD25siRNA和反义CD25siRNA均合成于上海吉玛制药技术有限公司。EntransterTM体内纳米转染试剂购自北京英格恩公司。PCR引物由上海捷瑞生物工程有限公司合成。
1.2 EntransterTM纳米转染试剂的制备参照说明书,将25 μg干粉状CD25siRNA基因溶于25 μL DEPC水中混匀,再加入25 μL 10%葡萄糖溶液,充分混匀作为试剂1。取12.5 μL EntransterTM体内转染试剂置于25 μL 10%葡萄糖溶液和12.5 μL DEPC水中,充分混匀作为试剂2。将试剂2加入到试剂1中,立即充分振荡混匀,即配制成50 μL EntransterTM-CD25siRNA 转染试剂,室温静置15 min后即可使用。相同的方法配制50 μL EntransterTM-反义CD25siRNA 转染试剂。50 μL的生理盐水作为空白转染试剂。将3种转染试剂配好备用。
1.3 大鼠穿透性角膜移植模型的分组及建模取84只SD大鼠作为角膜受体,42只Wistar大鼠作为供体。手术前用裂隙灯检查所有大鼠排除角膜疾病。采用单纯随机抽样法将受体大鼠分为对照组 (A组)、EntransterTM-反义CD25siRNA转染组(B组) 和EntransterTM-CD25siRNA 转染组(C组),每组28只。大鼠正位穿透性角膜移植手术参照Williams和Coster方法[10],Wistar大鼠双眼角膜作为供体,SD大鼠右眼作为移植眼。供体、受体术前均用3%戊巴比妥钠溶液腹腔注射麻醉。术眼0.5%复方托吡卡胺滴眼液充分散瞳后,用盐酸奥布卡因滴眼液进行眼表麻醉,手术显微镜(德国Leica-M841型)下严格无菌操作。用直径3.5 mm环钻钻取供体眼角膜,置于角膜保存液中备用。用直径3.0 mm环钻钻取受体右眼中央区角膜作为植床,将供体植片置于植床,用10-0尼龙线(Alcon,美国)间断对称缝合8针,线头暴露。用一个直径为5 mm的自制光滑圆筒协助,将50 μL生理盐水滴于A组大鼠眼表并维持5 min后,用消毒棉签擦拭眼表多余液体。用相同方法分别将50 μL EntransterTM-CD25siRNA转染试剂和50 μL EntransterTM-反义CD25siRNA 转染试剂滴于B组和C组大鼠眼表。0.2万单位庆大霉素结膜下注射后,涂红霉素眼膏于大鼠结膜囊内,并用7-0皮肤缝线缝合睑缘1针。次日拆除皮肤缝线,每日给予0.25%氯霉素滴眼液点眼3次,每次1~2滴。
1.4 术后观察术后大鼠每日行裂隙灯检测,参照Larkin等[11]的评分标准从混浊、水肿和新生血管3项指标对角膜植片进行评分并记录。①植片混浊分级。0级:完全透明;1级:透明度轻度丢失;2级:透明度中度丢失,虹膜血管可见;3级:虹膜血管窥不清,但瞳孔轮廓可见;4级:瞳孔轮廓不清。②植片水肿分级。0级:无水肿;1级:中度水肿;2级:伴有植片增厚的显著水肿。③新生血管分级。0级:无新生血管;1级:新生血管在任何象限伸入达到植片半径的25%;2级:新生血管达到植片半径50%;3级:新生血管达到植片半径的75%;4级:新生血管达到植片的中央。以上3项评分之和定义为当日角膜移植的免疫排斥反应指数(rejection index,RI),RI≥5或植片混浊≥3时视为角膜移植排斥反应发生。术后大鼠患有白内障、前房出血、感染、虹膜前粘连等并发症,被剔除手术,并及时补充动物例数。
1.5 植片组织病理学及免疫组化检查每组分别在术后3、7、14、21 d各随机处死1只大鼠,取出完整角膜,置于4%多聚甲醛中固定,酒精脱水,常规石蜡包埋切片,厚度5 μm。取出部分切片行HE染色,显微镜观察植片形态。另取部分切片行免疫组织化学染色。切片脱蜡后置于梯度酒精中脱水,后行微波抗原修复和正常山羊血清封闭。参照说明书,加入兔抗大鼠CD25单克隆抗体(abcam公司,英国)作为一抗,置于4℃冰箱过夜,阴性对照用PBS代替。次日加入山羊抗兔IgG(武汉博士德生物工程有限公司)作为二抗,DAB显色,苏木精复染,显微镜观察植片CD25表达。
1.6 qPCR检测植片CD25、FOXP3、IL-10 mRNA的表达每组分别在术后3、7、14、21 d各随机处死3只大鼠,取出完整眼角膜,按照TaKaRa反转录试剂盒说明书将RNA反转录为cDNA后,在ABI7500 PCR仪上检测mRNA浓度。引物序列设计如下:GAPDH上游:5′-CAAGGTCATCCATGACAACTTTG-3′,下游:5′-GGGCCATCCACAGTCTTCTG-3′。CD25上游:5′-GAGGAAGAGCAGAAGAAC-3′,下游:5′-GTCTCGGGACTTCATAAC-3′。IL-10上游:5′-TGCCTTCAGTCAAGTGAAGACT-3′,下游:5′-AAACTCATTCATGGCCTTGTA-3′;FOXP3上游:5′-TGAGCTGGCTGCAATTCTGG-3′,下游:5′-ATCTAGCTGCTCTGCATGAGGTGA-3′。反应体系10 μL,反应程序为95℃退火10 min,共40个循环后,用2-ΔΔCt法对数据进行分析,以GAPDH值为内参。
1.7 Western blot检测植片CD25蛋白表达每组分别在术后3、7、14、21 d各随机处死3只大鼠,取出完整眼角膜,置于RIPA裂解液中提取总蛋白。采用BCA法测定总蛋白浓度后,将等量蛋白样品用12% SDS-PAGE分离,转移至聚偏氟乙烯膜(PVDF膜)。参照说明书,加入兔抗大鼠CD25单克隆抗体(Abcam公司,英国)于4 ℃冰箱孵育过夜,次日TBST洗PVDF膜后加入抗兔二抗,室温孵育2h后用凝胶成像系统拍照。Quantity One4.4.0软件分析光密度值并统计分析。
1.8 统计学处理数据用x±s表示。采用SPSS 11.5软件进行单因素方差分析,组间两两比较采用LSD-t检验。植片生存时间用Kaplan-Meier法和log-rank法分析。
2 结果 2.1 术后植片观察共10只大鼠因患手术并发症导致角膜移植失败,遂剔除实验,并补充动物模型例数。移植术后3~4 d,3组均可见少量小新生血管分布在植片缝线边缘,植片均透明。术后6~14 d,可见对照组和EntransterTM-反义CD25siRNA 转染组植片恶化加剧,表现为新生血 管长入迅速增多,角膜混浊水肿逐渐加重,至术后14 d,植片明显增厚,高度水肿,大量新生血管达到植片中央,瞳孔轮廓窥不清。然而,EntransterTM-CD25siRNA 转染组植片发展缓慢,至术后14 d,可见大量小新生血管分布在角膜边缘,少量新生血管穿透植片中央,角膜水肿加重,植片开始混浊,但仍可窥见虹膜血管。至术后21 d,EntransterTM-CD25siRNA 转染组植片仍维持较好的透明度,但角膜水肿和新生血管程度与对照组和 EntransterTM-反义CD25siRNA 转染组无显著差异(图 1)。
 |
| 图 1 CD25siRNA基因转染于大鼠穿透性角膜移植术后植片的裂隙灯观察 |
3组植片存活时间显示,EntransterTM-CD25siRNA 转染组植片存活时间明显延长至(14.83±0.72)d,而对照组和EntransterTM-反义CD25siRNA 转染组植片存活时间分别为(7.58±0.67)、(7.83±0.58)d,与EntransterTM-CD25siRNA 转染组植片存活时间比较有统计学差异(P < 0.05)。植片生存曲线显示EntransterTM-CD25siRNA 转染组植片生存率明显高于其余2组(P < 0.05,图 2)。在急性排斥反应期,EntransterTM-CD25siRNA 转染组植片的水肿、新生血管、混浊和排斥指数评分均明显低于其余2组(P < 0.05)。术后21 d,相对于对照组和EntransterTM-反义CD25siRNA 转染组,EntransterTM-CD25siRNA 转染组植片仍维持较好的透明度,其余3个指标无显著差异(图 2)。
 |
| A:各组植片生存曲线;B:各组植片平均新生血管评分;C:各组植片平均水肿评分;D:各组植片平均混浊评分;E:各组植片平均排斥反应指数评分 a: P < 0.05,与C组比较图 2 CD25siRNA基因转染于大鼠穿透性角膜移植术后植片的生存曲线及排斥评分 (n=12,x±s) |
移植术后3 d,对照组和EntransterTM-反义CD25siRNA 转染组可见炎性细胞渗入,主要分布在角膜基质层,角膜轻度水肿。随后,炎症细胞的渗入和角膜基质的水肿逐渐加重,在14 d达到峰值。如图所示,可见角膜植片明显增厚,角膜基质严重水肿,大量炎症细胞浸润,伴有大量新生血管长入,主要分布在角膜基质层,角膜胶原纤维排列紊乱。术后21 d,炎症细胞和角膜水肿逐渐减轻,但新生血管无显著变化。EntransterTM-CD25siRNA 转染组从移植术后5 d开始,可见少量炎症细胞渗入,主要分布在角膜基质层,炎症细胞渗入发展缓慢。到移植术后14 d,炎症细胞浸润加重,角膜轻微增厚,基质轻度水肿,胶原纤维排列整齐,并可见少量新生血管长入(图 3)。至移植术后21 d,EntransterTM-CD25siRNA 转染组植片组织形态明显优于对照组和EntransterTM-反义CD25siRNA 转染组。
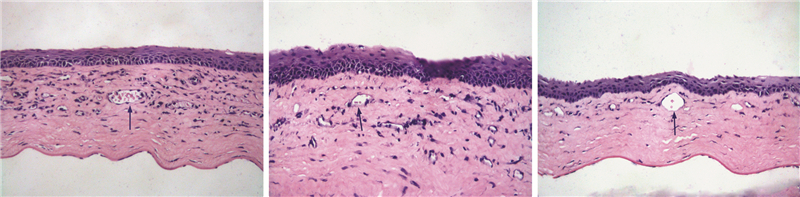 |
| A:对照组;B: EntransterTM-反义CD25siRNA 转染组;C: EntransterTM-CD25siRNA 转染组 ↑:示新生血管图 3 大鼠穿透性角膜移植术后14 d各组植片组织病理学改变 (HE ×200) |
免疫组化结果显示移植术后3、7、14、21 d各时间点,EntransterTM- CD25siRNA 转染组中CD25阳性表达量均少于其余2组。CD25的表达量在急性排斥反应期逐渐增多,在排斥反应后期减少。移植术后3 d,3组CD25阳性表达量均较少,主要分布在角膜上皮层,棕色显示(+)。术后14 d,对照组和EntransterTM-反义CD25siRNA 转染组CD25阳性表达量显著增加,棕色显示(+ + +),主要分布在角膜上皮层和基质层,角膜内皮层少量表达。而EntransterTM- CD25siRNA 转染组CD25阳性表达量明显少于其余2组,棕色显示(+),主要分布在角膜上皮层和基质层(图 4)。
 |
| A:对照组;B: EntransterTM-反义CD25siRNA 转染组 C: EntransterTM-CD25siRNA 转染组;↑:示阳性CD25表达图 4 免疫组织化学染色观察大鼠穿透性角膜移植术后14 d各组植片CD25表达及分布 (二步法 ×400) |
qPCR结果显示移植术后3、7、14、21 d各时间点,EntransterTM- CD25siRNA 转染组中CD25 mRNA阳性表达量均少于其余2组(P < 0.05)。CD25 mRNA表达趋势与免疫组化结果显示相同。3组CD25 mRNA最高表达量均出现在移植术后14 d,之后表达量降低(图 5A)。
 |
| A:相对CD25 mRNA含量;B:相对FOXP3 mRNA含量;C:相对IL-10 mRNA含量 a:P < 0.05,与C组比较图 5 qRT-PCR检测各组植片术后3、7、14、21 d CD25、FOXP3、IL-10 mRNA的表达水平 (n=3,x±s) |
在移植术后3、7、14、21 d各对应时间点,EntransterTM-CD25siRNA 转染组中FOXP3 mRNA表达量在同一时间点虽高于其余2组,但无统计学差异(P > 0.05)。在急性排斥反应期,3组FOXP3 mRNA表达量均逐渐增多,14 d达到最高表达量,之后逐渐降低(图 5B)。
移植术后3、7、14、21 d各时间点,EntransterTM- CD25siRNA 转染组中IL-10 mRNA阳性表达量均显著高于其余2组(P < 0.05)。对照组和EntransterTM-反义CD25siRNA 转染组中,IL-10 mRNA阳性表达量在术后7 d最低,14 d最高。而EntransterTM- CD25siRNA 转染组中,IL-10 mRNA阳性表达量在术后7 d最高,21 d最低(图 5C)。
2.6 植片CD25蛋白的表达Western blot结果显示移植术后3、7、14、21 d各时间点,EntransterTM- CD25siRNA 转染组(0.658 4± 0.141 6)中CD25蛋白表达量均少于对照组(1.031 5± 0.133 7)和EntransterTM- 反义CD25siRNA 转染组(1.031 3±0.132 9,P < 0.05,图 6)。在急性排斥反应期,3组植片中CD25蛋白浓度均逐渐升高,在术后14 d 达到最大,之后浓度降低。
 |
| 1:对照组;2: EntransterTM-反义CD25siRNA 转染组;3:EntransterTM-CD25siRNA 转染组图 6 Western blot检测各组植片术后14 d CD25 蛋白表达 |
角膜移植排斥反应是导致角膜移植失败的主要原因[12]。根据流行病学资料推测,我国公民因各种角膜病致盲致残者(包括单眼)约170万人,而因角膜供体来源的受限,每年全国仅能完成约5 000例角膜移植手术,大部分患者由于供体的缺乏而丧失了最佳的治疗时机[13]。因此,如何抑制角膜移植排斥反应的发生,是临床提高角膜移植手术成功率的关键。至今为止,环孢素A、西罗莫司、霉酚酸酯、FK506、FTY720等免疫抑制剂大量应用于临床预防和治疗角膜移植免疫排斥反应,均能有效的延长植片的存活时间,但同时造成药物不良反应[14]。因此,新型的治疗方式,作用于角膜移植排斥反应中的关键分子或关键通路,成为目前角膜移植排斥反应中研究的一大热点。
CD25,即IL-2R的α链,由CD4+T细胞分泌,被认为是参与角膜移植排斥反应中的关键分子[6]。Holland等[15]发现在角膜移植急性排斥反应期,IL-2R高表达于渗入的CD4 +T淋巴细胞表面。临床上将BT 563(CD25的单克隆抗体)应用于治疗肝移植患者,发现这些患者均未出现急性排斥反应。此外,CD25的单克隆抗体也应用于治疗临床肾移植患者,均取得明显抑制移植排斥反应的效果[16]。以上结果表明CD25在移植免疫排斥反应中发挥着重要作用。基因治疗是一种新型的治疗方式,通过载体转运DNA或者RNA到特定细胞,调节基因的转录、翻译,进而影响细胞的功能。该种治疗方式具有高效性,并且避免了大剂量药物带来的毒性反应[17]。研究表明,角膜的基因治疗具有高效性,原因为:①角膜具有可见性及易于接触;②离体培养的角膜组织可存活1个月,利于研究;③角膜内皮细胞再生能力有限,人角膜内皮细胞无分裂能力。因此,基因转染于角膜内皮细胞持续效应长[18]。结合以上因素,本实验采用基因治疗技术下调CD25表达,进而探讨CD25在角膜移植排斥反应中的作用,并检测IL-10和FOXP3的浓度变化。
本实验结果表明,CD25siRNA基因治疗显著下调CD25表达,尤其在移植术后14 d最明显。在急性排斥反应期,可见CD25表达逐渐增高,而在排斥反应后期,其表达降低。表明CD25中介的免疫应答主要发生在排斥反应早期。另外,角膜植片的大体观察显示,CD25siRNA基因治疗显著延长植片的生存时间,提高植片的生存率,但并未完全抑制角膜移植排斥反应的发生。可能的原因为:在CD25表达降低的情况下,IL-2R 的β链和γ链能诱导自然杀伤细胞(natural killer cells,NK cells)和静止T细胞发生免疫排斥反应[19]。在移植术后21 d,我们观察到CD25siRNA治疗组的角膜相对于空白组和反义CD25siRNA治疗组而言,仍维持较好的透明度,但角膜新生血管和角膜水肿评分在3组之间无显著差异。因此,我们认为在鉴定角膜植片是否发生排斥反应的3个指标中,即新生血管、水肿和透明度评分,角膜的透明度评分更能反映植片发生排斥反应的情况。
此外,本实验结果表明CD25siRNA基因治疗能在排斥反应早期,显著地上调IL-10 mRNA水平,进而下调主要组织相容性复合体Ⅱ(major histocompatibility complex class Ⅱ,MHC class Ⅱ)和共刺激分子的表达,从而减少有效的抗原应答。另外,本实验观察到CD25siRNA基因治疗组在角膜植片发生排斥时,仍维持较好的植片形态,表现为角膜组织结构形态清晰,胶 原纤维排列整齐,增生较少。可能的机制为上调的IL-10 通过抑制炎性分子的合成,防止植片过度的炎性损伤和组织破坏。综上表明IL-10在角膜移植免疫排斥反应中,通过多方面作用保护角膜植片,免受排斥损伤。最近的研究指出IL-10通过参与诱导Treg细胞分化,间接地诱导植片免疫耐受,对植片产生保护作用[9]。然而,先前的研究证实CD25是促使Treg细胞分化的关键分子,而FOXP3是已分化的Treg细胞的特异性标志。Hire等[20]发现在体外培养的淋巴细胞中应用CD25mAb,下调CD25表达后,对Treg细胞的分化无显著作用。相反地,在临床胰岛移植患者中,应用CD25mAb治疗后,却显著地上调了FOXP3表达。本实验发现CD25表达的下调并未降低FOXP3 mRNA水平,推测可能是由高表达的IL-10和其他细胞因子诱导了Treg细胞分化,上调了FOXP3表达,以及FOXP3 mRNA水平可能受到不同CD25浓度和不同种系的影响,其详细机制目前不详。并且,我们检测到在术后各个时间点,3组模型间FOXP3 mRNA的水平均无显著差异,但仅CD25siRNA治疗组能延长植片存活时间,进而推测CD25siRNA基因转染抑制角膜植片排斥反应的机制不在于诱导植片的免疫耐受,而是通过IL-10信号通路抑制植片的炎症反应,防止植片产生过度的炎性组织损伤,最终保护角膜植片。
因此,本实验表明在角膜移植术后,早期应用CD25siRNA基因治疗能显著延长植片的存活时间,维持植片较好的透明度,并有效降低植片发生排斥反应的程度。可能的机制主要在于CD25siRNA基因转染下调CD25表达后,低浓度的CD25上调抗炎性分子IL-10的表达,高表达的IL-10一方面抑制植片的炎症反应,一方面上调FOXP3表达,维持Treg细胞功能,最终延长植片的存活时间。这一技术为临床角膜移植患者的基因治疗提供参考,但需要更多的基础实验与临床研究来进行验证。
| [1] | Yuan X B, Yuan Y B, Jiang W, et al. Preparation of rapamycin-loaded chitosan/PLA nanoparticles for immunosuppression in corneal transplantation[J]. Int J Pharm, 2008, 349(1/2): 241-248. |
| [2] | Vail A, Gore S M, Bradley B A, et al. Conclusions of the corneal transplant follow up study. Collaborating Surgeons[J]. Br J Ophthalmol, 1997, 81(8): 631-636. |
| [3] | Williams K A, Esterman A J, Bartlett C, et al. How effective is penetrating corneal transplantation? Factors influencing long-term outcome in multivariate analysis[J]. Transplantation, 2006, 81(6): 896- 901. |
| [4] | Xiao H, Zhang H, Yu Z Y, et al. J2 prolongs the corneal allograft survival through inhibition of the CD4+ T cell-mediated response in vivo[J]. Transpl Immunol, 2007, 18(2): 130-137. |
| [5] | Jia Z, Jiao C, Zhao S, et al. Immunomodulatory effects of mesenchymal stem cells in a rat corneal allograft rejection model[J]. Exp Eye Res, 2012, 102: 44-49. |
| [6] | Cheikhelard A, Go S, Canioni D, et al. Enhanced in situ expression of NF-kappaBp65 is an early marker of intestinal graft rejection in rats[J]. J Pediatr Surg, 2005, 40(9): 1420-1427. |
| [7] | Wuest T Y, Willette-Brown J, Durum S K, et al. The influence of IL-2 family cytokines on activation and function of naturally occurring regulatory T cells[J]. J Leukoc Biol, 2008, 84(4): 973-980. |
| [8] | Lee H M, Bautista J L, Hsieh C S. Thymic and peripheral differentiation of regulatory T cells[J]. Adv Immunol, 2011, 112: 25-71. |
| [9] | Cheung K W, Sze D M, Chan W K, et al. Brazilian green propolis and its constituent, Artepillin C inhibits allogeneic activated human CD4 T cells expansion and activation[J]. J Ethnopharmacol, 2011, 138(2): 463-471. |
| [10] | Williams K A, Coster D J. Penetrating corneal transplantation in the inbred rat: a new model[J]. Invest Ophthalmol Vis Sci, 1985, 26(1): 23-30. |
| [11] | Larkin D F, Calder V L, Lightman S L. Identification and characterization of cells infiltrating the graft and aqueous humour in rat corneal allograft rejection[J]. Clin Exp Immunol, 1997, 107(2): 381-391. |
| [12] | Coster D J, Williams K A. The impact of corneal allograft rejection on the long-term outcome of corneal transplantation[J]. Am J Ophthalmol, 2005, 140(6): 1112-1122. |
| [13] | 李素霞, 谢立信. 我国眼库现状调查[J]. 中华眼科杂志, 2011, 47(9): 837-840. |
| [14] | 王丽超, 周伟. 高危角膜移植排斥反应的预防和治疗进展[J]. 国际眼科杂志, 2014, 14(8): 1413-1416. |
| [15] | Holland E J, Chan C C, Wetzig R P, et al. Clinical and immunohistologic studies of corneal rejection in the rat penetrating keratoplasty model[J]. Cornea, 1991, 10(5): 374-380. |
| [16] | Jirasiritham S, Sumethkul V, Mavichak V, et al. The role of anti-IL-2 receptor in high-risk kidney transplant patients[J]. Transplant Proc, 2004, 36(7): 2110-2112. |
| [17] | Mohan R R, Tovey J C, Sharma A, et al. Gene therapy in the cornea: 2005--present[J]. Prog Retin Eye Res, 2012, 31(1): 43-64. |
| [18] | Ritter T, Yang J, Dannowski H, et al. Effects of interleukin-12p40 gene transfer on rat corneal allograft survival[J].Transpl Immunol, 2007, 18(2): 101-107. |
| [19] | Nashan B, Schwinzer R, Schlitt H J, et al. Immunological effects of the anti-lL-2 receptor monoclonal antibody BT 563 in liver allografted patients[J]. Transpl Immunol, 1995, 3(3): 203-211. |
| [20] | Hire K, Ngo D K, Stewart-Maynard K M, et al. FoxP3+, and not CD25+, T cells increase post-transplant in islet allotransplant recipients following anti-CD25+ rATG immunotherapy[J]. Cell Immunol, 2012, 274(1/2): 83-88. |



