结肠癌是常见的消化道恶性肿瘤,严重危害人类健康,其发病率在发达的欧美国家仅次于肺癌。在我国,随着饮食习惯、生活方式及环境因素等的变化,结肠癌发病率呈明显上升趋势[1]。目前结肠癌治疗手段包括手术治疗、放射治疗、化学药物治疗、免疫治疗、基因治疗等,尽管近年来在结肠癌治疗上已取得了较大的进步,但总体疗效及预后仍然不佳[2]。结肠癌的发病原因和机制较复杂,涉及多种基因与蛋白的改变,细胞增殖与周期的异常,细胞凋亡机制受到抑制及Wnt等多条信号转导通路失调等[3]。因此,探索新型的高效低毒的靶向抗癌药物对结肠癌的药物治疗显得非常重要。
葫芦素E(cucurbitacin E,CuE)是葫芦素家族的重要成员。有研究表明,CuE能明显抑制卵巢癌、肝癌、乳腺癌等多种肿瘤细胞的增殖、迁移和诱导其凋亡,被认为是极具潜力的抗肿瘤药物[4, 5, 6, 7]。但是,目前关于CuE的抗肿瘤分子机制仍未完全阐明。众所周知[8, 9, 10, 11],细胞骨架微丝肌动蛋白(actin)与诸多细胞活动过程如增殖、凋亡、运动、分泌等密切相关,而肌动蛋白又以纤维状肌动蛋白(F-actin)与球状肌动蛋白(G-actin)动态平衡形式存在,并受丝切蛋白(cofilin)及其上游信号分子LIM激酶(LIMK)组成的LIMK/cofilin信号通路的调控。因此,本研究以培养的人结肠癌细胞株Caco-2为模型,研究CuE对结肠癌细胞增殖与迁移的影响,并从LIMK/cofilin信号通路角度探 讨其分子作用机制,为CuE治疗结肠癌提供实验依据。
1 材料与方法 1.1 主要材料人结肠癌细胞株Caco-2由中国科学院上海细胞研究所提供,DMEM培养基购自美国Gibco公司,胰蛋白酶购自BBI公司,胎牛血清购自美国Gibco公司,细胞培养箱购自美国Thermo公司,多功能读板仪购自Thermo公司,CCK-8试剂盒购自碧云天生物科技有限公司,倒置荧光显微镜为日本奥林巴斯产品,8 μm孔径的24孔板Transwell购自美国corning公司,DU800核酸蛋白分析仪购自美国贝克曼公司,488-DNaseI和594-phalloidin均购自Invitrogen公司,TCS SP5型激光共聚焦显微镜购自德国Leica公司,β-actin、cofilin、p-cofilin抗体购自美国Sigma公司,LIMK2、p-LIMK2抗体购自Abcam公司,超敏ECL化学发光试剂盒购自美国GE公司,聚偏二氟乙烯(PVDF)膜为Milipore公司产品,UD-201型组织细胞超声细胞破碎仪购自日本TOMY公司,TGL-16G台式离心机购自中国湘仪离心机公司,RC DC蛋白测定试剂盒、蛋白测定试剂盒、蛋 白电泳试剂、电泳仪、电转仪及ChemiDoc XRS型凝胶图像分析系统均购自美国Bio-Rad公司。CuE购自宝鸡市晨光生物科技有限公司,用DMSO配制成0.02 mol/L 的储存液,-20 ℃保存备用。
1.2 检测指标与方法 1.2.1 细胞培养人结肠癌细胞株Caco-2的培养 参照文献方法[12, 13],用含100 U/mL青霉素、100 μg/mL 链霉素、10%胎牛血清、2 mmol/L谷氨酰胺、1 mmol/L 非必需氨基酸、pH为7.4的DMEM培养液于5%CO2、37 ℃的饱和湿度培养箱中进行培养,每2~3天换液1次,待细胞生长到约80%汇合时,用0.25%胰蛋白酶及0.53 mmol/L EDTA液常规消化细胞,按1 ∶3比例传代培养。
1.2.2 CCK-8法检测CuE对细胞增殖的影响Caco-2细胞常规消化并计数,分别以2×104/mL的密度接种于96孔培养板,过夜使其贴壁。分为空白组、对照组和CuE处理组,每组设3个复孔。空白组加100 μL培养液,对照组加入终体积分数为0.05%DMSO溶液,CuE处理组分别加入终浓度为0.001、0.01、0.1、1、10 μmol/L的CuE溶液100 μL,分别培养24、48、72 h后。每孔加入10 μL的CCK-8溶液,继续培养箱孵育1 h,用酶标仪450 nm波长处测定光密度值D(450)。
1.2.3 划痕法检测CuE对细胞迁移的影响参照文献[14]方法稍加改进,即将Caco-2细胞接种在24孔 板中,待细胞贴壁长满后用200 μL无菌枪头进行划痕,DMEM培养液淋洗1次。分为对照组与不同剂量CuE组。分别在0、24、48 h及72 h时测量划痕距离并拍照。
1.2.4 Transwell小室跨膜检测CuE对细胞迁移的影响将Caco-2细胞常规消化,用无血清DMEM制备细胞悬液,按5×105/mL的密度接种于Transwell上室,每孔100 μL,分为对照组与CuE处理组,对照组下室加500 μL无血清DMEM,CuE处理组分别加入终浓度为0.001、0.01、0.1、1、10 μmol/L的CuE溶液500 μL(用无血清DMEM稀释),每组设3个复孔。培养箱中培养24 h后。取出Transwell小室,弃去培养液,PBS洗1遍,甲醇室温固定30 min,将小室膜风干,0.1%结晶紫室温染色20 min,用医用棉签轻轻擦去上室内的细胞,PBS洗2遍。显微镜下观察,选5个视野拍照,并计数。
1.2.5 荧光法检测CuE对细胞actin动态平衡的影响将Caco-2细胞按1×105/mL的密度接种到96孔 板,每孔100 μL。待细胞生长至约80%汇合时,用0.1 mmol/L CuE处理,并设对照组,继续培养箱孵育24、48及72 h。PBS洗1次,4%PFA固定15 min,0.1%Triton打孔15 min,2.5%BSA封闭30 min,PBS洗3次,分别用488-DNaseI(0.165 μmol/L)、594-鬼笔环肽(0.3 μmol/L)标记15 min,PBS洗3次,用多功能读板仪分别在激发光578 nm、发射光600 nm及激发光495 nm、发射光519 nm波长处测定荧光强度,依荧光强度计算F-actin、G-actin相对含量及F-actin/G-actin相对含量的比值。
1.2.6 荧光标记法检测CuE对细胞骨架F-actin的影响F-actin的荧光标记法参照文献[15],将Caco-2细胞接种于鼠尾胶原包被的无菌载玻片上,细胞生长至约80%汇合时,用0.1 μmol/L的CuE处理细胞,并设正常对照组。培养24 h后用PBS洗1次,4%PFA固定15 min,0.1%Triton打孔15 min,2.5%BSA封闭 30 min,PBS洗3次,最后用594-鬼笔环肽(0.3 μmol/L) 标记F-actin,15 min,PBS洗3次,滴加抗荧光衰减试剂,用1 ∶1甘油/PBS封片,激光共聚焦显微镜下观察并拍照。
1.2.7 Western blot检测CuE对cofilin、p-cofilin、 LIMK2及p-LIMK2蛋白表达的影响参照文献[16, 17] 方法进行,以β-actin作内参。方法简述如下:将Caco-2细胞接种于6孔板培养,待细胞长满后,分别加入新鲜培养液或不同浓度的CuE,继续培养24 h。弃 培养液并用冷PBS洗1次后,加入细胞裂解液收集细胞,超声破碎仪破碎细胞提取蛋白。经4 ℃、12 000 r/min 离心10 min,取上清液沸水煮5 min。取等量蛋白进行SDS-PAGE电泳,并转移至PVDF膜上,用5%脱脂奶粉封闭PVDF膜1 h。分别与相应一抗于4 ℃孵育过夜,用TBST漂洗15 min/次×4次后,分别与相应二抗室温孵育1 h,用TBST漂洗4次。加入化学发光液(GE公司),用ChemiDoc XRS系统采集化学发光信号,用Quantity One软件分析结果。
1.3 统计学分析数据以x±s表示,采用SPSS 17.0统计软件分析,2组间比较采用t检验,多组间数据分析采用单因素方差分析。
2 结果 2.1 CuE对Caco-2细胞增殖的影响CCK-8检测结果显示(图 1):在0.001、0.01、0.1、1、10 μmol/L 5种剂量中,0.001 μmol/L的CuE对细胞增殖抑制作用不明显(P>0.05),而0.01、0.1、1、10 μmol/L 的CuE作用24、48 h及72 h时,对细胞增殖均有显著的抑制作用(P<0.05),随着剂量与作用时间的延长,抑制作用也随之增加。CuE作用24、48 h及72 h的IC50分别是9.22、0.35与0.19 μmo/L,抑制作用总体呈现出剂量及时间依赖性。这表明CuE对Caco-2细胞增殖有明显抑制作用。
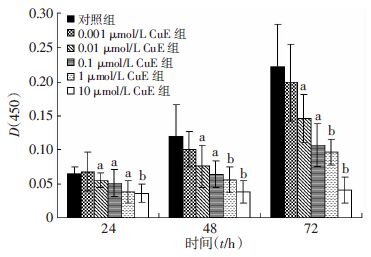
|
| a:P<0.05,b:P<0.01,与对照组比较 图 1 CuE对Caco-2细胞增殖的影响 |
0.001及0.01 μmol/L的CuE对细胞迁移的影响较小,在各时相点均与对照无显著差异(P>0.05);但0.1、1及10 μmol/L的CuE则明显抑制24、48及72 h时的细胞迁移(P<0.05),尤其当CuE剂量达到1或10 μmol/L时,细胞基本不发生迁移,两剂量的CuE处理72 h后,划痕距离分别为处理前原划痕距离的98.12%与98.01%(图 2)。
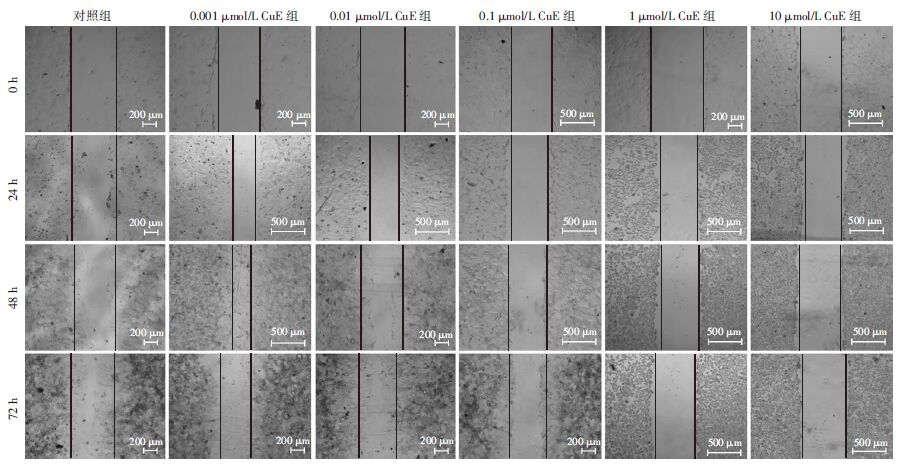
|
| 图 2 CuE对Caco-2细胞迁移能力的影响 |
结果见图 3、4,与上述划痕实验结果相一致,0.001、0.01 μmol/L的CuE组细胞跨膜数量较多,与对照组比较无统计差异(P>0.05),而0.1、1、10 μmol/L的CuE组,细胞跨膜数量逐渐减少,1、10 μmol/L 的CuE组与对照组比较有统计学差异(P<0.05)。 表明CuE对Caco-2细胞迁移有抑制作用。
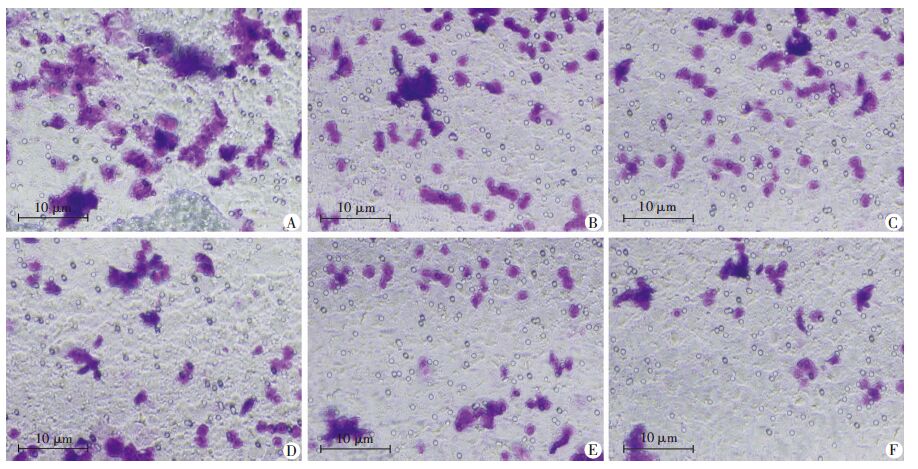
|
| A~F:分别为对照组,0.001、0.01、0.1、1、10 μmol/L CuE组0.1%结晶紫染色观察 图 3 不同剂量CuE对Caco-2细胞跨膜迁移的影响 |

|
| 1:对照组;2 ~6:分别为0.001、0.01、0.1、1、10 μmol/L CuE组 a: P<0.05,与对照组比较 图 4 Transwell实验检测细胞迁移数量变化 |
根据上述的细胞增殖及迁移结果,我们进一步选用0.1 μmol/L的CuE,观察了CuE对Caco-2细胞actin动态平衡的影响。如表 1所示,与对照组的F-actin相对含量相比较,0.1 μmol/L的CuE处理24 h后,F-actin相对含量增加,但48及72 h后又接近对照水平。而G-actin相对含量的变化与F-actin不同,与对照组的G-actin相对含量相比较,0.1 μmol/L的CuE处理24 h后,G-actin相对含量增加(P<0.05),至48、 72 h后更显著增加,接近对照水平的2倍(P<0.01)。以对照细胞actin动态平衡即F-actin/G-actin相对含量的比值为1.0计算,0.1 μmol/L的CuE处理24、48及72 h后F-actin/G-actin相对含量的比值分别为0.89、0.56及0.53,这些表明CuE能增加G-actin含量,引起F-actin与G-actin的动态平衡失调。
| (x±s) | ||||
| 时间 | F-actin | G-actin | ||
| 对照组 | 0.1 μmol/L CuE组 | 对照组 | 0.1 μmol/L CuE组 | |
| 24 h | 1.000±0.000 | 1.388±0.695 | 1.000±0.000 | 1.551±0.267a |
| 48 h | 1.000±0.000 | 1.093±0.414 | 1.000±0.000 | 1.931±0.403b |
| 72 h | 1.000±0.000 | 1.034±0.596 | 1.000±0.000 | 1.946±0.315b |
| a:P<0.05,b:P<0.01,与对照组比较 | ||||
荧光标记F-actin结果如图 5所示,0 h(即对照组)细胞骨架F-actin呈清晰可见的丝状纤维状相连分布,但0.1 μmol/L的CuE处理1、2、6、12、24h后,细胞骨架F-actin逐渐发生明显变化,分布不清晰,出现丝束断裂、棒状及溶解等现象。这表明CuE对Caco-2细胞骨架F-actin有明显的破坏作用。
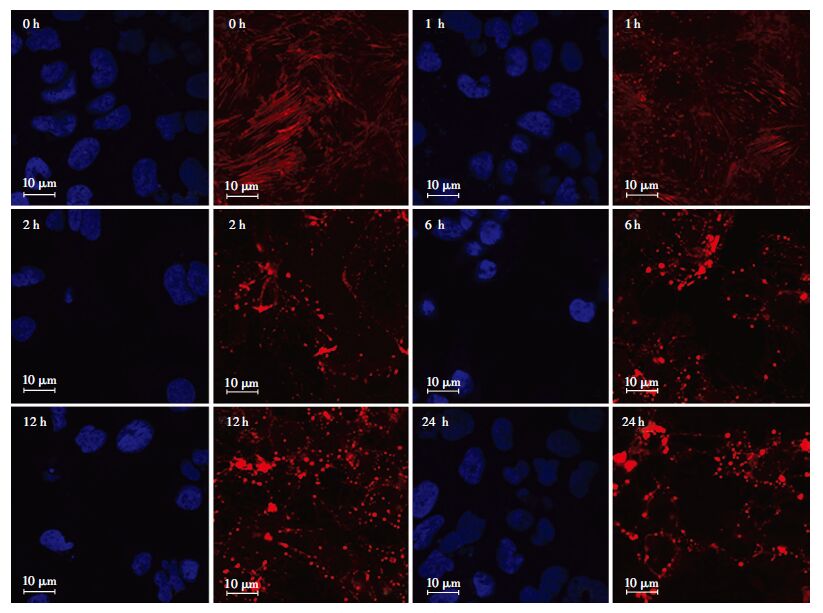
|
| 红色:F-actin,蓝色:细胞核 图 5 0.1 μmol/L CuE对Caco-2细胞骨架F-actin的影响 |
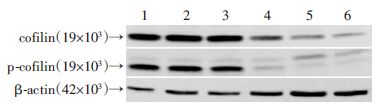
蛋白免疫印迹结果如图 6所示,0.001、0.01 μmol/L 的CuE处理Caco-2细胞24 h对cofilin及p-cofilin蛋白表达的影响较小,与对照相比较无明显差异(P>0.05);但0.1、1、10 μmol/L的CuE处理24 h后,cofilin及p-cofilin蛋白表达均明显降低,尤其是p-cofilin降低更显著(P<0.05)。
|
| 1:对照组;2 ~6:分别为0.001、0.01、0.1、1、10 μmol/L CuE组 图 6 各组cofilin、p-cofilin蛋白表达变化 |
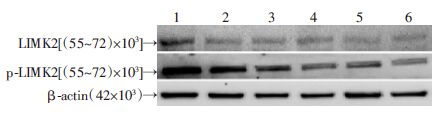
又进一步观察了CuE对cofilin上游信号分子LIMK2及磷酸化型LIMK2蛋白表达的影响,结果见图 7。与对照相比较,5种剂量的CuE处理24h对LIMK2蛋白表达均无明显影响(P>0.05),但它们对磷酸化型LIMK2蛋白表达均有不同程度的抑制作用,并与CuE剂量有关,0.001 μmol/L的CuE抑制作用最弱,而10 μmol/L的CuE抑制作用最强,其中0.1、1、10 μmol/L 的CuE处理组与对照组比较具有统计学意义(P<0.05)。
|
| 1:对照组;2 ~6:分别为0.001、0.01、0.1、1、10 μmol/L CuE组 图 7 CuE对Caco-2细胞LIMK2及P-LIMK2蛋白表达的影响 |
葫芦素系主要从葫芦科植物中提取的一类四环三萜类化合物,具有广泛的药理学作用,如抗炎、抗肿瘤、保肝等[7]。已知的葫芦素家族成员有多种,CuE是其中的重要一员。既往的研究发现,CuE能明显抑制卵巢癌、肝癌、乳腺癌等多种肿瘤细胞的增殖、迁移和诱导其凋亡,具有明显的抗肿瘤作用,被认为是极具潜力的抗肿瘤药物[4, 5, 6, 7]。但是,目前对CuE是否对结肠癌也有作用尚不清楚,这主要是相关研究资料少。为此,我们利用人结肠癌细胞株Caco-2,首先研究了CuE对体外培养的Caco-2细胞增殖及迁移的影响。结果表明,CuE对Caco-2细胞增殖及迁移均有明显的抑制作用,并呈现出剂量与时间依赖性。这与近期有关CuE抑制卵巢癌、肝癌、乳腺癌细胞增殖与迁移的结果相类似[4, 5, 6]。但CuE是否能抑制在体结肠癌的生长,目前还不清楚,我们今后将利用荷瘤实验予以证实。
目前有关CuE抑制肿瘤细胞增殖与迁移的分子机制尚不完全清楚。有研究表明[5],CuE是通过影响细胞周期而发挥抑制作用,CuE通过上调p21蛋白表达及下调细胞周期蛋白依赖性激酶CDK1的蛋白表达,干扰细胞周期的进程,使细胞周期阻滞于G2/M期,从而抑制肿瘤细胞增殖。新近的研究发现[18],CuE诱导人膀胱癌T24细胞的细胞周期阻滞于G2/M期可能与STAT3-p53-p21信号通路有关。最新的研究表明,CuE引起喉癌及鼻咽癌细胞阻滞于G2/M期与其抑制周期蛋白B1及细胞周期蛋白依赖性激酶CDC2表达有关[19];CuE也可能是通过诱导Menin蛋白表达而抑制Wnt/β-catenin信号通路而发挥作用[20]。但是,除这些分子机制外,是否还有其他机制介导CuE的作用呢?目前的研究认为[8, 9, 10],细胞骨架微丝actin在细胞的许多活动如增殖、凋亡、运动、分泌等的调控中具有重要作用,而actin又处于聚合与解聚的动态平衡,即以F-actin与G-actin动态平衡形式存在,并与肿瘤的生长及侵袭转移等密切相关。在发现CuE能明显抑制Caco-2结肠癌细胞增殖及迁移的基础上,我们又观察了CuE对Caco-2细胞骨架actin的影响。结果表明,在对Caco-2细胞增殖与迁移能力均能同时显著抑制的最低剂量(0.1 μmol/L)时,CuE处理Caco-2细胞24 h即能明显引起F-actin/G-actin的动态平衡失调,并对细胞骨架F-actin具有明显的破坏作用。这些结果提示,CuE可能是通过影响细胞骨架actin而抑制结肠癌细胞增殖与迁移。
我们又进一步探讨了CuE影响细胞骨架actin的分子机制,重点研究了CuE对在actin动态平衡调控中具有极其重要的作用的LIMK/cofilin信号通路的影响。目前已知[8, 9, 10, 21, 22],细胞骨架actin聚合与解聚的动态平衡直接受到cofilin的调控。作为一种重要的actin结合蛋白,cofilin的基本功能是解聚F-actin,抑制G-actin的聚合,调控F-actin/G-actin的转换,是细胞骨架actin解聚和重构的重要调控因子。cofilin活性主要取决于自身N末端第3位丝氨酸残基Ser3磷酸化状态,而Ser3磷酸化又主要受上游信号分子LIMK的调控,LIMK被磷酸化而激活后进一步引起cofilin的Ser3磷酸化,导致cofilin失活,从而提高F-actin的稳定性。我们的结果表明,CuE处理Caco-2细胞24h即能引起cofilin及磷酸化型cofilin蛋白表达明显降低,尤其是磷酸化型cofilin降低更显著。关于CuE引起Caco-2细胞cofilin蛋白表达降低的机制目前尚不清楚,有文献表明[23],CuE能抑制核转录因子NF-kB的活性,因此,我们推测可能与CuE影响某些转录因子的转录活性,从而抑制cofilin基因表达有关,但需进一步研究证实。此外,CuE对磷酸化型LIMK2蛋白表达也有明显的抑制作用,并呈现出剂量依赖性。与我们的结果相似,Nakashima等[24]也发现CuE通过抑制白血病U937细胞株cofilin磷酸化而引起F-actin/G-actin比值降低,其作用明显强于CuI。因此,我们认为CuE可能是通过抑制结肠癌细胞LIMK磷酸化而降低cofilin磷酸化水平。但CuE是直接还是间接调控LIMK磷酸化,目前尚不清楚,需进一步深入研究。
综上所述,CuE对结肠癌细胞Caco-2的增殖与迁移具有明显抑制作用,其分子机制可能与其抑制LIMK/cofilin信号通路,从而引起影响细胞骨架actin有关。
| [1] | Wang Y G, Chen K X, Wu G L, et al. An analysis: colon cancer mortality in Tianjn, China, from 1981 to 2000[J]. Word J Gastroenterol, 2005, 11(6): 895-898. |
| [2] | Engstrom P F. Ten years of progress in colon cancer therapy[J]. J Natl Compr Canc Netw, 2012, 10(5): 574-576. |
| [3] | Karim R, Tse G, Putti T, et al. The significance of the Wnt pathway in the pathology of human cancers[J]. Pathology, 2004, 36(2): 120-128. |
| [4] | 单晓蕾, 周雪莹, 杨姣, 等. 葫芦素E对卵巢癌细胞增殖的抑制作用及其机理研究[J]. 癌症, 2010, 29(1): 20-24. |
| [5] | 李艳春, 张鹏飞, 罗杞瑜, 等. 葫芦素E通过诱导G2/M周期阻滞抑制人肝癌细胞增殖[J]. 沈阳药科大学学报, 2010, 27(5): 388-391. |
| [6] | Zhang T, Li J, Dong Y, et al. Cucurbitacin E inhibits breast tumor metastasis by suppressing cell migration and invasion[J]. Breast Cancer Res Treat, 2012, 135(2): 445-458. |
| [7] | Chen J C, Chiu M H, Nie R L, et al. Cucurbitacins and cucurbitane glycosides: structures and biological activities[J]. Nat Prod Rep, 2005, 22(3): 386-399. |
| [8] | Yamazaki D, Kurisu S, Takenawa T. Regulation of cancer cell motility through actin reorganization[J]. Cancer Sci, 2005, 96(7): 379- 386. |
| [9] | Yoshioka K, Foletta V, Bernard O, et al. A role for LIM kinase in cancer invasion[J]. Proc Natl Acad Sci USA, 2003, 100(12): 7247-7252. |
| [10] | DesMarais V, Ghosh M, Eddy R, et al. Cofilin takes the lead[J]. J Cell Sci, 2005, 118(Pt 1): 19-26. |
| [11] | Duncan K L, Duncan M D, Alley M C, et al. Cucurbitacin E-induced disruption of the actin and vimentin cytoskeleton in prostate carcinoma cells[J]. Biochem Pharmacol, 1996, 52(10): 1553-1560. |
| [12] | 王裴, 陈传莉, 李牧, 等. 肌球蛋白轻链激酶介导的缺氧后肠上皮屏障功能紊乱的研究[J]. 中华烧伤杂志, 2009, 25(1): 57-60. |
| [13] | 刘行, 王裴, 王凤君. γ干扰素与肿瘤坏死因子α对肠上皮屏障功能影响的实验研究[J]. 中华烧伤杂志, 2011, 27(2): 145-149. |
| [14] | Liang C C, Park A Y, Guan J L. In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro[J]. Nat Protoc, 2007, 2(2): 329-333. |
| [15] | Chen C, Wang P, Su Q, et al. Myosin light chain kinase mediates intestinal barrier disruption following burn injury[J]. PLoS One, 2012, 7(4): e34946. |
| [16] | Liu H, Wang P, Cao M, et al. Protective role of oligomycin against intestinal epithelial barrier dysfunction caused by IFN-γ and TNF-α[J]. Cell Physiol Biochem, 2012, 29(5/6): 799-808. |
| [17] | Cao M, Wang P, Sun C, et al. Amelioration of IFN-γ and TNF-α-induced intestinal epithelial barrier dysfunction by berberine via suppression of MLCK-MLC phosphorylation signaling pathway[J]. PLoS One, 2013, 8(5): e61944. |
| [18] | Huang W W, Yang J S, Lin M W, et al. Cucurbitacin E induces G(2)/M phase arrest through STAT3/p53/p21 signaling and provokes apoptosis via Fas/CD95 and mitochondria-dependent pathways in human bladder cancer T24 cells[J]. Evid Based Complement Alternat Med, 2012, 2012: 952762. |
| [19] | Hung C M, Chang C C, Lin C W, et al. GADD45gamma induces G2/M arrest in human pharynx and nasopharyngeal carcinoma cells by cucurbitacin E[J]. Sci Rep, 2014, 4: 6454. |
| [20] | Feng H, Zang L, Zhao Z X, et al. Cucurbitacin-E inhibits multiple cancer cells proliferation through attenuation of Wnt/beta-catenin signaling[J]. Cancer Biother Radiopharm, 2014, 29(5): 210-214. |
| [21] | Momma K, Masuzawa Y, Nakai N, et al. Direct interaction of Cucurbitacin E isolated from Alsomitra macrocarpa to actin filament[J]. Cytotechnology, 2008, 56(1): 33-39. |
| [22] | Zhang Y, Ouyang D, Xu L, et al. Cucurbitacin B induces rapid depletion of the G-actin pool through reactive oxygen species-dependent actin aggregation in melanoma cells[J]. Acta Biochim Biophys Sin (Shanghai), 2011, 43(7): 556-567. |
| [23] | 乔静, 徐丽慧, 何健, 等. 葫芦素E对脂多糖诱导RAW264.7巨噬细胞炎症反应的影响及作用机制[J]. 现代免疫学, 2012, 32(4): 327-332. |
| [24] | Nakashima S, Matsuda H, Kurume A, et al. Cucurbitacin E as a new inhibitor of cofilin phosphorylation in human leukemia U937 cells[J]. Bioorg Med Chem Lett, 2010, 20(9): 2994-2997. |



