人脐带间充质干细胞(human umbilical cord derived mesenchymal stem cells,hUC-MSCs)因其取材方便、无免疫排斥反应、具有多向分化潜能等优势而成为再生医学研究领域的热点种子细胞[1]。如何有效地维持干细胞的“干性”和增殖活性,成为干细胞应用于临床的一个关键因素。p300既是转录辅助因子,也是一种重要的组蛋白乙酰基转移酶,可调节靶基因表达,对细胞的增殖、分化以及器官的发育形成有重要的作用。目前发现参与调节胚胎干细胞相关转录因子的表达,并参与胚胎干细胞多向分化能力的调节。microRNA(miRNA)是一种由20~23个核苷酸片段构成的短片段RNA,通过其负向调节的靶基因在干细胞的自我更新、定向分化和组织再生中,起着十分重要的作用[2]。本研究筛选并验证调节p300表达水平的microRNA,探讨其对hUC-MSCs增殖的影响。
1 材料与方法 1.1 材料hUC-MSCs来源于重庆市干细胞治疗工程技术研究中心,HEK-293T细胞株由本实验室保存,pmirGLO luciferase miRNA vector 质粒由以色列Hadassah-Hebrew University Hospital Dr Eithan Galun惠赠,Dual-Glo Luciferase Assay System、PureYieldTM Plasmid Miniprep System购自Promega公司,脂质体Lipofectamine TM 2000购自Invitrogen公司,限制性内切酶NheⅠ、XbaⅠ和DraⅠ、Taq DNA聚合酶、DNA Ligation Kit、引物购自TaKaRa公司,胎牛血清、DMEM/High Glucose、D/F12 培养基购自Gibco公司,p300单克隆抗体购自Abcam公司,Nanog蛋白单克隆抗体购自Biolegend公司,miRNA模拟物(mimics)购自上海吉玛制药技术有限公司。
1.2 方法 1.2.1 p300 3′ UTR-双荧光素酶报告基因载体的构建和鉴定根据Targetscan 6.2软件(http://www.targetscan.org/)获取人p300基因的 3′ UTR区域的序列,上下游分别插入限制性内切酶NheⅠ、XbaⅠ的识别位点,序列: 5′-GGTGCTAGCCCTCTCACAGAGTACACTAG-3′,5′-CGCTCTAGAGTCTGTCTCACACAGTTTAT-3′;以人外周血基因组DNA为模板通过PCR扩增得到P300基因的3′ UTR片段,插入质粒pmirGLO luciferase miRNA vector并转化,挑取单克隆进行菌落PCR鉴定。
1.2.2 mir mimic/pmirGLO-p300 3′ UTR共转染检测双荧光素酶取对数生长期的HEK-293T细胞按60%密度接种于96孔板中,以mir mimic/plasmid [(100 nmol/L)/100 ng]最适比例共转染细胞,根据生物信息学分析获得目标:mir 212-3p、mir 22-3p、mir 200b-3p、mir 200c-3p、mir 429、mir 182-5p、mir 26b-5p;设定mir mimics阴性对照组,序列为5′-UUCUCCGAACGUGUCACGU-TT-3′,与pmirGLO-p300 3′ UTR共转染后,分别测量萤火虫荧光素酶活性(Firefly)和作为内参的海肾荧光素酶活性(Renilla),以Firefly/Renilla的值作为荧光素酶相对活性,转染pmirGLO处理组作为空白对照,将各组荧光素酶活性值进行归一化,以相对活性比值进行组间比较。
1.2.3 mir mimic转染UC-MSCs细胞取对数生长期的hUC-MSCs按60%密度接种于6孔板中,将mimic-FAM(100 nmol/L)分别转染细胞,6~8 h镜下观察FAM荧光基团的分布,24 h收集细胞做流式细胞术检测转染率,以明确mimic转染效率;设立mir 26b-5p实验组和阴性对照组,转染后48 h收集细胞,RT-qPCR检测mir 26b-5p mimic转染后miRNA表达水平,按照天根公司miRcute miRNA提取试剂盒操作说明提取miRNA;按Gene Copoeia公司 All-in-One miRNA QRT-PCR Detection Kit操作说明进行miRNA的RT-qPCR,选择人U6基因为内参,目标miRNA 相对表达倍数用2-△△Ct公式计算。
1.2.4 Western blot检测mir 26b-5p mimic转染后目的蛋白水平变化取对数生长期的hUC-MSCs按60%密度接种于6孔板中,设立mir 26b-5p实验组和阴性对照组,空白组细胞不做处理,细胞转染48 h后收集提取总蛋白,BCA法检测蛋白浓度,取50 mg蛋白/孔上样电泳,采用冰浴湿转250 mA转膜2.5 h,然后封闭孵育1 h,分别加入一抗4 ℃孵育过夜,PBST缓冲液洗膜,再入荧光二抗(1 ∶20 000) 室温孵育1 h,Odyssey 近红外双色激光成像系统采集图像并进行分析。
1.2.5 RT-qPCR检测mir 26b-5p mimic转染后mRNA表达分组处理如1.2.4,细胞转染48 h后Trizol一步法提取细胞的总RNA,并逆转录为cDNA,进行RT-qPCR检测,上下游引物序列见表 1,选择人GAPDH基因为内参,目的基因的相对表达倍数用2-△△Ct 公式计算。
|
基因名称 |
引物序列 | 片段大
小(bp) |
|
| human Oct4 | 上游引物 | 5′-GTGGAGGAAGCTGACAACAA-3′ | 120 |
| 下游引物 | 5′-ATTCTCCAGGTTGCCTCTCA-3′ | ||
| human Sox2 | 上游引物 | 5′-TACCTCTTCCTCCCACTCC-3′ | 185 |
| 下游引物 | 5′-TGTGTGAGAGGGGCAGTGT-3′ | ||
| human Nanog | 上游引物 | 5′-CAGTCCCAAAGGCAAACAA-3′ | 163 |
| 下游引物 | 5′-CTGCTGGAGGCTGAGGTAT-3′ | ||
| human GAPDH | 上游引物 | 5′-CAACGAATTTGGCTACAGCA-3′ | 170 |
| 下游引物 | 5′-AGGGGAGATTCAGTGTGGTG-3′ |
取对数生长期的UC-MSCs 按5×103/孔接种于96孔中,每组为6个复孔,待细胞贴壁后,设立转染mir 26b-5p mimic实验组和阴性对照组,空白组细胞不 做处理,于1、2、3、4、5 d分别加入20 μL MTT(5 mg/mL),37 ℃孵育4 h后吸弃上清,加入150 μL DMSO并充分振摇,使结晶溶解后用多功能酶联免疫检测仪于492 nm 波长处测量每孔的光密度值[D(492)],并绘制生长曲线。
1.2.7 CFU-F检测mir 26b-5p mimic转染后细胞克隆形成能力分组处理如1.2.4,转染24 h后,将细胞消化,制成细胞悬液并计数,6孔板每孔铺500个细胞,每组设3复孔,10 d后结晶紫染色并扫描,计算克隆形成数。
1.3 统计学处理采用GraphPad Prism 4.0统计软件,2组间比较采用t检验,多组数据比较采用单因素方差分析。
2 结果 2.1 p300 3′ UTR-双荧光素酶报告基因载体的鉴定成功扩增到p300 3′ UTR区1 121 bp大小的PCR片段,符合预期大小,构建重组质粒pmirGLO-p300 3′ UTR,随机挑取单克隆做菌落PCR,电泳出现约1.1 kb 的阳性扩增带(图 1),测序验证与p300 3′ UTR序列相符合。
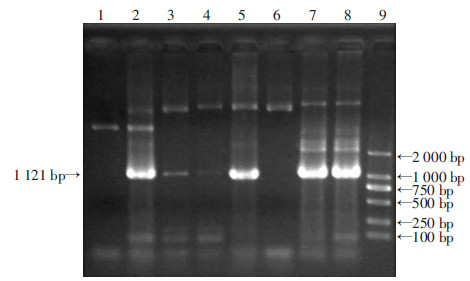 |
| 1~8:随机挑取菌落的p300 3′ UTR区PCR扩增;9:DL2000 Marker 图 1 pmirGLO p300 3′ UTR的菌落PCR鉴定 |
根据生物信息学分析获得7个目标片段:mir 212-3p、mir 22-3p、mir 200b-3p、mir 200c-3p、mir 429、mir 182-5p、mir 26b-5p(表 2)。各组mir mimic/pmirGLO-p300 3′ UTR共转染293T 细胞后,与阴性对照组比较Firefly/Renilla相对活性比值,筛选得到目标miRNA:mir 26b-5p,较阴性对照组的Firefly/Renilla相对活性降低了40.0%(P < 0.05,图 2)。
| 配对序列名称 | 预测靶标序列(上)与miRNA(下)互补配对结果 |
| 位点727~733 | 5′-UCAAAAAUAUACAGGGGCAGCUG-3′ |
| hsa mir 22-3p | 3′-UGUCAAGAAGUUGACCGUCGAA |
| 位点669~675 | 5′-GAGCGUAAAACUUCAAGUAUUAA-3′ |
| hsa mir 200b-3p | 3′-AGUAGUAAUGGUCCGUCAUAAU |
| 位点733~739 | 5′-AUAUACAGGGGCAGCUGCCAAAU-3′ |
| hsa mir 182-5p | 3′-UCACACUCAAGAUGGUAACGGUUU |
| 位点978~984 | 5′-CACACUUUCUAUAAAACUUGAAA-3′ |
| hsa mir 26b-5p | 3′-UGGAUAGGACUUAAUGAACUU |
| 位点669~675 | 5′-GAGCGUAAAACUUCAAGUAUUAA-3′ |
| hsa mir 429 | 3′-UGCCAAAAUGGUCUGUCAUAAU |
| 位点1 065~1 072 | 5′-UUGGAUCACUGUAUAGACUGUUA-3′ |
| hsa mir 212-3p | 3′-CCGGCACUGACCU-CUGACAAU |
| 位点669~675 | 5′-GAGCGUAAAACUUCAAGUAUUAA-3′ |
| hsa mir 200c-3p | 3′-AGGUAGUAAUGGGCCGUCAUAAU |
| 下划线:两两匹配的序列 | |
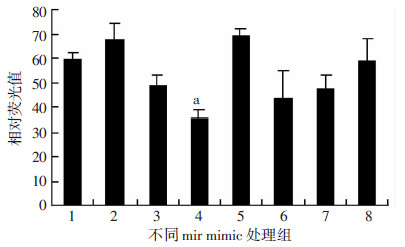 |
| 1:mir 22-3p;2:mir 200b-3p;3:mir 182-5p;4:mir 26b-5p;5:miR 429;6:mir 212-3p;7:mir 200c-3p;8:阴性对照组a:P < 0.05,与阴性对照组比较 图 2 mir mimic/pmirGLO-p300 3′ UTR共转染后Luc/Rel相对活性的比较 |
通过荧光倒置显微镜观察,转染mimic-FAM(100 nmol/L)后的UC-MSCs细胞广泛表达星点状FAM荧光基团,经流式细胞术检测转染效率高达99.37%;qRT-PCR检测结果显示:mir 26b-5p mimic组中目标miRNA表达明显上调,约为阴性对照组的25.41倍(P < 0.01)。
2.4 mimic转染后p300蛋白水平转染48 h后,空白组、阴性对照组和mir 26b-5p mimic组中p300蛋白表达的相对灰度值依次为309.27±42.46、334.58±52.64、141.41±24.57;其中mir 26b-5p mimic组较阴性对照组p300蛋白表达水平下调了42.26%(P < 0.05,图 3)。
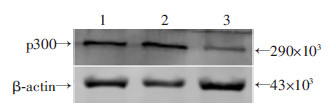 |
| 1:空白组;2:阴性对照组;3:mir 26b-5p组 图 3 mir 26b-5p mimic转染UC-MSCs后p300 蛋白表达水平 |
转染48 h后,mir 26b-5p mimic组较阴性对照组的Nanog基因表达水平降低了2.71倍(P < 0.05),而Oct4、Sox2基因mRNA表达水平没有明显变化;同时mir 26b-5p mimic组较空白组、阴性对照组细胞中Nanog蛋白表达水平显著下降(P < 0.05),空白组和阴性对照组相比无显著性差异(图 4)。
 |
| A: RT-qPCR分析 a:P < 0.05,与阴性对照组比较;B: Western blot检测 1:空白组;2:阴性对照组;3:mir 26b-5p组 图 4 mir 26b-5p mimic转染UC-MSCs Nanog mRNA和蛋白表达水平 |
与阴性对照组相比,mir 26b-5p mimic组细胞增殖能力明显下降(P < 0.05),而空白组 和阴性对照组相比差异无统计学意义(P>0.05,图 5)。
 |
| a:P < 0.05,与空白组及阴性对照组比较 图 5 mir 26b-5p mimic转染UC-MSCs后生长曲线 |
mir 26b-5p mimic组细胞克隆形成能力明显下降,空白组和阴性对照组形成克隆数分别为29.33±2.08和27.67±2.52,而mir 26b-5p mimic组为17.67±2.51(P < 0.05),空白组和阴性对照组相比无显著性差异(P>0.05,图 6)。
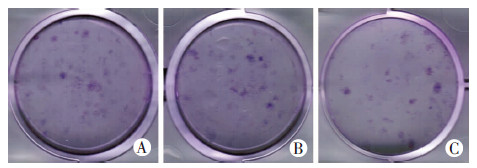 |
| A:空白组;B:阴性对照组;C:mir 26b-5p mimic组 图 6 mir 26b-5p mimic转染UC-MSCs后克隆形成能力 |
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新和多向分化潜能的成体干细胞,广泛存在于外周血、骨髓、脂肪、骨实质、脐带血、脐带、胎盘、羊膜等组织[3],其中hUC-MSCs具有易于分离培养、获取方式无伤害性、无伦理学争议、可进行自/异体移植、免疫原性低等优点,是一类理想的间充质干细胞,在临床细胞治疗方面有广阔的应用前景[4]。
转录共激活因子p300是组蛋白乙酰基转移酶(histone acetyltransferase,HATs)家族中的一员,通过表观遗传调控,“启动”或“关闭”靶基因的表达,在细胞的增殖、分化以及器官的发育形成中发挥重要作用。Zhong等[5]发现p300基因敲除的胚胎干细胞(embryonic stem cells,ESCs)在体外诱导拟胚体形成过程中,3个胚层的分化发生了异常,提示p300在维持ESCs的全能性方面有重要作用。Fang等[6]也报道p300/CBP通过乙酰化作用改变染色质结构,在维持胚胎干细胞的自我更新和多能性中发挥作用。而p300在成体干细胞中的研究鲜有报道。本研究探讨了p300在hUC-MSCs中可能的调节和作用方式。
miRNA属于内源性的非编码RNA家族,长度为19~25 nt,可以与基因mRNA的3′ UTR区结合,起到在转录后水平调控基因表达的作用。已有研究表明miRNA在组织发育、干细胞增殖分化过程中有重要作用[2, 7]。选择p300作为潜在miRNA的下游调控目标,通过生物信息学分析和双荧光素酶报告基因系统筛选 得到mir 26b-5p通过种子序列互补配对方式结合p300 3′ UTR区,明显抑制Luc/Rel相对活性,相应miRNA mimic转染UC-MSCs后显著下调p300蛋白表达。进一步实验发现mir 26b-5p高表达后明显抑制了UC-MSCs的增殖能力和克隆形成能力,提示转录共激活因子p300的高活性对维持UC-MSCs的自我更新能力有重要作用。
Nanog、Oct-4、Sox-2通过调节ESCs的基因转录,对其多潜能性和自我更新能力具有关键性的调控作用。目前发现人体多种组织来源的间充质干细胞同样表达ESCs的这些分子标志,并具有与ESCs中相类似的功能和干性维持作用[8]。MSCs随着传代扩增,其增殖分化潜能和Nanog、Oct4基因表达显著下降,并具有正相关性,而在早期代数的MSCs和低氧培养条件则能维持Nanog、Oct4基因表达的高表达和多向分化潜能[9, 10]。Greco等[11]发现Oct4在MSCs具有和ESCs中相类似的干性维持作用。本研究发现,hUC-MSCs同样表达Nanog、Oct-4、Sox-2这3个转录因子,并且mir 26b-5p高表达后Nanog的表达明显降低。提示mir 26b-5p导致的UC-MSCs增殖能力和克隆形成能力的下降,与Nanog表达下调有关。
在胚胎干细胞中,p300可被Oct-4、Nanog和Sox-2招募到染色体上相应结合位点,调节其转录活性[12]。p300可以结合在Nanog基因的转录调控区并可能通过组蛋白乙酰化修饰调控其表达。郭允倩等[13]报道p300通过homebox结构域增强Nanog转录活性,明确p300通过稳定Nanog的表达来维持ESCs的亚全能性。在胚胎干细胞体外诱导分化时,p300基因的缺失使ES细胞向内中外3个胚层的分化发生的异常,可以部分地被Nanog基因的外源过量表达修复[5]。本实验验证了mir 26b-5p靶向抑制p300表达,因此mir 26b-5p导致的细胞增殖能力的下降和Nanog表达的降低,均可能受p300表达下调的影响。
综上所述,本研究证实在UC-MSCs中mir 26b-5p可直接靶向抑制p300的表达,已有文献证实p300可参与调控Nanog基因的表达水平,提示mir 26b-5p可通过下调p300间接调控Nanog表达,进而参与调控干细胞的增殖和干性维持,为研究UC-MSCs自我更新能力的维持,增殖分化的调节提供了新的线索。
| [1] | Wang H S, Hung S C, Peng S T, et al. Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord[J]. Stem Cells, 2004, 22(7): 1330-1337. |
| [2] | Melton C, Judson R L, Blelloch R. Opposing microRNA families regulate self-renewal in mouse embryonic stem cells[J]. Nature, 2010, 463(7281): 621-626. |
| [3] | Verfaillie C. Adult stem cells: Tissue specific or not?[M]// Lanza R, Atala A. Essentials of Stem Cell Biology. 3rd ed. Oxford: Elsevier Academic Press, 2006: 23-27. |
| [4] | Choumerianou D M, Martimianaki G, Stiakaki E, et al. Comparative study of stemness characteristics of mesenchymal cells from bone marrow of children and adults[J]. Cytotherapy, 2010, 12(7): 881-887. |
| [5] | Zhong X, Jin Y. Critical roles of coactivator p300 in mouse embryonic stem cell differentiation and Nanog expression[J]. J Biol Chem, 2009, 284(14): 9168-9175. |
| [6] | Fang F, Xu Y, Chew K K, et al. Coactivators p300 and CBP maintain the identity of mouse embryonic stem cells by mediating long-range chromatin structure[J]. Stem Cells, 2014, 32(7): 1805-1816. |
| [7] | Wang Y, Medvid R, Melton C, et al. DGCR8 is essential for microRNA biogenesis and silencing of embryonic stem cell self-renewal[J]. Nat Genet, 2007, 39(3): 380-385. |
| [8] | Riekstina U, Cakstina I, Parfejevs V, et al. Embryonic stem cell marker expression pattern in human mesenchymal stem cells derived from bone marrow, adipose tissue, heart and dermis[J]. Stem Cell Rev, 2009, 5(4): 378-386. |
| [9] | Tsai C C, Su P F, Huang Y F, et al. Oct4 and Nanog directly regulate Dnmt1 to maintain self-renewal and undifferentiated state in mesenchymal stem cells[J]. Mol Cell, 2012, 47(2): 169-182. |
| [10] | Tsai C C, Chen Y J, Yew T L, et al. Hypoxia inhibits senescence and maintains mesenchymal stem cell properties through down-regulation of E2A-p21 by HIF-TWIST[J]. Blood, 2011, 117(2): 459-469. |
| [11] | Greco S J, Liu K, Rameshwar P. Functional similarities among genes regulated by OCT4 in human mesenchymal and embryonic stem cells[J]. Stem Cells, 2007, 25(12): 3143-3154. |
| [12] | Chen X, Xu H, Yuan P, et al. Integration of external signaling pathways with the core transcriptional network in embryonic stem cells[J]. Cell, 2008, 133(6): 1106-1117. |
| [13] | 郭允倩, 陈默, 马天骅, 等. p300通过homeobox结构域增强Nanog的转录激活活性[J]. 中国生物工程杂志, 2009, 29(10): 1-5. |



