树突状细胞(dentritic cells,DCs)是至今为止发现的能力最强的抗原提呈细胞,在诱导和维持机体的抗肿瘤免疫中起关键作用[1, 2]。但是越来越多的研究发现在肿瘤宿主体内,DCs正常的分化和成熟存在障碍,导致DCs不能诱导机体产生有效的抗肿瘤免疫,所以现在普遍认为DCs的功能障碍是导致肿瘤逃逸的关键原因之一[3, 4]。目前大量研究表明肿瘤细胞分泌的高水平免疫因子参与了DCs分化和成熟障碍的过程[5]。在这些免疫因子中,IL-6作为一种多功能的细胞因子,在免疫调节、造血、炎症等中发挥着广泛的生物学效应[6]。但肿瘤细胞来源的IL-6能明显抑制DCs的分化和成熟,导致DCs功能障碍[7, 8, 9]。最近研究表明,肿瘤细胞来源的IL-6能抑制人单核细胞来源树突状细胞(human monocyte-derived dendritic cells,moDCs)表面趋化因子受体7(c-c chemokine receptor type 7,CCR7)的表达,导致moDCs迁移受损[10]。CCR7是介导成熟DCs向淋巴结迁移激活T细胞启动免疫反应的关键分子[11]。在小鼠基因敲除模型中发现,CCR7-/-小鼠的树突状细胞因缺乏CCR7的表达,导致淋巴器官内DCs缺失和机体免疫缺陷[12]。而IL-6抑制moDCs CCR7表达的内在分子机制还不清楚,本研究拟对内在分子机制展开进一步研究。在IL-6 的下游信号分子中,信号转导子和转录激活子3(signal transducer and activator of transcription 3,STAT3)发挥着重要的作用,研究发现IL-6导致的STAT3过度磷酸化能使髓源性DCs分化成熟产生障碍,对其表型成熟产生明显抑制作用,导致MHC-Ⅱ类分子,共刺激分子CD40、CD80、CD86的表达明显降低[13]。虽然肿瘤细胞来源的IL-6对LPS刺激的moDCs的表型成熟没有影响,但是明显抑制moDCs CCR7的表达和树突状细胞的迁移能力[10],所以我们猜测STAT3信号通路在IL-6抑制moDCs CCR7表达的过程中也发挥了重要作用。本研究拟通过在体外建立IL-6抑制moDCs CCR7表达的模型,使用STAT3磷酸化特异性抑制剂JSI-124(cucurbitacin I)抑制STAT3的过度磷酸化后,从moDCs CCR7的mRNA水平、蛋白分子表达以及对细胞迁移功能的影响3个方面观察IL-6对moDCs CCR7表达的影响。通过研究IL-6抑制moDCs CCR7表达的内在机制,希望能找到纠正树突状细胞迁移障碍的分子靶点,达到纠正肿瘤患者免疫缺陷的目的。
1 材料与方法 1.1 主要材料与试剂人外周血单个核细胞分离液购自天津灏洋公司;重组人粒细胞-巨噬细胞集落刺激因子(recombinant human granulocyte-macrophage colony-stimulating factor,rhGM-CSF);重组人白细胞介素4(rhIL-4)、重组人白细胞介素6(rhIL-6)、趋化因子配体19(CCL19)均购自美国Peprotech公司;LPS购自Sigma公司;CD14+人单核细胞磁珠分离试剂盒购自美天旎公司;红细胞裂解液、RIPA裂解液、SDS-PAGE蛋白上样缓冲液购自碧云天公司;磷酸酶抑制剂购自Roche公司;PE标记抗人CCR7单克隆抗体以及相应的同型对照抗体均购自BD Pharmingen公司;TRIzol、PrimeScriptR RT试剂盒购自TaKaRa公司,SYBRR premix Ex Taq购自Bio-Rad公司;鼠抗人STAT3单克隆抗体以及兔抗人p-STAT3(Y705)多克隆抗体均购自R&D公司;STAT3磷酸化抑制剂JSI-124购自Sigma公司;辣根过氧化物酶偶联的山羊抗兔IgG、山羊抗鼠IgG均购自北京中杉金桥公司,ECL化学发光试剂盒购自Advansta公司;PVDF膜购自美国Bio-Rad公司;Transwell小室购自美国Corning公司;所用引物由华大基因合成。
1.2 人外周血单核细胞来源的树突状细胞的培养及IL-6抑制moDCs CCR7表达模型的建立从第三军医大学西南医院血库购得分离人单核细胞所用白膜,在无菌条件下转移至塑料离心管中,加入等体积灭菌PBS液,并充分混匀。采用梯度离心法分离出单个核细胞(human peripheral blood mononuclear cells,HPBMC),细胞数为(2~3)×108/mL,加入红细胞裂解液去除红细胞。按照CD14+人单核细胞磁珠分离试剂盒的操作程序从HPBMC中分离得到人外周血单核细胞,细胞数为(1~2)×106/mL。用含rhGM-CSF 800 U/mL、rhIL-500 U/mL、10% FBS以及青霉素与链霉素双抗的RPMI1640培养基混悬细胞,加入6孔板中,每孔(2~4)×106/2 mL,置于37 ℃、5% CO2孵箱中继续诱导培养,每隔2 d半量更换培养基,同时补充丢失的rhGM-CSF和rhIL-4。为鉴定IL-6抑制moDCs CCR7表达的最佳浓度,共使用了50、100、150 ng/mL 3个浓度。取3孔,在培养的第3天加入IL-6,使IL-6终浓度依次为50、100、150 ng/mL,在培养第6天加入LPS 100 ng/mL刺激48 h,同时设置LPS 100 ng/mL刺激的阳性对照组,正常培养的未成熟moDCs组,以及只添加IL-6(在培养的第3天加入,终浓度50 ng/mL)刺激的阴性对照组。在培养的第8天使用TRIzol提取总RNA。吸取2 μL样品RNA,使用PrimeScriptR RT试剂盒首先去除基因组DNA,然后按操作手册步骤逆转为cDNA。CCR7的检测引物为:上游5′-TGGACCTGGGGAAACCAATG-3′,下游5′-CACTGTGGTGTTGTCTCCGA-3′,扩增片段长度为116 bp;内参GAPDH的检测引物为:上游5′-TGTTGCCATCAATGACCCCTT-3′,下游5′-CTCCACGACGTACTCAGCG-3′,扩增片段长度为202 bp。PCR反应体系(10 μL):cDNA 0.5 μL,上游引物与下游引物等摩尔混合物0.5 μL,ddH2O 4 μL,SYBRR premix Ex Taq 4 μL;PCR反应条件为:95 ℃预变性2 min;95 ℃ 30 s,60 ℃ 30 s,共40个循环。每个样品做3个复孔,使用基因公司自动化RT-PCR仪进行检测和分析。
1.3 Western blot检测IL-6预处理moDCs后p-STAT3的表达水平moDCs的培养和处理同1.3步骤,在第8天使用RIPA裂解液(含100 mmol/L PMSF,磷酸酶抑制剂)提取总蛋白用于检测p-STAT3的表达水平。收集各处理组细胞,1 000 r/min,离心5 min,弃上清,加入100 μL RIPA裂解液,冰浴1 h后,超声破碎10 s,而后15 000 r/min,离心10 min,将上清转移至另一干净EP管中,加入6×SDS-PAGE蛋白上样缓冲液,100 ℃,煮8 min。每个样品取10 μL,上样电泳(90 V,2 h)。然后转移至PVDF膜(15 V,45 min)。封闭2 h后分别加入鼠抗人STAT3单克隆抗体以及兔抗人p-STAT3(Y705)多克隆抗体,抗体均1 ∶1 000稀释,4 ℃,孵育过夜。PBST漂洗3次后,分别加入辣根过氧化物酶偶 联的山羊抗鼠IgG、山羊抗兔IgG。摇床孵育1 h后,PBST漂洗3次后加上ECL发光试剂,然后人工曝光与显影。最后使用Quantity One软件对结果进行分析。
1.4 抑制STAT3高度活化后,观察IL-6对moDCs CCR7表达的影响 1.4.1 使用STAT3磷酸化特异性抑制剂JSI-124抑制STAT3的过度磷酸化取1孔细胞在第3天加入IL-6 100 ng/mL后,在第6天加入JSI-124,终浓度为0.5 μmol/L(同时设置单独IL-6处理的对照组),12 h后使用RIPA裂解液(含100 mmol/L PMSF,磷酸酶抑制剂)提取总蛋白用检于测p-STAT3、STAT3表达情况。
1.4.2 抑制STAT3过度磷酸化后,RT-PCR、流式分析、细胞迁移实验分别检测IL-6对moDCs CCR7 mRNA、分子表达以及细胞迁移能力的影响取1孔细胞在第3天加入IL-6 100 ng/mL,第6天加入的JSI-124,终浓度为0.5 μmol/L,JSI-124预处理12 h后加入LPS 100 ng/mL刺激48 h。另取1孔加入DMSO取代JSI-124作对照,其余处理方式不变。同样设置LPS 100 ng/mL刺激的阳性对照组,正常培养的未成熟moDCs组,以及只添加IL-6(培养的第3天加入,终浓度100 ng/mL)的阴性对照组。在培养第8天,使用TRIzol提取总RNA,用于检测各组moDCs CCR7 mRNA的表达情况。在培养第8天,收集各处理组细胞,分别用PE标记的抗人CCR7抗体与相应的同型对照抗体与细胞避光孵育30 min,PBS洗涤2次后,用流式细胞仪分析moDCs表面分子CCR7的表达情况。另外取一批细胞进行细胞迁移实验,实验参照文献[10, 14]报道进行,收集培养第8天的各组细胞,细胞计数后 取5×105个细胞加入Transwell小室(直径6.5 mm,孔径5 μm)上室中,下室加入含200 ng/mL CCL19的10% FBS的RPMI1640培养基。5 h后收集下室内的细胞后用流式细胞仪计数,计算各组moDCs细胞的迁移率。
1.5 统计学分析实验数据以x±s表示,使用SPSS 13.0统计软件,组间均数比较使用单因素方差分析。
2 结果 2.1 体外成功建立IL-6抑制moDCs CCR7表达模型RT-PCR结果发现单独LPS刺激未成熟moDCs 48 h 后,其CCR7 mRNA的表达明显升高,而IL-6预处理moDCs后再用LPS刺激48 h后,moDCs CCR7 mRNA的表达明显受到抑制(P<0.05)。而正常培养的未成熟moDC组,以及只添加IL-6的阴性对照组的CCR7 mRNA表达非常低。结果表明该实验成功构建了IL-6抑制moDCs CCR7表达的模型,IL-6浓度为100、150 ng/mL对moDCs CCR7 mRNA表达的抑制作用更为明显(与50 ng/mL组比较,P<0.05),但两者之间无差异(P>0.05,图 1),所以后续实验中使用IL-6的浓度是100 ng/mL。
 |
| 1:未成熟moDCs组;2:IL-6单独处理组;3:LPS刺激组;4:IL-6(50 ng/mL)+LPS刺激组;5: IL-6(100 ng/mL)+LPS刺激组;6: IL-6(150 ng/mL)+LPS刺激组; a:P<0.05,与LPS刺激组比较; b: P<0.05,与IL-6(50 ng/mL)+LPS刺激组比较 图 1 RT-PCR检测不同浓度IL-6预处理后moDCs CCR7 mRNA表达 |
Western blot检测结果发现,未成熟moDCs细胞质内存在较高水平的p-STAT3表达,而经过LPS刺激成熟的moDCs的p-STAT3水平明显降低,而用IL-6预处理后再用LPS刺激的moDCs,其细胞质内p-STAT3水平显著升高(P<0.05,图 2)。
 |
| 1:未成熟moDCs组;2:IL-6单独处理组;3:LPS刺激组;4:IL-6(50 ng/mL)+LPS刺激组;5: IL-6(100 ng/mL)+LPS刺激组;6: IL-6(150 ng/mL)+LPS刺激组;a:P<0.05,与IL-6单独处理组比较 A:Western blot检测结果;B:半定量分析结果 图 2 Western blot检测IL-6预处理后p-STAT3的表达 |
与IL-6单独 处理组比较,IL-6(100 ng/mL)+JSI-124处理组p-STAT3表达 降低(1.388±0.093 vs 0.841±0.018,P<0.05,图 3)。
 |
| 1:IL-6单独处理组;2: IL-6(100 ng/mL)+JSI-124处理组 图 3 Western blot检测IL-6预处理后加入JSI-124后moDCs p-STAT3的表达 |
IL-6+ JSI-124处理组在LPS刺激48 h后moDCs CCR7的mRNA、 蛋白表达水平以及moDCs细胞的迁移率明显高于IL-6+ LPS处理组,使IL-6对moDCsCCR7的抑制作用消失(图 4、5)。
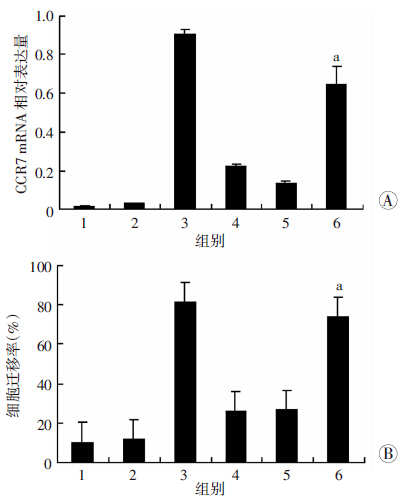 |
| 1:未成熟moDCs组;2:IL-6单独处理组;3:LPS刺激组;4:IL-6(100 ng/mL)+LPS刺激组;5: IL-6(100 ng/mL)+DMSO+LPS刺激组;6: IL-6(100 ng/mL)+JSI-124+LPS刺激组; a:P<0.05,与IL-6(100 ng/mL)+JSI-124+LPS刺激组比较 图 4 抑制STAT3过度磷酸化后IL-6对moDCs CCR7 mRNA(A)、细胞迁移能力(B)的影响 |
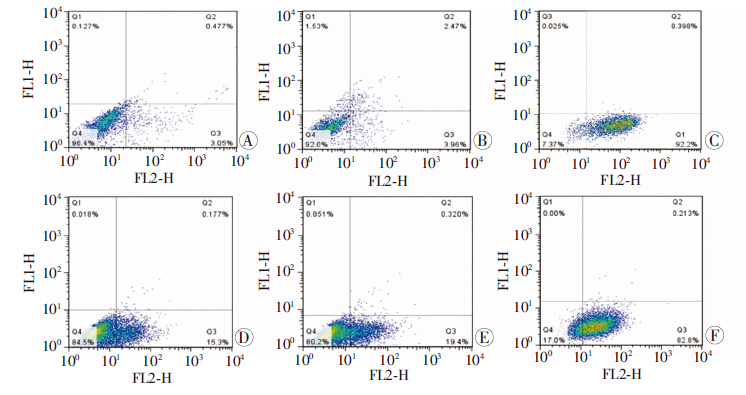 |
| A:未成熟moDCs组;B:IL-6单独处理组;C:LPS刺激组;D:IL-6(100 ng/mL)+LPS刺激组;E: IL-6(100 ng/mL)+DMSO+LPS刺激组;F: IL-6(100 ng/mL)+JSI-124+LPS刺激组 图 5 流式细胞仪检测抑制STAT3过度磷酸化后IL-6对CCR7蛋白表达的影响 |
随着对肿瘤发生、发展认识的不断深入,肿瘤与免疫之间的关系越来越受到研究者的重视,而启动特异性抗肿瘤免疫反应的树突状细胞更是研究热点。树突状细胞来源于骨髓造血祖细胞,在正常生理情况下,树突状细胞广泛分布于人体外周组织中,并处于不成熟的状态,此时的树突状细胞有很强的吞噬能力,但缺乏抗原提呈和激活T细胞的功能,而一旦遭遇了抗原或者激活信号,树突状细胞就会上调MHC-Ⅱ类分子以及一些共刺激分子CD40、CD80、CD86、CD83、DC-LAMP,以及上调表达趋化因子受体CCR7,CCR7与配体CCL19或者CCL21结合后介导树突状细胞向淋巴器官运动,进一步激活T细胞启动特异性免疫反应[11]。而在肿瘤微环境中,树突状细胞从骨髓造血祖细胞分化到最后成为树突状细胞的过程受到来自肿瘤微环境中免疫抑制因子、基质细胞、肿瘤细胞等的异常影响,从而导致树突状细胞正常功能受到损害。研究发现在很多肿瘤患者中(肝癌、肺癌、结肠癌以及乳腺癌)成熟DCs的数量明显减少,而导致肿瘤患者自身低下的肿瘤免疫功能的一个重要的原因在于成熟DCs数量的缺乏[15, 16, 17, 18],但是最近有研究发现在某些类型的肿瘤中(如卵巢癌、宫颈癌)树突状细胞高表达CD86、CD83、MHC-Ⅱ类分子[19, 20],这样就不能用成熟DCs数量的缺乏来解释这些肿瘤患者肿瘤免疫缺陷的原因。而最近有研究报道肿瘤细胞来源的IL-6能明显抑制moDCs CCR7的表达,导致成熟的moDCs的迁移能力明显受到抑制,而不影响moDCs的表型成熟[8],这就提示我们在这些肿瘤患者中树突状细胞迁移能力受损,不能淋巴器官激活机体免疫反应可能是这些肿瘤患者机体免疫力低下的原因。由于绝大多数肿瘤细胞都能分泌大剂量IL-6,有研究发现血清中IL-6水平与肿瘤病理分期与患者预后密切相关[21, 22, 23],所以进一步阐明IL-6抑制moDCs CCR7表达的内在分子机制可能能为纠正患者肿瘤免疫缺陷提供有效分子靶点。
本研究成功建立了IL-6抑制moDCs CCR7表达的体外模型,Western blot结果发现IL-6预处理的moDCs STAT3信号通路被高度活化,而在使用JSI-124抑制STAT3的高度活化后,IL-6对moDCs CCR7表达和细胞迁移能力的抑制被有效逆转,证明了STAT3信号通路在IL-6抑制moDCs CCR7表达中的重要作用,而STAT3可能成为纠正moDCs迁移障碍的分子靶点。而STAT3是分布在细胞质内的蛋白质,磷酸化后生成二聚体入核进一步发挥其生物学效应,而STAT3是如何在核内调控CCR7还不清楚,所以进一步研究STAT3入核后如何抑制CCR7表达的作用机制将是我们未来的研究重点。
| [1] | Palucka K, Banchereau J. Cancer immunotherapy via dendritic cells[J]. Nat Rev Cancer, 2012, 12(4): 265-277. |
| [2] | Lakomy D, Janikashvili N, Fraszczak J,et al. Cytotoxic dendritic cells generated from cancer patients[J]. J Immunol, 2011, 187(5): 2775-2782. |
| [3] | Tesone A J, Svoronos N, Allegrezza M J,et al. Pathological mobilization and activities of dendritic cells in tumor-bearing hosts: challenges and opportunities for immunotherapy of cancer[J]. Front Immunol, 2013, 4: 435. |
| [4] | Ma Y, Shurin G V, Peiyuan Z,et al. Dendritic cells in the cancer microenvironment[J]. J Cancer, 2013, 4(1): 36-44. |
| [5] | Bennaceur K, Chapman JA, Touraine J L,et al. Immunosuppressive networks in the tumour environment and their effect in dendritic cells[J]. Biochim Biophys Acta, 2009, 1795(1): 16-24. |
| [6] | Mihara M, Hashizume M, Yoshida H,et al. IL-6/IL-6 receptor system and its role in physiological and pathological conditions[J]. Clin Sci (Lond), 2012, 122(4): 143-159. |
| [7] | Menetrier-Caux C, Montmain G, Dieu M C,et al. Inhibition of the differentiation of dendritic cells from CD34(+) progenitors by tumor cells: role of interleukin-6 and macrophage colony-stimulating factor[J]. Blood, 1998, 92(12): 4778-4791. |
| [8] | Ratta M, Fagnoni F, Curti A,et al. Dendritic cells are functionally defective in multiple myeloma: the role of interleukin-6[J]. Blood, 2002, 100(1): 230-237. |
| [9] | Hayashi T, Hideshima T, Akiyama M,et al. Ex vivo induction of multiple myeloma-specific cytotoxic T lymphocytes[J]. Blood, 2003, 102(4): 1435-1442. |
| [10] | Pahne-Zeppenfeld J, Schroer N, Walch-Ruckheim B,et al. Cervical cancer cell-derived interleukin-6 impairs CCR7-dependent migration of MMP-9-expressing dendritic cells[J]. Int J Cancer, 2014, 134(9): 2061-2073. |
| [11] | Riol-Blanco L, Sanchez-Sanchez N, Torres A,et al. The chemokine receptor CCR7 activates in dendritic cells two signaling modules that independently regulate chemotaxis and migratory speed[J]. J Immunol, 2005, 174(7): 4070-4080. |
| [12] | Forster R, Schubel A, Breitfeld D,et al. CCR7 coordinates the primary immune response by establishing functional microenvironments in secondary lymphoid organs[J]. Cell, 1999, 99(1): 23-33. |
| [13] | Park S J, Nakagawa T, Kitamura H, Atsumi T,et al. IL-6 regulates in vivo dendritic cell differentiation through STAT3 activation[J]. J Immunol, 2004, 173(6): 3844-3854. |
| [14] | Bertho N, Adamski H, Toujas L,et al. Efficient migration of dendritic cells toward lymph node chemokines and induction of T(H)1 responses require maturation stimulus and apoptotic cell interaction[J]. Blood, 2005, 106(5): 1734-1741. |
| [15] | Ormandy L A, Farber A, Cantz T,et al. Direct ex vivo analysis of dendritic cells in patients with hepatocellular carcinoma[J]. World J Gastroenterol, 2006, 12(20): 3275-3282. |
| [16] | Perrot I, Blanchard D, Freymond N,et al. Dendritic cells infiltrating human non-small cell lung cancer are blocked at immature stage[J]. J Immunol, 2007, 178(5): 2763-2769. |
| [17] | Chaux P, Moutet M, Faivre J,et al. Inflammatory cells infiltrating human colorectal carcinomas express HLA class Ⅱ but not B7-1 and B7-2 costimulatory molecules of the T-cell activation[J]. Lab Invest, 1996, 74(5): 975-983. |
| [18] | Pinzon-Charry A, Ho C S, Maxwell T,et al. Numerical and functional defects of blood dendritic cells in early- and late-stage breast cancer[J]. Br J Cancer, 2007, 97(9): 1251-1259. |
| [19] | Hayati A R, Zulkarnaen M. An immunohistochemical study of CD1a and CD83-positive infiltrating dendritic cell density in cervical neoplasia[J]. Int J Gynecol Pathol, 2007, 26(1): 83-88. |
| [20] | Scarlett U K, Cubillos-Ruiz J R, Nesbeth Y C,et al. In situ stimulation of CD40 and Toll-like receptor 3 transforms ovarian cancer-infiltrating dendritic cells from immunosuppressive to immunostimulatory cells[J]. Cancer Res, 2009, 69(18): 7329-7337. |
| [21] | Dethlefsen C, Hojfeldt G, Hojman P. The role of intratumoral and systemic IL-6 in breast cancer[J]. Breast Cancer Res Treat, 2013, 138(3): 657-664. |
| [22] | Szczepanik A M, Scislo L, Scully T, Walewska E,et al. IL-6 serum levels predict postoperative morbidity in gastric cancer patients[J]. Gastric Cancer, 2011, 14(3): 266-273. |
| [23] | Wong H L, Rabkin C S, Shu X O,et al. Systemic cytokine levels and subsequent risk of gastric cancer in Chinese Women[J]. Cancer Sci, 2011, 102(10): 1911-1915. |



