2710032 西安,第四军医大学:西京医院眼科,全军眼科研究所
2Department of Ophthalmology,Institute of Ophthalmology,Xijing Hospital,Fourth Military Medical University,Xi’an,Shaanxi Province,710032,China
视网膜色素变性(retinitis pigmentosa,RP)是最常见的一种致盲性、遗传性视网膜退行性(retinal degeneration,rd)疾病[1]。目前已知有70多种致病基因与该病相关[2],临床尚缺乏有效治疗手段,因此一直是眼科研究领域关注的重点[3]。患有相关疾病的模式动物是开展基础研究的重要条件,目前国际上有上百种RP模式小鼠,多为基因工程和化学诱导,自发性突变的模式鼠只占很小的一部分[4]。近年来我实验室采用视觉电生理方法,发现了一种自发突变的遗传性视网膜色素变性小鼠,种属来源为昆明小鼠,因该品系为封闭群,遗传学信息比较少,因此我们将疾病相关的基因同源导入到遗传背景明确C57BL/6J近交系小鼠中,通过大量的筛选以及长期传代繁殖,培育了一种具有C57BL/6J遗传背景的近交系小鼠。本项目利用我实验室这一特有资源,对该种近交系小鼠进行发育表型的研究,为将其应用于我国医学科学在RP机制和治疗的研究提供条件和资源,具有重要的科学意义和应用前景。
1 材料与方法 1.1 实验动物本实验室发现的该种昆明小鼠来源的视网膜色素变性小鼠表型遗传稳定,目前已传至F29代,暂命名为KMrdf/rdf小鼠。为进一步明确病因,我们将KMrdf/rdf小鼠的致病基因同源导入遗传背景明确的C57BL/6J小鼠中,目前已近交至F25代,形成的近交系暂命名为B6rdf/rdf。本实验选取2、3、10月龄的B6rdf/rdf小鼠用于眼底照相和眼底荧光素血管造影,选取日龄为P14、P21的B6rdf/rdf小鼠各3只用于视网膜组织形态学观察,选取日龄为P14、P21、P56的B6rdf/rdf小鼠各6只进行视觉电生理检查。选取正常C57BL/6J小鼠作为对照。B6rdf/rdf来源于我动物实验室,正常C57BL/6J小鼠购自第四军医大学实验动物中心,予以12 h明-暗交替光照,不限食水,室温22~25 ℃条件下饲养。所有动物实验均符合眼科及视觉科学研究学会(ARVO)和第四军医大学动物饲养和使用委员会的规定。
1.2 实验仪器手持式眼底照相机(Kowa Genesis-D,日本)、Micron Ⅲ视网膜成像显微镜(Phoenix,美国)、RETI-port视觉电生理记录系统(Roland Consult,德国)、荧光倒置研究显微镜(Olympus,日本)、自动脱水机(SANTAK,中国)、石蜡组织包埋机(雅博,中国)、石蜡组织切片机(Thermo Scientific,美国)。
1.3 方法 1.3.1 KMrdf/rdf小鼠与C57BL/6J小鼠杂交方法KMrdf/rdf小鼠表现为常染色体隐性遗传且表型稳定,但为下一步基因突变位点的鉴定,我们采用互交配对方案拟将致病基因导入到遗传背景明确的近交系小鼠C57BL/6J体内。如图 1,取患病雄性小鼠(KMrdf/rdf)(来源于昆明小鼠)与正常雌性C57BL/6J+/+小鼠杂交。子代(F1)中均为rd杂合子C57BL/6J-KMrd/+,再将F1代中兄妹互交后仔鼠中应有1/4为rd阳性,基因型分别为:C57BL/6J-KM+/+、C57BL/6J-KMrd/+、C57BL/6J-KMrd/rd。
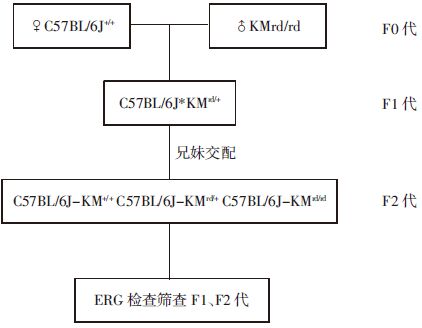
|
| 图 1 互交配对方案 |
对所有F1、F2代仔鼠编号后进行视网膜电图检测,F1代为正常表型,F2代中具有阳性表型的再与C57BL/6J+/+小鼠回交,对F3、F4进行视网膜电图检测,F4代中具有阳性表型的继续和C57BL/6J+/+小鼠回交。不断重复以上步骤,直至符合C57BL/6J小鼠遗传标志点信息,现已形成近交系并传至F25代,与KMrdf/rdf小鼠同样表现为常染色体隐性遗传,暂命名为B6rdf/rdf小鼠。
1.3.2 检测方法眼底照相:复方托吡卡胺滴眼液(沈阳兴齐眼药股份有限公司)散瞳,加90D的前置镜进行眼底照相。
荧光素血管造影:1%戊巴比妥钠(Sigma,美国)3 mL/kg 和0.05 mL速眠新Ⅱ(吉林省华牧动物保健品有限公司)腹腔内注射麻醉,复方托吡卡胺滴眼液(沈阳兴齐眼药股份有限公司)散瞳。将小鼠放置于实验台上。腹腔注射0.1 mL 2%荧光素钠(Akorn,美国),3~5 min后采用视网膜成像显微镜观察视网膜血管充盈情况。
视网膜组织形态学观察:选取P14、21的B6rdf/rdf小鼠,以正常C57BL/6J小鼠作为对照。将双眼眼球取出,4%多聚甲醛固定、常规脱水透明、石蜡包埋、切片、HE染色。
视网膜电图(electroretinogram,ERG)按照ISCEV标 准和我实验室ERG标准化方案[5],记录常规ERG五项,即暗视应0.01 cd·s/m2反应、暗视应3.0 cd·s/m2 反应、暗视应3.0 cd·s/m2 OPs反应、明视应3.0 cd·s/m2 反应和明视应3.0 cd·s/m2 Flicker反应。实验前将小鼠暗适应12 h,1%戊巴比妥钠(Sigma,美国)3 mL/kg 和0.05 mL速眠新Ⅱ(吉林省华牧动物保健品有限公司)腹腔内注射麻醉,复方托吡卡胺滴眼液(沈阳兴齐眼药股份有限公司)散瞳,将小鼠固定于实验台上,记录电极置于角膜,参考电极刺入颊部皮下,接地电极置于尾部皮下。
2 结果 2.1 不同月龄B6rdf/rdf小鼠眼底改变相比正常C57BL/6J小鼠眼底,2月龄时B6rdf/rdf小鼠视网膜血管萎缩变细,眼底呈斑块状脱色素改变,3月龄时色素进一步脱失,至10月龄时视网膜血管严重退化,眼底色素已基本缺失(图 2)。
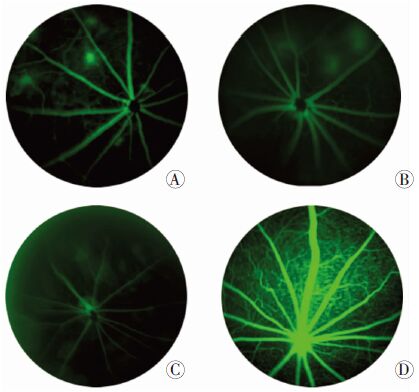
|
| A:2月龄;B:3月龄;C:10月龄;D:C57BL/6J 2月龄 图 2 不同月龄B6rdf/rdf小鼠眼底发育情况比较 |
荧光素血管造影显示正常C57BL/6J小鼠血管充盈良好,而2月龄时B6rdf/rdf小鼠视网膜血管萎缩变细,由于色素脱失导致斑块状脉络膜背景显现。3月龄时血管进一步萎缩变细,至10月龄时视网膜血管严重退化,色素脱失(图 3)。

|
| A:2月龄;B:3月龄;C:10月龄;D:C57BL/6J 2月龄 图 3 不同月龄B6rdf/rdf小鼠眼底荧光素血管造影观察 |
与正常C57BL/6J小鼠比较,P14时外核层细胞层细胞数明显减少;P21时,外核层、外网状层已基本消失(图 4)。
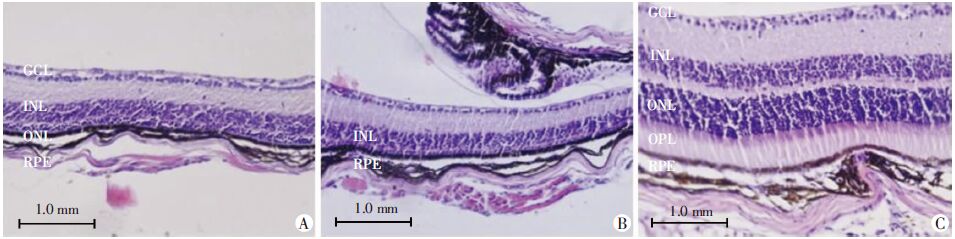
|
| A:P14;B:P21;C:C57BL/6J;GCL:神经节细胞层,INL:内核层,ONL:外核层,OPL:外网状层,RPE:色素上皮层 图 4 不同日龄B6rdf/rdf小鼠视网膜组织形态学变化 |
B6rdf/rdf小鼠从P14起,记录不到明显的ERG波形。而正常C57BL/6J小鼠在P14时,已有ERG的波形出现且接近成年水平,P21时ERG波形已发育成熟达成年水平(图 5)。
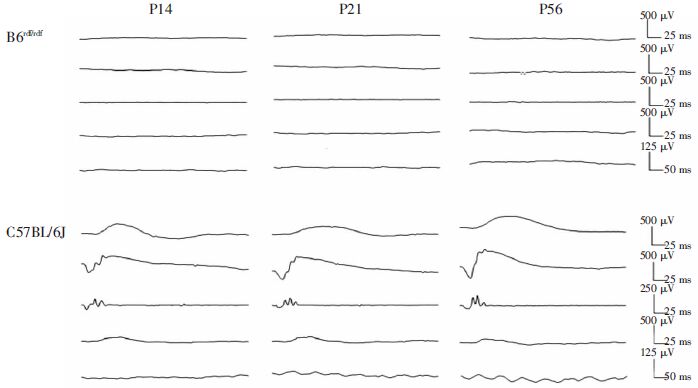
|
| 从上至下依次为暗视应0.01 cd·s/m2反应、暗视应3.0 cd·s/m2反应、暗视应3.0 cd·s/m2 OPs反应、明视应3.0 cd·s/m2反应和明视应3.0 cd·s/m2 Flicker反应 图 5 不同日龄B6rdf/rdf小鼠视网膜功能发育观察 |
本研究对我实验室自行发现并培育的一种近交系疾病小鼠进行了表型的发育学研究。眼底照相和荧光素血管造影显示2~10月龄期间视网膜血管进行性退化、眼底色素逐渐脱失,组织形态学研究显示P14视网膜外核层细胞数已经显著减少,P21外核层细胞、外网状层已基本消失,ERG检查自P14开始已经观察不到明显波形。这些结果显示B6rdf/rdf小鼠眼部表型呈早发性、快速进行性改变。我们在前期的研究中对KMrdf/rdf小鼠的发育表型已经做了充分的研究,本实验中的B6rdf/rdf小鼠与之类似[6],提示致病基因在C57BL/6J小鼠和昆明小鼠两种不同遗传背景条件下表现出十分相似的眼部表型,与Jackson实验室报道的rd1小鼠相似[7]。至今,Jackson实验室筛查出rd1不同背景家系小鼠有99种[8],而我国尚少有报道。
在基因鉴定方面,前期我们对KMrdf/rdf小鼠进行了突变基因的筛查和测序。发现KMrdf/rdf与rd1小鼠不仅表型类似,同时两者突变基因均为pde6b基因,第一内含子均存在病毒序列的插入,但不同的是KM-1rdf/rdf小鼠第7外显子并未出现如rd1小鼠一样的无义突变[9]。mRNA检测发现KMrdf/rdf小鼠pde6b基因在750 bp 处出现分子量增大的未知条带,而rd1仅表现为pde6b基因的不表达。由于KM-1rdf/rdf小鼠来源于昆明小鼠属于封闭群,国际上并没有其完整的遗传谱系,而rd1来源于C57BL/6J等近交系,因此我们也并不能肯定KMrdf/rdf发生的基因突变位点与rd1完全相同。且KM-1rdf/rdf小鼠视网膜中cGMP含量的变化,与rd1并不完全相符[10]。另外,一直认为视网膜色素变性会影响视网膜新生血管的形成,这在rd1小鼠的氧诱导视网膜新生血管实验中得到部分证实,即rd1小鼠视网膜在氧诱导条件下没有明显的新生血管生成[11],但我们发现在氧诱导条件下KM-1rdf/rdf小鼠视网膜新生血管生长情况与野生型小鼠没有明显区别[12]。为此,我实验室通过同源导入的方法将KMrdf/rdf小鼠的致病基因导入C57BL/6J小鼠中,筛选并培育出具有C57BL/6J遗传背景的B6rdf/rdf小鼠,以便在相同遗传背景下鉴别致病基因位点是否相同。本实验基于B6rdf/rdf小鼠对其形态和功能的发育表型进行了研究,在下一步实验中,我们拟对B6rdf/rdf小鼠的pde6b基因进行鉴定,确定突变位点,并且研究同一基因在不同遗传背景下的表达更有助于理解基因的交叉作用,为基因干涉治疗提供潜在的靶向位点,如Crb1rd8基因在C3H/HeJ遗传背景有临床表型而在C57BL/6J中无任何表现[13]。
RP为高度遗传异质性疾病,目前已知至少76个基因突变与其有关,已经有69个致病基因被鉴定,7个基因未被鉴定[5]。遗传方式可为常染色体隐性遗传(50%~60%)、常染色体显性遗传(30%~40%)或X-连锁伴性遗传(5%~15%),也可同时存在两种或以上基因的改变,临床表现可只存在眼部症状也可以伴发眼外症状以综合征的方式出现,如伴有耳聋的Usher综合征(约占rp病例的17%)[14, 15]。由于RP致病基因以及临床表现的多样性、复杂性,相应的疾病动物模型是开展发病机制、基因功能和疾病治疗研究的重要资源。
建立遗传性疾病动物模型是后基因组时代的重要课题,也是开展临床研究的必要条件。疾病动物模型可以通过人工诱导建立遗传性疾病动物模型,也可以在正常动物种群中对自发性疾病动物进行筛选。而在自然界中筛选所需要的疾病动物模型则需要建立一个敏感的筛选方法和合理的筛选策略,并需要在一定基数的筛选工作量后才有可能得到所希望的疾病动物,所筛选到的动物同时还需保持稳定的遗传性状。而对于自发性疾病动物模型的筛选工作,运气和机遇意识比工作量本身更重要,因此自发性疾病动物的发现往往是可遇而不可求的。
眼科专业丰富的检查技术手段对于开展临床工作十分有利,但往往不适用于小动物实验,有的甚至无法采用。筛选自发性疾病动物,比较简单的方法就是肉眼观察,容易发现表现明显异常的突变动物,如毛色改变、角膜混浊、白内障等。对于那些对毛色、生长、发育、繁殖没有受到明显影响,不经过特殊检查而不能发现的疾病动物的识别尤为困难。因而,常用动物视觉功能检查,包括视觉行为学、视觉电生理学技术方法等。由于各实验室的研究目的不同,所采用的筛选策略也有所区别。我实验室长期在视觉电生理领域进行工作,有丰富的经验和完善的实验条件,并在科研过程中,采用视觉电生理方法,发现了多种自发性遗传性视网膜疾病动物,并逐步建立了近交系。基于我实验室发现的疾病模式动物和前期研究结果,进一步完善B6rdf/rdf小鼠和KMrdf/rdf小鼠信息,也为我国科学工作者对RP疾病的发病机制和治疗手段的研究提供有利资源,具有非常重要的科学意义。
| [1] | Hartong D T, Berson E L, Dryja T P. Retinitis pigmentosa[J]. Lancet, 2006, 368(9549): 1795-1809. |
| [2] | |
| [3] | Daiger S P, Sullivan L S, Bowne S J. Genes and mutations causing retinitis pigmentosa[J]. Clin Genet, 2013, 84(2): 132-141. |
| [4] | |
| [5] | 张作明, 顾永昊, 郭群, 等. 小鼠与大鼠视网膜电图和闪光视觉诱发电位记录标准化方案建议[J]. 眼科新进展, 2004, 24(2): 81-83. |
| [6] | 龙潭. 快速视网膜变性小鼠视网膜发育的初步研究[D]. 西安: 第四军医大学, 2005. |
| [7] | Chang B, Hawes N L, Pardue M T, et al. Two mouse retinal degenerations caused by missense mutations in the beta-subunit of rod cGMP phosphodiesterase gene[J]. Vision Res, 2007, 47(5): 624-633. |
| [8] | Chang B, Hurd R, Wang J, et al. Survey of common eye diseases in laboratory mouse strains[J]. Invest Ophthalmol Vis Sci, 2013, 54(7): 4974-4981. |
| [9] | Andrieu-Soler C, Halhal M, Boatright J H, et al. Single-stranded oligonucleotide-mediated in vivo gene repair in the rd1 retina[J]. Mol Vis, 2007, 13: 692-706. |
| [10] | 闫果林.一种视网膜色素变性小鼠致病基因的鉴定[D]. 西安: 第四军医大学, 2008. |
| [11] | Lahdenranta J, Pasqualini R, Schlingemann R O, et al. An anti-angiogenic state in mice and humans with retinal photoreceptor degeneration[J]. Proc Natl Acad Sci U S A, 2001, 98(18): 10368-10373. |
| [12] | Zhang Q, Zhang Z M. Oxygen-induced retinopathy in mice with retinal photoreceptor cell degeneration[J]. Life Sci, 2014, 102(1): 28-35. |
| [13] | Mehalow A K, Kameya S, Smith R S, et al. CRB1 is essential for external limiting membrane integrity and photoreceptor morphogenesis in the mammalian retina[J]. Hum Mol Genet, 2003, 12(17): 2179-2189. |
| [14] | Samardzija M, Neuhauss S, Joly S, et al. Animal Models for Retinal Degeneration[M]// Pang I H, Clark A F. Animal Models for Retinal Diseases: Neuromethods, 46, 2010: 51-79. |
| [15] | Anasagasti A, Irigoyen C, Barandika O, et al. Current mutation discovery approaches in Retinitis Pigmentosa[J]. Vision Res, 2012, 75: 117-129. |



