2.400037 重庆,第三军医大学新桥医院:胸外科 全军呼吸内科研究所,全军呼吸病研究重点实验室
2.Department of Thoracic Surgery;
Institute of Respiratory Diseases, Key Laboratory of Respiratory Diseases, Xinqiao Hospital, Third Military Medical University, Chongqing, 40037, China
肺癌是发病率和死亡率都极高的恶性肿瘤,肺癌中约85%是非小细胞肺癌。非小细胞肺癌包括肺腺癌和肺鳞癌等,其中以肺腺癌患者占大多数。关于肺癌的遗传易感性,已有大量报道,一项多中心的全基因组关联研究(GWAS)发现位于13q31.3位点的磷脂酰肌醇蛋白聚糖5 ( glypican-5,GPC5)基因可能与肺腺癌的发生密切相关[1]。GPC5属于磷脂酰肌醇蛋白聚糖类(heparan sulphate proteoglycans,HSPGs),HSPGs通过糖基-磷脂酰肌醇锚定在细胞膜表面,在细胞生长及分化中发挥重要作用[2]。目前研究发现GPC5参与淋巴瘤、横纹肌肉瘤及结肠癌的发生、发展,同时与炎性脱髓鞘疾病、肾病综合征相关[3, 4, 5, 6, 7]。而对于GPC5基因在肺癌中是否为抑癌基因或者癌基因目前研究尚存在争议[8, 9, 10],因此有必要对GPC5基因在肺癌中的作用进行探索验证。本研究通过同时构建过表达及干扰载体使肺腺癌细胞系中GPC5过表达及沉默,探究其对肺腺癌细胞生长和细胞周期及细胞凋亡的影响,为GPC5基因在肺癌中的作用及其分子机制的研究奠定基础。
1 材料与方法 1.1 细胞培养及主要检测试剂盒人肺腺癌细胞系H1299、A549、H1975、H358及人正常肺上皮细胞系HBE均购自中科院上海细胞生物学研究所细胞库。总RNA提取试剂盒RNAiso plus购自TaKaRa公司,逆转录试剂盒GoScriptTMReverse Transcription System 购自Promega公司,PCR引物由Invitrogen公司合成,转染试剂包括Invitrogen的脂质体2000及Promega的ViaFectTM试剂,CCK-8购自DOJINDO,碘化丙啶(PI)试剂购自碧云天,APC、PI双染细胞凋亡检测试剂盒购自BD生物,其他试剂均为进口超纯级或国产分析纯以上级产品。
1.2 逆转录PCR、实时定量PCR和Western blot检测 1.2.1 RNA提取运用RNAiso plus试剂盒抽提生长状态良好的肺癌细胞系总RNA,采用分光光度仪定量及检测纯度,并取2 μL总RNA进行琼脂糖凝胶电泳,检查RNA是否降解。
1.2.2 逆转录PCRGPC5特异性引物设计根据GenBank中GPC5的mRNA序列采用Primer Premier 5.0进行引物设计,最终确定引物序列为上游:5′-TACAGGCTCACCTCAATGGACAAA-3′,下游:5′-TGTTGGCAAGCGTCTCTTCA-3′,逆转录扩增产物大小为146 bp,根据GPC5逆转录扩增产物大小选择内参基因POLR2A,其引物序列为上游:5′-GCAGAGAAGCTGGTGCTCCGTA-3′,下游:5′-CAGCATGTTGGACTCGATGCAG-3′,逆转录扩增产物大小为 126 bp。引物合成由Invitrogen公司完成。
采用逆转录试剂盒将提取的细胞中总RNA合成cDNA,再分别取1 μL cDNA进行PCR扩增,反应体系参照说明书,反应条件为 95 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 15 min。同时,PCR 扩增看家基因POLR2A作为检验反转录是否成功的标准。反应结束后,取5 μL产物进行1.5%琼脂糖凝胶电泳,确认PCR产物,同时通过不同组之间的电泳条带的光密度差异进行GPC5基因相对表达量的初步分析。
1.2.3 实时定量PCR反应qRT-PCR的cDNA合成同RT-PCR第一步,获得cDNA后取1 μL cDNA作为模板。采用荧光定量试剂盒SYBR Premix Ex TaqTM进行实时定量PCR反应,以POLR2A作为内参,反应体系参照说明书,反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,39个循环。每个待测基因设3个复孔,反应结束后,观察扩增曲线及熔解曲线,记录反应管中的荧光信号到达所设定的阈值时所经历的循环数 即Ct值,根据Ct值计算目的基因的相对表达量:△Ct=Ct目的基因-CtPOLR2A,△△Ct =△Ct实验组 -△Ct对照组。实验组目的基因mRNA的表达量即为对照组的2-△△Ct倍。
1.2.4 Western blot采用碧云天Radio Immunoprecipitation Assay(RIPA)蛋白裂解液提取各细胞总蛋白,并采用Bicinchoninic acid (BCA )法测定蛋白浓度。取40 μg总蛋白进行10%SDS-PAGE凝胶电泳,转膜,5%脱脂奶粉溶液封闭1 h,分别加入GPC5多克隆抗体(1 ∶500稀释)、内参GAPDH(1 ∶2 000稀释),4 ℃ 孵育过夜,洗膜3次,加入辣根过氧化物酶标记的二抗室温孵育1 h,洗膜3次后使用凝胶成像分析系统扫描结果。
1.3 GPC5基因表达载体和miRNA干扰载体构建及鉴定 1.3.1 GPC5基因表达载体的构建和鉴定在NCBI 数据库中(http://www.ncbi.nlm.nih.gov)中查找并下载GPC5基因mRNA的序列,对需要合成的cDNA区域序列进行分析,检查基因内部有无特别复杂的二级结构和重复序列连接。根据基因序列分析的结果,分别进行寡核苷酸(oligo DNA)的设计及合成,利用PCR将合成的oligo拼接成完整的GPC5基因序列,并将合成好的序列TA克隆入pMD-18T载体,测序验证。最后将目的基因克隆装入载体pIRES2-EGFP,测序验证,构建GPC5基因表达载体。
1.3.2 miRNA表达载体的构建与鉴定通过BLOCK-iTTM RNAi Express数据库(http://rnaidesigner.lifetechnologies.com /rnaiexpress /rnaiExpress.jsp)提交GPC5基因信息选择4个干扰位点(干扰位点序列均经过Blast检验靶基因的特异性),针对每一个干扰位点设计并合成两段寡核苷酸(oligo DNA)退火形成表达miRNA的双链DNA,然后连接装载于线性质粒pcDNA6.2-GW/EmGFP-miR。转化至感受态大肠杆菌,挑选阳性克隆,摇菌抽提质粒后进行测序验证。4对 oligo DNA序列信息见表 1。
| oligo名称 | oligo DNA序列5′-3′ |
| 干扰序列-1 | 上游:TGCTGTTCAGGAGGGCTCTGCTGCACGTTTTGGCCACTGACTGACGTGCAGCAGCCCTCCTGAA |
| 下游:CCTGTTCAGGAGGGCTGCTGCACGTCAGTCAGTGGCCAAAACGTGCAGCAGAGCCCTCCTGAAC | |
| 干扰序列-2 | 上游:TGCTGTTCATTAGCACAAAGCTGATCGTTTTGGCCACTGACTGACGATCAGCTGTGCTAATGAA |
| 下游:CCTGTTCATTAGCACAGCTGATCGTCAGTCAGTGGCCAAAACGATCAGCTTTGTGCTAATGAAC | |
| 干扰序列-3 | 上游:TGCTGTAGAGCTGGACGTTTGAAGAAGTTTTGGCCACTGACTGACTTCTTCAAGTCCAGCTCTA |
| 下游:CCTGTAGAGCTGGACTTGAAGAAGTCAGTCAGTGGCCAAAACTTCTTCAAACGTCCAGCTCTAC | |
| 干扰序列-4 | 上游:TGCTGACCAAATGGACTCACATCCCGGTTTTGGCCACTGACTGACCGGGATGTGTCCATTTGGT |
| 下游:CCTGACCAAATGGACACATCCCGGTCAGTCAGTGGCCAAAACCGGGATGTGAGTCCATTTGGTC | |
| 阴性对照 | 上游:tgctgAAATGTACTGCGCGTGGAGACGTTTTGGCCACTGACTGACGTCTCCACGCAGTACATTT |
| 下游:cctgAAATGTACTGCGTGGAGACGTCAGTCAGTGGCCAAAACGTCTCCACGCGCAGTACATTTc |
载体构建正确后,表达载体及干扰载体的转染根据Lipofectamine® 2000/ViaFectTM转染试剂说明书进行,转染的效率通过倒置荧光显微镜进行观察,转染的效果通过RT-PCR、qRT-PCR及Western blot进行验证。
1.4 CCK-8法检测细胞增殖细胞均以2×104/孔细胞接种到96孔板,每组设置6个重复,24 h后转染。转染后继续培养,分别在第1、2、3、4、5天加入10 μL CCK-8试剂染色,37 ℃孵育2 h,在酶联免疫检测仪下测定450 nm波长处的光密度值D[450]。实验重复3次。
1.5 细胞周期检测细胞均以2×105/孔接种于6孔板中,24 h后转染。转染后72 h胰酶消化收集细胞,预冷的PBS清洗2次,加入预冷的75%的乙醇4 ℃固定超过12 h。离心收集固定后细胞,预冷的PBS 清洗,加RnaseA(终浓度100 μg/mL),37 ℃水浴消化30 min。加碘化丙啶(PI)至终浓度50 μg/mL,冰浴避光染色30 min。24 h内进行流式细胞术检测,488 nm 激发光激发检测。实验重复3次。
1.6 细胞凋亡检测细胞均以2×105/孔接种于6孔板中,24 h后转染。转染后72 h胰酶消化收集细胞,PBS 重悬计数。取5~10 万重悬的细胞,1 000×g离心5 min,弃上清,加入100 μL的 Binding Buffer 悬浮细胞,再加入2 μL Annexin V-APC染液及2 μL PI染液,混匀,室温、避光、反应 5~15 min,1 h内进行流式细胞术检测。实验重复3次。
1.7 统计学处理采用SPSS 13.0统计分析软件,计量资料以x ±s表示,两组间差异比较采用t检验,多组间差异比较采用单因素方差分析。
2 结果 2.1 肺腺癌细胞系中GPC5基因mRNA及蛋白的表达RT-PCR检测4株肺癌细胞系A549、H1299、H358、H1975及人正常肺上皮细胞系HBE细胞中GPC5基因mRNA的表达,结果表明GPC5基因的mRNA 在H1299、H358细胞中相对高表达,而在A549、H1975中相对低表达(图 1A)。同时以正常肺上皮细胞系HBE作对照,对4株肺癌细胞系进行GPC5基因mRNA表达量qRT-PCR分析,GPC5基因mRNA在H1299、H358细胞系中表达水平明显升高(P<0.05),2-△△Ct值分别为20.1、16.9;在H1975细胞系中表达水平略高,2-△△Ct值为1.58,与HBE细胞相比差异无统计学意义(P>0.05);而在A549细胞株中表达水平明显降低,2-△△Ct值为0.29,差异具有统计学意义(P<0.05)。在蛋白表达水平,Western blot的结果与mRNA水平的结果一致(图 1B)。
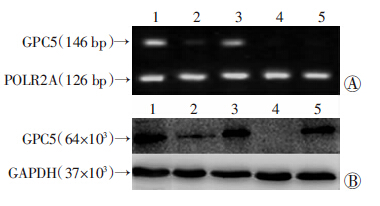 |
|
1:H358;2:H1975;3:H1299;4:A549;5:HBE A:RT-PCR检测GPC5基因mRNA的表达;B: Western blot检测GPC5蛋白的表达 图 1 4株肺腺癌细胞系及正常肺上皮细胞系HBE细胞中GPC5基因mRNA及蛋白表达 |
成功构建GPC5过表达载体GPC5-pIRES2-EGFP及干扰载体系列pcDNA6.2-GW/EmGFP-miR-GPC5-1/2/3/4载体。根据前期GPC5基因mRNA表达量检测结果,对GPC5低表达肺腺癌A549细胞进行GPC5-pIRES2-EGFP载体转染,对GPC5高表达肺腺癌H1299细胞进行pcDNA6.2-GW/EmGFP-miR-GPC5-1/2/3/4载体转染,对转染前后细胞系中GPC5基因mRNA 表达量进行RT-PCR分析(图 2A),qRT-PCR结果表明,A549细胞转染GPC5-pIRES2-EGFP载体后GPC5基因mRNA表达量较空载体组明显增高,2-△△Ct值为12 000(P<0.05),GPC5过表达细胞系构建成功。对于pcDNA6.2-GW/EmGFP-miR-GPC5-1/2/3/4载体系列,pcDNA6.2-GW/EmGFP-miR-GPC5-3干扰效果最高(图 2B、C),与空载体组相比GPC5表达量降低到30%,差异具有统计学意义(P<0.05),后续实验均以pcDNA6.2-GW/EmGFP-miR-GPC5-3载体进行GPC5干扰试验,GPC5低表达细胞系构建成功。此外,在蛋白水平对过表达载体和干扰载体的效果进行验证(图 2D),与mRNA水平结果一致。
 |
| A:RT-PCR分别检测A549细胞过表达GPC5基因前后GPC5基因mRNA的表达 1:pIRES2/NC;2:pIRES2/GPC5;B、C:RT-PCR及qRT-PCR分别检测H1299细胞GPC5基因干扰前后GPC5基因mRNA的表达 1:pcDNA6.2-miR-GPC5-1;2:pcDNA6.2-miR-GPC5-2;3:pcDNA6.2-miR-GPC5-3;4:pcDNA6.2-miR-GPC5-4;5:pcDNA6.2-miR-GPC5-NC;a:P<0.05,与空载体组比较;D:Western blot检测表达载体及沉默载体转染效果 1:pIRES2/NC; 2:pIRES2/GPC5;3:pcDNA6.2-miR-GPC5-NC;4:pcDNA6.2-miR-GPC5-3 图 2 GPC5基因过表达/干扰载体转染效果验证 |
采用CCK-8法对转染细胞系进行生长曲线分析,结果表明,过表达GPC5在转染后1、2、3、4、5 d时相点均抑制A549细胞的生长(与转染空载体的对照组相比,各时相点分析均为P<0.05);沉默GPC5基因,在各时相点均促进H1299细胞生长(与空载体组相比较,除第5天之外,其余各时相点均有统计学意义,P<0.05)。转染后第3、4天抑制或促进效果最佳(图 3)。
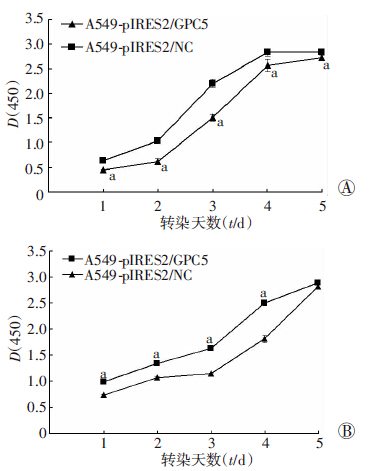 |
| A:GPC5基因过表达抑制A549细胞生长 a:P<0.05,与空载体组比较;B:GPC5基因沉默对促进H1299细胞生长 a:P<0.05,与空载体组比较 图 3 CCK-8检测GPC5基因过表达/沉默对肺癌细胞系生长的影响 |
采用流式细胞术对转染细胞进行周期检测分析,结果表明,转染后72 h,过表达GPC5基因使A549细胞G1期比率增高,S期比率降低、G2期比率降低,与空载体组相比,G1期增高及S期降低具有统计学差异(P<0.05,表 2);GPC5基因沉默可使H1299细胞G1期比率降低、G2期比率降低,而S期比率增高,与空载体组相比,G1期、S期变化具有统计学差异(P<0.05,表 2)。
| 组别 | G1期(%) | S期(%) | G2期(%) |
| A549-pIRES2/GPC5 | 80.05±0.45a | 7.79±0.29a | 13.64±0.89 |
| A549-pIRES2/NC | 66.62±1.50 | 15.32±0.76 | 18.56±0.33 |
| H1299-pcDNA6.2-miR-GPC5-3 | 63.50±4.66a | 23.29±3.88a | 12.18±3.96 |
| H1299-pcDNA6.2-miR-GPC5-NC | 74.76±0.53 | 11.29±1.34 | 13.82±1.21 |
| a:P<0.05,与空载体组比较 | |||
采用APC/PI双染法对转染前后细胞凋亡情况进行流式分析。实验结果表明,GPC5过表达细胞总凋亡率由10.03%降到8.99%,但差异不具有统计学意义(P>0.05),同样在沉默细胞系H1299中也未观察到细胞凋亡差异(表 3)。
| 组别 | 早期凋亡率 (%) | 晚期凋亡率 (%) | 总凋亡率 (%) |
| A549-pIRES2/GPC5 | 7.66±0.56 | 1.34±0.52 | 8.99±1.07 |
| A549-pIRES2/NC | 8.71±0.79 | 1.32±0.24 | 10.03±0.71 |
| H1299-pcDNA6.2-miR-GPC5-3 | 5.71±1.56 | 0.64±0.14 | 6.35±1.56 |
| H1299-pcDNA6.2-miR-GPC5-NC | 6.16±0.63 | 0.67±0.09 | 6.84±0.66 |
GPC5是磷脂酰肌醇蛋白聚糖(glypican)基因家族成员之一,磷脂酰肌醇蛋白聚糖属于硫酸类肝素蛋白多糖类(heparan sulphate proteoglycans,HSPGs),目前在哺乳类基因组中共发现GPC1到GPC6的6个磷脂酰肌醇蛋白聚糖成员,其中GPC3与GPC5具有较高同源性[11]。HSPGs广泛分布于哺乳动物组织内,与生长因子、趋化因子和细胞外基质结构蛋白等相互作用,在细胞的生长、分化和反应中起重要作用[12]。研究表明GPC5参与了淋巴瘤、横纹肌肉瘤及结肠癌的发生、发展,同时与多发性硬化、肾病综合征相关,且在不同的疾病中可能发挥不同的作用。一项多中心合作的全基因组关联研究(GWAS)发现,GPC5基因可能与非吸烟肺腺癌的发生密切相关,使GPC5与肺癌关系的研究成为一个热点。
目前关于GPC5基因在肺癌中的作用研究仍存在争议。Li等[8]通过对GPC5基因在肺腺癌细胞系中迁移能力的研究并结合临床数据分析提出GPC5高表达促进肺癌细胞的迁移、增加预后的风险。而Yang等[9]通过对GPC5基因在肺腺癌及肺鳞癌细胞系中细胞生长、周期、迁移的研究及更大样本的临床数据分析提出GPC5低表达促进细胞的迁移、增加预后的风险。本研究通过探索验证更支持Yang等[9]的结果。
本研究通过RT-PCR、qRT-PCR以及Western blot对不同细胞系GPC5基因表达情况进行筛选,发现GPC5基因在A549细胞中相对低表达,而在H1299、H358细胞中相对高表达。我们选择了A549细胞系进行GPC5基因过表达处理,通过CCK-8实验证实GPC5过表达能够抑制细胞的生长,这一结果与Yang等[9]的研究结果一致,但Yang等[9]的研究未证明GPC5沉默能够促进细胞生长,分析其原因可能为GPC5沉默细胞系A549、H1975细胞系中GPC5表达量相对较低,而本研究通过对GPC5基因高表达的H1299细胞系进行miRNA干扰研究,结果发现GPC5基因沉默能够促进细胞生长,与Yang等[9]对A549、H1975进行GPC5基因过表达后再进行GPC5沉默的结果一致。另一方面,Yang等[9]的干扰研究采用 siRNA 系统,本研究选 用miRNA干扰载体系统,这种RNAi 其本质与shRNA一致,区别在于shRNA靶点序列两端延伸了一段pri-miRNA序列的侧翼序列,当miRNA 载体进入细胞后,可以模拟体内miRNA的成熟过程,不容易被细胞识别为“非我”,同时又具有shRNA的特异性,因此可能产生更好的干扰效果[13, 14]。
为了进一步探索GPC5基因对肺癌细胞系增殖作用,我们利用流式细胞术对转染前后肺癌细胞系进行细胞周期分析。结果表明GPC5过表达肺癌细胞系A549的G1期增高,S期降低;GPC5沉默细胞系H1299的G1期降低,S期增高,细胞周期的结果分析与细胞增殖CCK-8结果分析一致。通过GPC5过表达细胞系及GPC5沉默细胞系的细胞周期实验结果共同验证了GPC5可以通过影响细胞周期进而影响细胞增殖能力。在磷脂酰肌醇蛋白聚糖(glypican)基因家族中,GPC5基因与GPC3基因具有较强的同源性,Valsechi等[15]研究发现过表达GPC3基因能够引起肾癌细胞G1期增高,S期降低,说明磷脂酰肌醇蛋白聚糖(glypican)基因家族可以通过影响细胞周期进而影响细胞增殖能力。
为了进一步探讨GPC5基因对肺癌细胞系功能的影响,本研究探讨了GPC5基因对细胞凋亡的影响。结果发现GPC5过表达及沉默细胞系细胞凋亡均未产生影响,说明GPC5可能不通过凋亡通路影响细胞的生长增殖。Valsechi等[15]研究表明GPC3在肾癌中为抑癌基因,上调或者下调GPC3基因对肾癌细胞凋亡没有影响。而另一项研究表明GPC3基因在肝癌中为癌基因,下调GPC3基因能够通过抑制Wnt通路上调CASPASE-3表达水平,从而促进肝癌细胞凋亡[16]。由此可见,磷脂酰肌醇蛋白聚糖(glypican)基因家族对不同肿瘤细胞中凋亡影响可能不一样,GPC5基因主要通过对细胞生长及增殖的影响进而对肺癌细胞产生影响,而GPC5基因对肺癌细胞凋亡的影响需要进一步的研究证明。
从目前研究结果来看,GPC5基因在肺腺癌中可能为抑癌基因,进一步针对GPC5基因在肺腺癌细胞侵袭能力、体内致瘤性方面的影响可补充验证文章结果。另一方面关于GPC5基因抑癌作用的产生机制及与其他通路的相互作用关系还十分复杂,有待于进一步深入研究。全面深入地研究GPC5基因可为肺癌的诊断、治疗提供新的策略和靶点。
| [1] | Li Y, Sheu C C, Ye Y, et al. Genetic variants and risk of lung cancer in never smokers: a genome-wide association study[J]. Lancet Oncol, 2010, 11(4): 321-330. |
| [2] | Saunders S, Paine-Saunders S, Lander A D. Expression of the cell surface proteoglycan glypican-5 is developmentally regulated in kidney, limb, and brain[J]. Dev Biol, 1997, 190(1): 78-93. |
| [3] | Okamoto K, Tokunaga K, Doi K, et al. Common variation in GPC5 is associated with acquired nephrotic syndrome[J]. Nat Genet, 2011, 43(5): 459-463. |
| [4] | Kim J C, Kim S Y, Cho D H, et al. Genome-wide identification of chemosensitive single nucleotide polymorphism markers in colorectal cancers[J].Cancer Sci, 2010, 101(4): 1007-1013. |
| [5] | Williamson D, Selfe J, Gordon T, et al. Role for amplification and expression of glypican-5 in rhabdomyosarcoma[J]. Cancer Res, 2007, 67(1): 57-65. |
| [6] | Schraders M, Pfundt R, Straatman H M, et al. Novel chromosomal imbalances in mantle cell lymphoma detected by genome-wide array-based comparative genomic hybridization[J]. Blood, 2005, 105(4): 1686-1693. |
| [7] | Shin J G, Kim H J, Park B L, et al. Putative association of GPC5 polymorphism with the risk of inflammatory demyelinating diseases[J]. J Neurol Sci, 2013, 335(1/2): 82-88. |
| [8] | Li Y, Miao L, Cai H, et al. The overexpression of glypican-5 promotes cancer cell migration and is associated with shorter overall survival in non-small cell lung cancer[J]. Oncol Lett, 2013, 6(6): 1565-1572. |
| [9] | Yang X, Zhang Z, Qiu M, et al. Glypican-5 is a novel metastasis suppressor gene in non-small cell lung cancer[J]. Cancer Lett, 2013, 341(2): 265-273. |
| [10] | 饶文, 余祖滨, 向颖, 等. GPC5基因在肺腺癌组织中差异表达和突变分析[J]. 第三军医大学学报, 2014, 36(11): 1153-1157. |
| [11] | De-Cat B, David G. Developmental roles of the glypicans[J]. Semin Cell Dev Biol, 2001, 12(2): 117-125. |
| [12] | Filmus J, Capurro M, Rast J. Glypicans[J]. Genome Biol, 2008, 9(5): 224. |
| [13] | Ambros V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350-355. |
| [14] | Zeringue H C, Constantine-Paton M. Post-transcriptional gene silencing in neurons[J]. Curr Opin Neurobiol, 2004, 14(5): 654-659. |
| [15] | Valsechi M C, Oliveira A B, Conceicao A L, et al. GPC3 reduces cell proliferation in renal carcinoma cell lines[J]. BMC Cancer, 2014, 14: 631. |
| [16] | 郑大勇, 阮健, 刘斐烨, 等. RNA干扰GPC3基因表达影响肝癌细胞Huh-7凋亡的机制研究[J]. 热带医学杂志, 2011, 11(5): 516-519. |



