2 510507广州,广州军区疾病预防控制中心
乳腺癌(breast cancer)对于女性人群而言是一种最为普遍和致命性的恶性肿瘤,全球每年罹患乳腺癌的女性大约有130万人,因乳腺癌死亡的约有46.5万人[1],死亡率高居所有类型恶性肿瘤的第2位[2]。MDA-MB-231细胞系属雌激素,孕激素,生长因子受体均阴性的三阴性乳腺癌,具有很高的恶性程度[3]。
自噬(autophagy)是一种真核细胞内包裹损伤的细胞器,异常功能的蛋白体和侵入性病原体等,并运送至溶酶体内进行降解的过程[4]。普遍认为,自噬是一种细胞保护反应机制,但是也有人认为存在自噬性的死亡[5]。近年来,随着对自噬功能及其调控机制的深入研究,越来越多的证据显示,自噬对肿瘤的发生、发展,以及肿瘤化疗放疗发挥有重要的影响。然而,在肿瘤治疗过程中,自噬仍然是一把双刃剑[6]。一方面,对于正常组织细胞而言,长期的自噬缺乏或缺陷会导致肿瘤的发生;另一方面,对肿瘤组织而言,自噬是其耐受传统化疗放疗手段,维持其在缺血缺氧等应激环境中活性的重要因素[7]。尽管如此,自噬抑制剂在肿瘤化疗中的地位在逐渐显现,包括FDA批准的氯喹(chloroquine,CQ)及羟基氯喹(hydroxychloroquine,HCQ)已经进入临床研究并且取得了显著地联合化疗效果[8]。因此,从天然植物中研究和开发新型自噬抑制剂,深入研究抗乳腺癌作用的分子机制和可能的作用靶点,具有极其重要的临床意义。
莲心碱(liensinine)是一种来源于睡莲莲属植物(Nelumbo Nucifera Gaertn)成熟种子胚芽的双苄基异喹啉类生物碱,具有抗心律失常及高血压的药理作用[9]。其同源性结构化合物甲基莲心碱(neferine),在抗白血病,逆转肿瘤细胞多药耐药性等方面有大量报道,但莲心碱在抗肿瘤中的作用及其分子机制还少见报道[10]。通过前期研究,我们观察到莲心碱对乳腺癌细胞MDA-MB-231自噬作用有显著影响。本研究旨在论证莲心碱对乳腺癌细胞MDA-MB-231自噬功能的调控作用。 1 材料与方法 1.1 实验材料
MDA-MB-231细胞采购于ATCC;DMEM培养基、胰蛋白酶和胎牛血清均购于美国Invitrogen公司;EGFP-LC3,tfLC3质粒来源于Addgene;质粒提取试剂盒Endo-free Plasmid Mini Kit采购自OMEGA公司;Lipofectamine 3000转染试剂盒购于Invitrogen公司;SQSTM1/p62抗体购于Cell Signaling公司,Anti-Beclin1与Anti-LC3B抗体采购于Sigma公司,β-actin抗体采购于Santa Cruz公司,Goat anti-Rabbit IgG采购于KPL公司;莲心碱对照品采购于成都曼斯特生物科技有限公司,Bafilomycin A1采购于Cayman公司,DMSO采购于Sigma公司。 1.2 方法 1.2.1 细胞培养MDA-MB-231 细胞用DMEM完全培养基(10%胎牛血清)于37℃、5% CO2、饱和湿度培养箱培养,隔日传代。 1.2.2 透射电镜检查MDA-MB-231 细胞经莲心碱20 μmol/L或溶媒DMSO处理24 h后,Trypsin-EDTA消化下细胞,冰PBS洗涤2次,用4℃预冷的2.5%戊二醛固定细胞过夜,2%锇酸后固定,系列乙醇-丙酮脱水,环氧树脂包埋,制作切片后用电子显微镜(Hitachi-7500)80 kV下观察。 1.2.3 质粒提取、转染及激光共聚焦显微镜观察
携带质粒的大肠杆菌在加入相应抗性抗生素(kanamycin or ampicillin)的液体LB培养基中过夜培养,按照Endo- free Plasmid Mini Kit试剂盒说明书进行提取纯化质粒,-20 ℃长期保存待转染。MDA-MB-231细胞1×104个/孔铺于预置有细胞爬片(Nest)的24孔板(Corning)内,贴壁24 h后按Lipofectamine 3000说明书进行转染,转染24 h后更换新鲜完全DMEM培养基并加入莲心碱20 μmol/L,Bafilomycin A1 25 nmol/L或溶媒DMSO处理24 h后PBS洗涤,固定后,在激光共聚焦显微镜(Zeiss)下观察自噬空泡情况。 1.2.4 Western blot检测
MDA-MB-231细胞处理后,提取总蛋白并测定蛋白浓度(碧云天BCA蛋白浓度测定试剂盒增强型),行12% SDS-PAGE电泳,电转3 h至PVDF膜,5% 脱脂奶粉封闭30 min,SQSTM1/p62,Anti-Beclin1,Anti-LC3B抗体均1 ∶1 000稀释后4℃摇床上孵育过夜,TBST洗涤一抗后,Goat anti-Rabbit IgG二抗1 ∶20 000室温下孵育2 h,洗涤后显影并分析结果。 1.3 数据分析
Western blot结果采用Quality One软件分析,共聚焦图像采用Image J处理并统计计数,数据以x±s表示,采用SPSS 19.0统计软件处理。结果采用Student’s t检验。 2 结果 2.1 莲心碱对乳腺癌细胞超微的影响
透射电镜结果显示,DMSO处理组细胞内结构清晰(图 1A),细胞核内常染色质较多,异染色质少,有多个大核仁,形态不规则。细胞内无退变的细胞器,细胞基质密度均匀。细胞表面微绒毛细长且密集。莲心碱处理组(图 1B)细胞核与对照组没有显著差异,细胞质内出现较多含有内容物的双层膜空泡结构,内质网略微肿胀,线粒体出现较多断裂,有部分损伤的线粒体被双层膜包裹,但未见高密度的嗜锇性空泡。
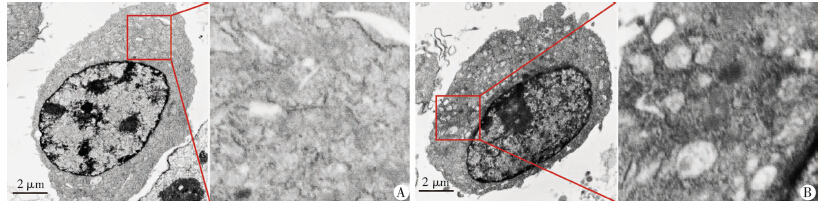 |
| A:对照组; B:莲心碱组图 1 透射电镜观察MDA-MB-231细胞超微结构变化 |
DMSO处理组(图 2A)EGFP-LC3呈现全细胞弥散状,光亮强度均匀,部分细胞呈现少量的绿色荧光团。莲心碱处理组(图 2B)出现明显的绿色荧光光团,数量较多,主要分布于细胞核周围。对照组(4.00±2.31)与莲心碱处理组(32.70±6.32)的绿色荧光光团数量有显著统计学差异(P<0.01)。
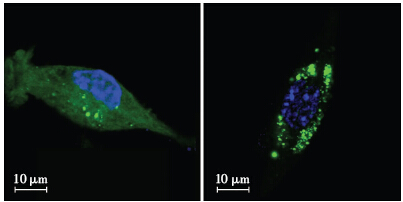 |
| A:对照组;B:莲心碱组图 2 激光共聚焦显微镜观察莲心碱处理后EGFP-LC3荧光团 |
LC3B是自噬空泡膜的结构蛋白,在自噬空泡膜延伸过程中由LC3B-Ⅰ转变为LC3B-Ⅱ;Beclin1在自噬发生过程中常表现为高表达,是自噬发生的关键蛋白之一;SQSTM1/p62作为自噬反应的底物蛋白,可以反映自噬流的情况,是观察自噬情况的重要指标。通过Western blot检测显示,经由莲心碱处理后,MDA-MB-231细胞中SQSTM1/p62和LC3B-Ⅱ蛋白表达显著增加,呈明显的量效和时效关系(图 3A、C),但Beclin1的表达未见显著性变化(图 3B、D)。
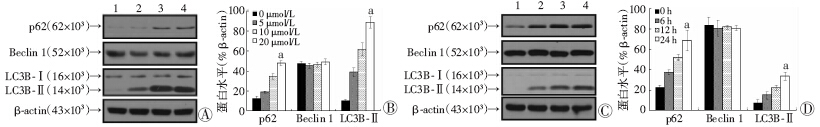 |
| A:不同浓度的Western blot 检测结果 1:对照组;2: 5 μmol/L组;3:10 μmol/L组;4: 20 μmol/L组;B:半定量分析结果 a:P<0.01,与对照组比较; C: 不同作用时间的Western blot 检测结果 1:对照组;2:6 h组;3:12 h组;4:24 h组;D:半定量分析结果 a:P<0.01,与对照组比较图 3 Western blot 检测莲心碱对自噬相关蛋白的影响 |
绿色荧光蛋白(GFP)是一种对偏酸性环境敏感的荧光蛋白,尤其是在pH<5的晚期内涵体或溶酶体中,GFP会迅速淬灭,红色荧光蛋白(RFP)则耐受低pH环境。因此,当自噬空泡体与溶酶体或晚期内涵体融合之后,mRFP-EGFP-LC3上的绿色荧光会迅速淬灭,只剩下红色荧光。当对细胞处理之后,出现红色荧光团的增多,说明自噬空泡与溶酶体等融合正常。当出现显著增多的黄色荧光光团时说明自噬空泡与溶酶体等融合受到了干扰,或者形成了pH被扰乱的自噬溶酶体结构,自噬过程被阻断在降解阶段。通过激光共聚焦显示(图 4),对照组可见少部分的红色荧光团,莲心碱处理组呈现较多的黄色荧光光团,阳性对照药物Bafilomycin A1是溶酶体膜上H+-ATPase阻断剂,可有效升高溶酶体腔内pH,扰乱自噬空泡与溶酶体的融合。Bafilomycin A1处理后出现与莲心碱相似的大量黄色荧光团。进一步用Western blot检测经Bafilomycin A1预处理1 h后,莲心碱对MDA-MB-231细胞中LC3B和SQSTM1/p62表达的影响。由图 5A所示,BafilomycinA1预处理后,并没有改变莲心碱处理后的LC3B-Ⅱ和SQSTM1/p62水平(图 5B),说明了莲心碱与Bafilomycin A1对MDA-MB-231细胞作用效果的一致性。
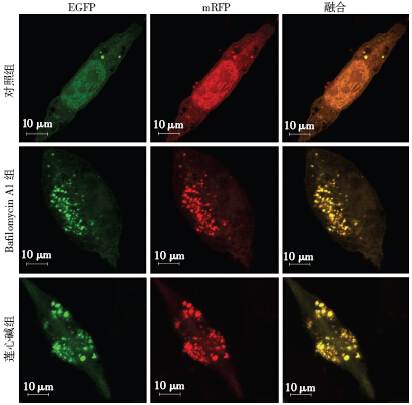 |
| 图 4 激光共聚焦显微镜观察tfLC3 质粒转染后自噬流变化 |
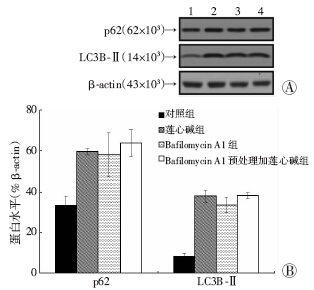 |
| A:Western blot检测结果 1:对照组;2:莲心碱组;3:Bafilomycin A1组;4:Bafilomycin A1预处理+莲心碱组;B:半定量分析结果图 5 Western blot检测经BafilomycinA1预处理后莲心碱对乳腺癌细胞MDA-MB-231细胞中LC3B-Ⅱ和p62表达的影响 |
乳腺癌是我国女性发病率和死亡率较高的恶性肿瘤。文献[11, 12]报道显示,乳腺癌化疗可以从多个方面入手影响乳腺癌的发展、侵袭和转移能力。自噬是细胞内维持稳态的过程[13]。通常认为,自噬与肿瘤的发展侵袭有相关,并且与肿瘤细胞的化疗耐受有关。自噬抑制剂与传统化疗药物协同作用的化疗策略在临床试验上已证实了其显著效果,但现阶段批准上市的自噬抑制剂只有氯喹(chloroquine,CQ)及羟基氯喹(hydroxychloroquine,HCQ)。新型自噬抑制剂的开发具有广阔的研究前景。现阶段开发的自噬抑制剂可以作用于自噬的各个靶点,包括抑制自噬起始阶段:3-methyladenine(3-MA),Wortmannin,LY294002等;抑制自噬空泡转运过程:紫杉醇(paclitaxel),长春新碱(vincristine)等;干扰溶酶体功能及降解能力:Bafilomycin A1,Chloroquine,Hydroxychloroquine,pepstatin A,monensin等[14]。文献[15]报道,作用于降解阶段的自噬抑制剂与化疗药物协同作用比作用于起始阶段的显著。因此,开发作用于自噬降解的抑制剂,并寻找其特 异性的作用靶点,对自噬抑制剂的临床应用有重要意义。
莲心碱作为一种中药(莲心)中生物碱成分,其主 要药理作用为抗心律失常及高血压,本研究通过电子显微镜、Western blot、激光共聚焦显微镜等技术研究表明莲心碱对乳腺癌细胞MDA-MB-231,具有扰乱自噬空泡与溶酶体的融合,干扰乳腺癌细胞自噬降解的作用,与文献[16]的研究有互补作用。本研究显示莲心碱干扰乳腺癌细胞MDA-MB-231自噬降解,抑制自噬小体的成熟。其作用机制与Bafilomycin A1相似,但作用于自噬小体成熟阶段的靶点众多,文献[17]报道,扰乱溶酶体腔内pH,扰乱微观蛋白功能,抑制溶酶体内水解酶活性,干扰自噬小体与溶酶体融合的关键蛋白复合物如HOPS,SNARE等都可能影响自噬小体的成熟。莲心碱作为一种酚性类生物碱,药理活性广泛,由于本身具有弱碱性特性,考虑其自噬抑制机制可能来源于升高了溶酶体腔内的pH或者影响了关键融合机制的蛋白活性。本研究主要是对莲心碱的自噬抑制效果做了初步探讨,莲心碱作为具有食物和中药源性的天然产物,其有效活性结构对于新型自噬抑制剂的开发研究具有重要指导意义。尽管如此,对于莲心碱抑制自噬降解的作用是否具有普遍性,以及其具体作用机制,我们还需要进一步深入研究。
| [1] | Kuger S, Corek E, Polat B, et al. Novel PI3K and mTOR inhibitor NVP-BEZ235 radiosensitizes breast cancer cell lines under normoxic and hypoxic conditions[J]. Breast Cancer (Auckl), 2014, 8: 39-49. |
| [2] | Gomes L R, Terra L F, Wailemann R A, et al. TGF-beta1 modulates the homeostasis between MMPs and MMP inhibitors through p38 MAPK and ERK1/2 in highly invasive breast cancer cells[J]. BMC Cancer, 2012, 12: 26. |
| [3] | Sohn J, Liu S, Parinyanitikul N, et al. cMET activation and EGFR-Directed therapy resistance in Triple-Negative breast cancer[J].J Cancer, 2014, 5(9): 745-753. |
| [4] | Mehrpour M, Esclatine A, Beau I, et al. Overview of macroautophagy regulation in mammalian cells[J]. Cell Res, 2010, 20(7): 748-762. |
| [5] | Liu E Y, Ryan K M. Autophagy and cancer-issues we need to digest[J].J Cell Sci, 2012, 125(Pt 10): 2349-2358. |
| [6] | Kimura T, Takabatake Y, Takahashi A, et al. Chloroquine in cancer therapy: a double-edged sword of autophagy[J]. Cancer Res, 2013, 73(1): 3-7. |
| [7] | Kimmelman A C. The dynamic nature of autophagy in cancer[J]. Genes Dev, 2011, 25(19): 1999-2010. |
| [8] | Zarzynska J M. The importance of autophagy regulation in breast cancer development and treatment[J]. Biomed Res Int, 2014, 2014: 710345. |
| [9] | Dong Z X, Zhao X, Gu D F, et al. Comparative effects of liensinine and neferine on the human ether-a-go-go-related gene potassium channel and pharmacological activity analysis[J]. Cell Physiol Biochem, 2012, 29(3/4): 431-442. |
| [10] | Tian Y, Qian S, Jiang Y, et al. The interaction between human breast cancer resistance protein (BCRP) and five bisbenzylisoquinoline alkaloids[J]. Int J Pharm, 2013, 453(2): 371-379. |
| [11] | 宗贝歌, 周艳, 杨新华, 等. ERβ1影响乳腺癌上皮间质转化和侵袭迁移的初步试验研究[J]. 第三军医大学学报, 2014, 36(4): 317-320. |
| [12] | 杜俊泽, 范林军, 齐晓伟, 等. MicroRNA-206可能通过调控Cx43表达调节人乳腺癌细胞的转移能力[J]. 第三军医大学学报, 2014, 36(2): 115-120. |
| [13] | Gewirtz D A. The four faces of autophagy: implications for cancer therapy[J]. Cancer Res, 2014, 74(3): 647-651. |
| [14] | Cheong H, Lu C, Lindsten T, et al. Therapeutic targets in cancer cell metabolism and autophagy[J]. Nat Biotechnol, 2012, 30(7): 671-678. |
| [15] | Kreuzaler P, Watson C J. Killing a cancer: what are the alternatives?[J]. Nat Rev Cancer, 2012, 12(6): 411-424. |
| [16] | Law B Y, Chan W K, Xu S W, et al. Natural small-molecule enhancers of autophagy induce autophagic cell death in apoptosis-defective cells[J]. Sci Rep, 2014, 4: 5510. |
| [17] | Cheng Y, Ren X, Hait W N, et al. Therapeutic targeting of autophagy in disease: biology and pharmacology[J].Pharmacol Rev, 2013, 65(4): 1162-1197. |



