先天性心脏病是婴幼儿最常见的先天性畸形,而紫绀型先心病是其重要的组成部分。尽管目前紫绀型先心病的临床治疗已较为成熟,但复杂性紫绀型先心病的手术死亡率仍然较高[1]。复杂性紫绀型先心病的病理生理改变尚不清楚,导致围手术期中缺乏有效的心肌保护策略,是制约临床治疗水平的瓶颈[2],而心肌慢性缺氧是紫绀型先心病共有的临床特点及病理改变,因此,深入研究心肌慢性缺氧的适应机制具有重要意义。
在心肌慢性缺氧适应机制的研究中,既往研究已证实在慢性缺氧条件下,心肌通过增加线粒体生物合成[3]、改变能量代谢相关酶活性以及转录水平[4, 5]等一系列调节来满足心肌能量需求。能量代谢调节是心肌适应慢性缺氧的关键步骤,深入研究心肌慢性缺氧能量代谢调节可能为围手术期的有效心肌保护提供新的方向。
腺苷酸激活蛋白激酶(monophosphate-activated protein kinase,AMPK)是一种在真核细胞生物中广泛存在的丝氨酸/苏氨酸蛋白激酶,广泛参与糖类代谢、脂质代谢、蛋白质代谢等细胞生理代谢的调控。近年来,AMPK在心血管系统中的作用被广泛关注,被认为是疾病状态下心脏能量代谢的“中心调控分子”[6]。既往研究证实心肌细胞在慢性缺氧适应中,AMPK激活水平增加并作用于转移抑制因子(migration inhibitory factor,MIF),但对心肌细胞的影响暂不清楚[7]。本研究将检测AMPK在慢性缺
氧条件下的激活水平,探讨AMPK激活对慢性缺氧心肌细胞的影响及意义,旨在提高紫绀型复杂先心病围手术期的心肌保护治疗水平。 1 资料与方法 1.1 临床资料与分组
研究经第三军医大学新桥医院伦理委员会批准,术前征得患儿家属同意并签署知情同意书。以入院后经我院经验丰富的心脏彩超技师复查的心脏彩色多普勒超声检查结果为诊断标准,如行心室造影检查,则以造影检查结果作为确诊标准。常温环境不吸氧1 h以上测四肢血压和血氧饱和度。纳入标准:紫绀组,平均血氧饱和度<85%且四肢血氧饱和度差异≤2%,临床诊断为法洛氏四联症(tetralogy of fallot,TOF),术中需要行右室流出道疏通术;非紫绀组,平均血氧饱和度>95%且四肢血氧饱和度差异<2%,临床诊断为室间隔缺损(ventricular septal defect,VSD)合并右室流出道狭窄,术中行室间隔修补术、同时行右室流出道疏通术。按照以上纳入标准[8],入选2013年在本科行手术治疗的先心病患儿34例,其中紫绀组20例,非紫绀组14例。从上述2种疾病中各选出12例患儿(表 1)。所有患儿入院后病史、查体和实验室检查排除心脏合并畸形、唐氏综合征及其他系统病变。
组别 | n | 性别 (男/女) | 手术时年龄 (月,±s) | 临床诊断 | 射血分数 (%,±s) | 术前血氧饱和度 (%,±s) | 血红蛋白 (g/L,x±s) |
| 紫绀组 | 20 | 5/7 | 87.0±27.9 | TOF | 71.4±1.7a | 81.7±2.0a | 148.7±8.5 |
| 非紫绀组 | 14 | 8/4 | 72.0±47.3 | VSD | 70.3±2.5 | 98.3±1.6 | 129.3±2.2 |
| a :P<0.05,与非紫绀组比较 | |||||||
选用24只清洁级SD大鼠,4~6周龄,雄性,购自第三军医大学新桥医院实验动 物中心,分为常氧组和缺氧组(n=12),体质量(156.1±16.3)g。 1.2.2 试剂
p-AMPK(T172)兔抗大鼠单克隆抗体、AMPK兔抗大鼠单克隆抗体(CST),β-actin兔抗大鼠单克隆抗体(博奥森公司),辣根酶标记山羊抗兔IgG(中杉金桥公司),RIPA(自配),PMSF、磷酸酶抑制剂、BCA试剂盒(碧云天公司),H9c2心肌细胞株(ATCC),DMEM高糖、FBS(Gibco公司),双抗(Hyclone公司),胰酶、Compound C、AICAR(Sigma公司),DMSO(索莱宝公司),LDH细胞检测试剂盒、Hoechst染色试剂盒、TUNEL检测试剂盒(碧云天公司)、Annexin V-FITC双染(BD公司) 1.3 方法 1.3.1 动物处理
将缺氧组SD大鼠置入低压舱 (贵州风雷航空军械有限责任公司);模拟海拔5 000 m,气压405 mmHg(第三军医大学高原军事医学系低压氧舱);大鼠自由进食和饮水;常氧组SD大鼠由第三军医大学新桥医院动物中心正常饲养。同时喂养28 d后,建立SD大鼠慢性缺氧模型和常氧对照SD大鼠(表 2)。
| 组别 | 血氧饱和度(%) | 血红蛋白(g/L) |
| 常氧组 | 91.67±1.20 | 14.20±1.36 |
| 慢性缺氧组 | 71.00±1.16a | 17.30±1.53 |
| a :P<0.05,与常氧组比较 | ||
①人体心肌组织:常规麻醉、开胸建立体外循环,取手术中切除的右室流出道心肌组织作为标本。②大鼠心肌组织:缺氧组经过慢性缺氧处理后,测定血氧饱和度后经断颈法处死并迅速开胸取出心脏,分离右心室及左心室和室间隔,取右室部分,锡箔纸包裹后存于-80 ℃备用。 1.3.3 Compound C和AICAR处理缺氧心肌细胞
将H9c2细胞株置入缺氧培养箱(94% N2,5% CO2,1% O2),36 h更换1次培养液(培养液含10%胎牛血清),培养72 h后建立慢性缺氧模型[9]。根据不同实验要求,将慢性缺氧心肌细胞转移至6孔板、96孔板 或制作细胞爬片,细胞密度在5×104/cm2左右,向各组细胞加入处理因素:低氧组(加入等量DMSO)、阻断组(加入Compound C,使其终浓度为20 μmol/L)[10, 11]、 激活组(加入AICAR,使其终浓度为0.5 mmol/L)[12, 13],继续置入缺氧培养箱培养12 h。与此同时,设立同等时间的常氧对照组。抽提上述4组心肌细胞蛋白,用Western blot测定p-AMPK激活水平;将细胞爬片用TUNEL和DAPI染色,并在荧光显微镜下观察荧光;用Annexin V-FITC染色,流式细胞仪观察细胞凋亡比例;用LDH细胞检测试剂盒处理,酶标仪测定光密度值;用hoechst染色后,荧光显微镜下对比各组细胞核变化。 1.3.4 Western blot测定p-AMPK激活水平
心肌组织:从-80 ℃中取出冻存的心肌组织,取0.1 g溶解于组织裂解液中制成匀浆;心肌细胞:收集上述各组处理的细胞于EP管中,PBS缓冲液漂洗后,加入细胞裂解液。离心30 min后取上清液用BCA法测定蛋白质含量。各标本取等量蛋白质样品于100 ℃加热5 min后,上样于10%SDS-聚丙烯酰胺凝胶中电泳,将蛋白质从SDS-聚丙烯酰胺凝胶转移到聚偏二氟乙烯滤膜上,在5%BSA中封闭1 h。随后,加入p-AMPK(T172)兔抗大鼠单克隆抗体,置4 ℃过夜,以β-actin为内参。再加入山羊抗兔IgG室温孵育1 h,ECL显影成像,凝胶成像系统采集图片。图像用Image-Pro Plus 6.0软件进行分析,用p-AMPK/AMPK条带灰度比值表示蛋白表达量。 1.3.5 TUNEL实验
将4组细胞爬片用4%多基甲醛固定30 min,PBS缓冲液洗5 min,加入含0.1% Triton X-100的PBS冰浴孵育2 min,PBS缓冲液冲洗10 min×2次,将TUNEL工作液加入6孔板中37 ℃避光孵育60 min,PBS缓冲液冲洗10 min× 3次,DAPI染色液染色10 min,PBS缓冲液冲洗5 min×3次,将爬片取出,抗荧光淬灭剂封片,免疫荧光显微镜下采集图片。用Image-Pro Plus 6.0软件随机抽取6个区域分别测定TUNEL荧光数量,DAPI染色细胞核数量,用TUNEL荧光数量/DAPI细胞核数量表示细胞凋亡水平。 1.3.6 流式细胞仪检测
收集上述4组处理的细胞于EP管,PBS缓冲液漂洗,加入Annexin V-FITC检测液重新悬浮细胞,同时加入碘化丙啶染色液,轻轻混匀,室温避光孵育20 min,随即进行流式细胞仪检测。以损伤细胞比例(%)=Q2(晚期凋亡+坏死细胞)+Q3(早期凋亡细胞)评价心肌细胞损伤水平。 1.3.7 LDH细胞死亡率检测实验
将正常心肌细胞、慢性缺氧心肌细胞分别接种于96孔板,按照上述分组,每组6孔(3孔为LDH测定孔,另3孔为LDH最大酶活性测定孔),另加3孔背景空白孔,共计27孔。待细胞贴壁后,PBS缓冲液漂洗,更换培养基,按上述方法处理细胞,提前1 h向LDH最大酶活性测定孔中加入LDH释放剂,37 ℃孵育1 h,离心机400×g离心5 min,分别吸取各孔上清液,加入LDH检测工作液,酶标仪测定各孔光密度值。计算细胞死亡率[细胞死亡率=(处理样品光密度值-样品对照孔光密度值)/(细胞最大酶活性的光密度值-样品对照孔光密度值)×100%]。 1.3.8 Hoechst染色实验
将含有上述4组处理细胞的96孔板用PBS缓冲液漂洗,加入Hoechst33528染色液,37 ℃孵育20 min,弃染色液,PBS缓冲液漂洗5 min×3次,滴入抗荧光淬灭液,用荧光显微镜采集图像。每组随机选取6个区域观察不正常细胞核,采用不正常细胞核数量/总细胞核数量表达各组细胞凋亡情况。 1.4 统计学分析
采用SPSS 13.0统计软件,数据采用x±s表示。多组比较采用单因素方差分析法,两两比较用LDS法;两组比较采用独立样本t检验。 2 结果 2.1 慢性缺氧心肌组织中AMPK磷酸化水平
与非紫绀组(常氧组)相比,紫绀组先心病患儿(慢性缺氧组SD大鼠)心肌细胞中AMPK蛋白激活水平明显增加(P<0.01,图 1)。
 |
| A、B:分别为SD大鼠和人体心肌组织Western blot检测结果;C:半定量分析 a:P<0.01,与正常心肌组织比较图 1 Western blot检测p-AMPK在慢性缺氧心肌组织中的激活 |
常氧组、低氧组、阻断组、激活组4组心肌细胞中p-AMPK蛋白激活水平均有明显差异(P<0.05),且阻断组、激活组分别与低氧组比较,差异有统计学意义(P<0.01,图 2)。
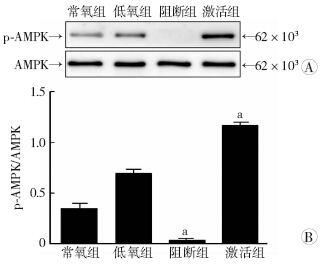 |
| A:Western blot检测结果;B:半定量分析 a: P<0.01,与低氧组比较 图 2 Western blot检测药物干预后各组心肌细胞p-AMPK 激活水平 |
与低氧组比较,阻断组不正常核细胞比例明显增多(P<0.01),同时,激活组与低氧组相比不正常核细胞比例降低(P<0.05,图 3)。
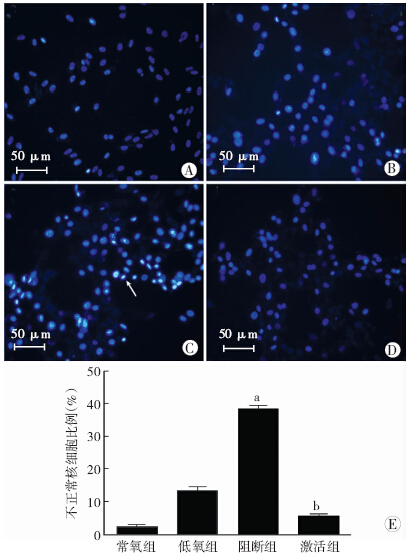 |
| A~D:Hoechst33528染色观察,分别为常氧组、低氧组、阻断组、激活组 箭头示不正常细胞核;E:不正常细胞核数与总细胞核数比值 a:P<0.01,b: P<0.05,与低氧组比较 图 3 药物干预后各组心肌细胞Hoechst染色观察 |
常氧组、低氧组、阻断组、激活组凋亡细胞比例分 别为4.33%、8.15%、18.45%、5.12%,与低氧组相比,激活组凋亡细胞比例降低,而阻断组凋亡细胞比例升高(图 4)。
 |
| A~D:分别为常氧组、低氧组、阻断组、激活组 图 4 流式细胞仪检测药物干预后各组心肌细胞凋亡 |
常氧组、低氧组、阻断组、激活组4组间TUNEL-阳性细胞比值差异均有显著性(P<0.05)。与低氧组比较,阻断组TUNEL-阳性比值升高,激活组降低(P<0.01,P<0.05,图 5)。
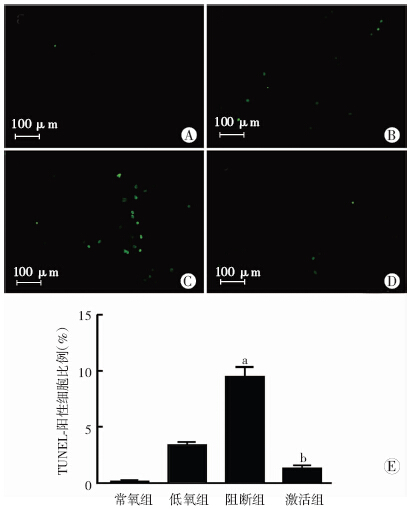 |
| A~D: TUNEL检测心肌细胞凋亡,分别为常氧组、低氧组、阻断组、激活组;E:TUNEL-阳性细胞与总细胞数(DAPI染色)比值 a:P<0.01,b: P<0.05,与低氧组比较 图 5 TUNEL检测药物干预后各组心肌细胞凋亡 |
与低氧组比较,阻断组细胞死亡率明显增高,而激活组则降低(P<0.05,P<0.01,图 6)。
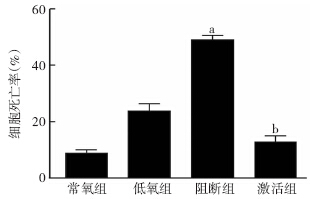 |
| a:P<0.01,b: P<0.05,与低氧组比较图 6 LDH测定药物干预后各组心肌细胞死亡率 |
心肌慢性缺氧是临床常见的病理生理过程,紫绀型先心病、稳定型冠心病等是临床常见的导致心肌慢性缺氧的疾病类型。在慢性缺氧过程中,心肌会逐渐产生一系列适应性变化,以保证心肌的存活和功能维持,这些防御性变化被统称为心肌慢性缺氧适应[14]。目前认为心肌慢性缺氧适应中的保护作用包括ATP敏感性钾通道激活、NOS活性改变及NO生成增加、各种蛋白激酶激活等方面[15, 16],但心肌细胞能量代谢调节仍是心肌慢性缺氧适应中的保护作用中的主要环节。
作为心肌细胞能量调节的关键激酶[17],AMPK在慢性缺氧条件下,与常氧条件相比,其激活水平明显增高;在进一步探讨p-AMPK在心肌慢性缺氧适应的影响研究中,我们通过加入AMPK特异性阻断剂Compound C和特异性激活剂AICAR,实现对AMPK的阻断和激活。在细胞凋亡方面,流式细胞仪和TUNEL实验的结果显示:与低氧组相比,AMPK阻断组凋亡细胞比例明显升高,相反,AMPK激活组凋亡水平低于低氧对照组;同时在细胞死亡方面,Hoechst染核和LDH心肌细胞死亡率测定结果显示:AMPK阻断组心肌细胞死亡率明显高于低氧对照组,而AMPK激活组与低氧对照组相比,细胞死亡率却有所下降。本研究结果提示:在心肌慢性缺氧适应中,AMPK的激活对减少心肌损伤有着重要作用。
既往研究中,虽有文献[18]报道AMPK激活可促进肿瘤细胞在慢性缺氧条件下的存活,但本研究发现AMPK激活仍然参与促进慢性缺氧时心肌细胞的存活,这无疑给复杂性紫绀型先心病围手术期的心肌保护治疗提供了新的方向,但AMPK激活对慢性缺氧时心肌细胞的保护作用的具体机制仍不清楚。究其原因,AMPK在急性或慢性缺氧、心肌缺血、心室超负荷等能量状态时被激活,活化的AMPK通过调节下游效应分子,增加葡萄糖的摄取、转移进而增加能量合成,同时抑制蛋白合成的能量消耗途径[19, 20],从而对心肌产生一定的保护作用。最新研究表明,激活的AMPK还可能通过AMPK-ULK1-Beclin1-VSP34途径介导细胞自噬[21, 22],通过溶酶体对细胞结构的降解、原料的再循环对心肌产生保护作用。因此,进一步研究AMPK在心肌慢性缺氧适应中的保护作用的机制,可能为紫绀型先心病围手术期的心肌保护治疗提供新的策略。
| [1] | Kornosky J L, Salihu H M. Getting to the heart of the matter: epidemiology of cyanotic heart defects[J]. Pediatr Cardiol, 2008, 29(3): 484-497. |
| [2] | Roger V L, Go A S, Lloyd-Jones D M,et al. Heart disease and stroke statistics-2012 update: a report from the American Heart Association[J]. Circulation, 2012, 125(1): e2-e220. |
| [3] | Chitra L, Boopathy R. Altered mitochondrial biogenesis and its fusion gene expression is involved in the high-altitude adaptation of rat lung[J]. Respir Physiol Neurobiol 2014, 192: 74-84. |
| [4] | Nouette-Gaulain K, Biais M, Savineau J P,et al. Chronic hypoxia-induced alterations in mitochondrial energy metabolism are not reversible in rat heart ventricles[J]. Can J Physiol Pharmacol, 2011, 89(1): 58-66. |
| [5] | Essop M F. Cardiac metabolic adaptations in response to chronic hypoxia[J]. J Physiol, 2007, 584(Pt 3): 715-726. |
| [6] | Arad M, Seidman C E, Seidman J G,et al . AMP-activated protein kinase in the heart: role during health and disease[J]. Circ Res, 2007, 100(4): 474-488. |
| [7] | Jian Z, Li J B, Ma R Y,et al. Increase of macrophage migration inhibitory factor (MIF) expression in cardiomyocytes during chronic hypoxia[J]. Clin Chim Acta, 2009, 405(1/2): 132-138. |
| [8] | 蹇朝, 马瑞彦, 王咏, 等. 缺氧诱导因子-1α在紫绀型先心病患儿心肌中的表达[J]. 第三军医大学学报, 2009, 31(12): 1189-1192. |
| [9] | He S, Liu P, Jian Z,et al. miR-138 protects cardiomyocytes from hypoxia-induced apoptosis via MLK3/JNK/c-jun pathway[J]. Biochem Biophys Res Commun, 2013, 441(4): 763-769. |
| [10] | Borgdorff V, Rix U, Winter G E,et al. A chemical biology approach identifies AMPK as a modulator of melanoma oncogene MITF[J]. Oncogene, 2014, 33(19): 2531-2539. |
| [11] | Kim J, Kundu M, Viollet B,et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nat Cell Biol, 2011, 13(2): 132-141. |
| [12] | Canto C, Gerhart-Hines Z, Feige J N,et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity[J]. Nature, 2009, 458(7241): 1056-1060. |
| [13] | Liang J, Shao S H, Xu Z X,et al. The energy sensing LKB1-AMPK pathway regulates p27(kip1) phosphorylation mediating the decision to enter autophagy or apoptosis[J]. Nat Cell Biol, 2007, 9(2): 218-224. |
| [14] | Kolar F, Ostadal B. Molecular mechanisms of cardiac protection by adaptation to chronic hypoxia[J]. Physiol Res, 2004, 53(Suppl 1): S3-S13. |
| [15] | Baker J E, Holman P, Kalyanaraman B,et al. Adaptation to chronic hypoxia confers tolerance to subsequent myocardial ischemia by increased nitric oxide production[J]. Ann N Y Acad Sci, 1999, 874: 236-253. |
| [16] | Eells J T, Henry M M, Gross G J,et al. Increased mitochondrial K(ATP) channel activity during chronic myocardial hypoxia: is cardioprotection mediated by improved bioenergetics?[J]. Circ Res, 2000, 87(10): 915-921. |
| [17] | Hardie D G, Carling D. The AMP-activated protein kinase--fuel gauge of the mammalian cell?[J]. Eur J Biochem, 1997, 246(2): 259-273. |
| [18] | Borger D R, Gavrilescu L C, Bucur M C,et al. AMP-activated protein kinase is essential for survival in chronic hypoxia[J]. Biochem Biophys Res Commun, 2008, 370(2): 230-234. |
| [19] | Young L H. AMP-activated protein kinase conducts the ischemic stress response orchestra[J]. Circulation, 2008, 117(6): 832-840. |
| [20] | Dyck J R, Lopaschuk G D. AMPK alterations in cardiac physiology and pathology: enemy or ally?[J]. J Physiol, 2006, 574(Pt 1): 95-112. |
| [21] | Egan D F, Shackelford D B, Mihaylova M M,et al. Phosphorylation of ULK1 (hATG1) by AMP-activated protein kinase connects energy sensing to mitophagy[J]. Science, 2011, 331(6016): 456-461. |
| [22] | Russell R C, Tian Y, Yuan H,et al. ULK1 induces autophagy by phosphorylating Beclin-1 and activating VPS34 lipid kinase[J]. Nat Cell Biol, 2013, 15(7): 741-750. |



