近年来,相较于“外源性”移植干细胞,激活“内源性”干细胞在脏器损伤修复中的优势日益凸显,内源性干细胞的恰当应用为创面修复提供了新的治疗策略。骨髓是人体巨大的内源性干细胞库,骨髓来源细胞(bone marrow-derived cells,BMDCs)含有造血干细胞(haematopoietic stem cells,HSCs)和间充质干细胞等干细胞群,在稳定的造血状态下,骨髓细胞中干细胞的数量非常少,占骨髓细胞总数的1%~10%[1]。利用药物进行骨髓动员是增加骨髓干细胞数量的有效措施,其中粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)是目前标准动员方案,临床应用安全有效,被国际上批准用于干细胞动员[2]。G-CSF动员BMDCs的机制已得到广泛研究,并证实能促进心梗、肌肉损伤、肝脏损伤等的修复。然而,G-CSF促进局部组织损伤修复的作用和机制目前仍不清楚。本研究利用转绿色荧光蛋白(green fluorescent protein,GFP)嵌合小鼠动物模型,通过流式细胞仪和免疫组化对BMDCs进行检测,分析G-CSF骨髓动员在创面愈合过程中的作用及机制。
1 材料与方法 1.1 实验动物雄性C57BL/6小鼠共60只,8周龄,体质量18~22 g,购自中科院动物研究所。转EGFP C57BL/6转基因小鼠15只,体质量18~22 g,8周龄,雄性,骨髓供体,购自南京大学模式动物研究所。
1.2 动物分组和模型建立受体鼠60Co γ射线致死剂量8.5 Gy全身照射,辐照后4 h受体鼠经尾静脉骨髓移植,每只移植GFP转基因小鼠骨髓细胞5×106个。辐照后2个月,对建立成功的GFP嵌合小鼠进行脾切除。将脾切后的嵌合小鼠随机分为骨髓动员组和对照组。对骨髓动员组小鼠进行骨髓动员,方法为皮下注射重组人的粒细胞集落刺激因子50 μg·(kg·d)-1,连续5 d;对照组小鼠给予等量的生理盐水皮下注射。各组小鼠均以1%戊巴比妥钠麻醉,背部备皮,制成1.3 cm×1.3 cm大小的缺损伤创面。骨髓动员组伤后继续每日给予粒细胞集落刺激因子50 μg·(kg·d)-1,连续3 d;对照组给予皮下注射同等量的生理盐水。
1.3 创面愈合情况仔细观察小鼠一般状况和创面愈合时间,伤后1、3、5、7、9、11、13、15、17、19 d拍照记录创面残余面积,运用Image J 图像分析软件进行创面面积测量。
1.4 创面GFP+细胞流式细胞仪检测取嵌合小鼠正常皮肤、嵌合小鼠对照组和骨髓动员组伤后第1天创面组织,按文献[3]方法制备单细胞悬液,步骤如下:将组织剪成1 mm2大小,置于含2 mg/mL 胶原酶D,1 mg/mL透明质酸酶和20 mg/mL I型DNA酶 (roche diagnostics,Penzbeg,Germany)的DMEM 培养基 (Invitrogen,Carlsbad,CA)中,37 ℃消化2 h,反复吹打成单细胞悬液,200目滤网过滤,1 000 r/min 离心5 min,PBS重悬,流式细胞仪检测GFP+细胞比例。
1.5 创面β-catenin检测取对照组和骨髓动员组伤后第3天创面组织,10%甲醛固定、石蜡包埋,5 μm连续切片。按照ABC免疫组化试剂盒说明书进行。石蜡切片常规脱蜡水化,0.01% PBS洗涤5 min 3次,3% H2O2室温浸泡10 min,0.01% PBS洗涤5 min 3次,5%胎牛血清阻断2 h,0.01% PBS液洗涤5 min 3次后甩干,滴加抗β-catenin 单克隆抗体(博士德),4 ℃冰箱过夜,次日0.01% PBS再次洗涤3次,滴加二抗生物素(1 ∶300),室温孵化30 min,DAB显色液显色,苏木精衬染,中性树胶封固。每组抽取3个样本,每个样本采用OLYMPUS BX51型光学显微镜随机检测3个不重叠视野,采集图像。采集后的图像用Image Pro Plu 6.0对阳性染色结果进行半定量分析,检测1张切片3个视野的平均光密度,平均值作为该切片的平均光密度。
1.6 统计学分析计量数据用 ±s表示,采用SPSS 17.0 统计软件进行t检验或单因素方差分析。
2 结果 2.1 创面愈合时间G-CSF骨髓动员组小鼠创面愈合增快,骨髓动员组小鼠愈合时间为(12.5±0.9)d,对照组小鼠愈合时间为(18.3±0.8)d,G-CSF骨髓动员后创面愈合时间提前5 d余,差异有统计学意义(P < 0.05)。各时相点残余创面面积如表 1。
| 组别 | 术后时间(d) | |||||||||
| 1 | 3 | 5 | 7 | 9 | 11 | 13 | 15 | 17 | 19 | |
| 对照组 | 1.88±0.1 | 1.41±0.08 | 1.03±0.11 | 0.80±0.05 | 0.64±0.03 | 0.52±0.04 | 0.36±0.04 | 0.29±0.06 | 0.22±0.06 | 0.03±0.03 |
| 骨髓动员组 | 1.88±0.1 | 0.69±0.04 a | 0.44±0.13 a | 0.35±0.04 a | 0.26±0.03 a | 0.19±0.02 a | 0.08±0.04 a | 0 | 0 | 0 |
| a: P<0.05,与对照组比较 | ||||||||||
GFP嵌合小鼠正常皮肤GFP阳性细胞比例为(5.98±1.60)%,伤后第1天对照组创面GFP阳性细胞比例为(14.92±3.92)%,骨髓动员组创面GFP阳性细胞比例为(21.14±1.91)%,各组间差异均有统计学意义(P < 0.05)。
2.3 创面β-catenin表达在对照组创源皮肤中,β-catenin蛋白主要定位在表皮中下层细胞间连接处和毛囊,棕黄色阳性颗粒主要位于细胞膜,即呈膜表达(图 1A、B)。而在骨髓动员组创源皮肤中,β-catenin在表皮全层表达明显增强,尤其是在表皮基底层和毛囊,部分呈现核表达(图 1C、D红色箭头处)。β-catenin蛋白在骨髓动员组中的平均光密度值为(0.23±0.03),较对照组中β-catenin蛋白的平均光密度值(0.14±0.04)明显增加,两者差异有统计学意义(P < 0.05)。
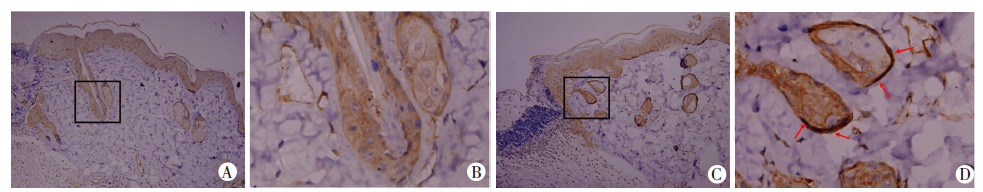 |
| A:对照组β-catenin表达(ABC ×200);B:A黑框区域放大5倍;C:骨髓动员组β-catenin表达增强,部分呈核表达(ABC ×200);D:C黑框区域放大5倍 图 1 2组小鼠创面β-catenin表达 |
1980年,Metcalf等发现经过内毒素处理的小鼠血清或者条件培养基中有一种活性成分。这种成分具有诱导小鼠骨髓单核细胞白血病细胞集落分化的功能,将之命名为粒细胞集落刺激因子(G-CSF)[4]。近年来,G-CSF在临床的应用日益广泛,是一个非常有临床应用前景的新药。目前已经实G-CSF具有动员骨髓干细胞的能力,据此学者尝试将其应用到心梗、肌肉损伤、肝脏损伤的修复中,G-CSF展现了良好的救治效果[5, 6, 7]。然而G-CSF在创面修复中的作用目前并不清楚。
本研究利用GFP嵌合小鼠观察骨髓动员组和对照组G-CSF+细胞在创面的聚集。实验结果证实,骨髓动员组创面GFP+细胞数量显著多于对照组,并且骨髓动员组创面愈合较之对照组增快5 d左右。我们在前期研究中发现,G-CSF动员后VEGF、EGF和bFGF等创面修复关键性生长因子表达上调[8],这可能是G-CSF动员后促进创面修复的可能途径之一。值得说明的是,虽然GFP嵌合鼠模型是目前研究骨髓来源细胞体内迁徙、示踪较常用和可靠的研究方法,在本研究中,创面GFP+细胞增加可能是G-CSF动员了大量骨髓来源细胞向创面的聚集,然而也有可能是损伤局部的GFP+细胞在G-CSF作用下增殖加快造成的。G-CSF动员后,创面GFP+细胞的来源和功能值得进一步研究。
Wnt信号通路是一条控制细胞命运及组织器官形态发生的重要通路。β-catenin是Wnt信号转导途径中的关键分子,具有调控干细胞增殖的重要作用[9]。该通路是否激活取决于细胞内游离β-catenin的水平[10, 11],Wnt/β-cat信号途径在创伤修复中的作用目前已受到各国学者的广泛关注。研究[12, 13]显示,小鼠皮肤创伤后Wnt/β-cat信号途径的激活,Wnt3a和Wnt4表达增加,同时Wnt3a能促进体外培养的小鼠成纤维细胞增殖;还发现,Wnt基因在皮肤损伤过程中会重新表达,其可能机制是损伤后的皮肤深层组织分泌Wnt蛋白并输送到损伤部位,以激活剩余的表皮干细胞Wnt信号通路,促使干细胞增殖和分化修复创面。目前,G-CSF动员与Wnt/β-cat信号途径之间的相互作用研究较少。本研究显示,创伤后应用G-CSF,可以上调β-catenin的表达,促进β-catenin核内转位从而激活Wnt/β-cat信号途径。
综上所述,本研究发现G-CSF动员后,GFP+细胞大量聚集于创面,并促进创面β-catenin的表达和核转位。推测Wnt信号途径关键因子β-catenin表达上调和核转位可能是G-CSF骨髓动员促进创面修复加快的重要途径之一。
| [1] | Bender J G, Unverzagt K L, Walker D E, et al. Identification and comparison of CD34-positive cells and their subpopulations from normal peripheral blood and bone marrow using multicolor flow cytometry[J]. Blood, 1991, 77(12): 2591-2596. |
| [2] | Bendall L J, Bradstock K F. G-CSF: From granulopoietic stimulant to bone marrow stem cell mobilizing agent[J]. Cytokine Growth Factor Rev, 2014, 25(4): 355-367. |
| [3] | Wilson L, Fathke C, Isik F. Tissue dispersion and flow cytometry for the cellular analysis of wound healing[J]. Biotechniques, 2002, 32(3): 548-551. |
| [4] | Burgess A W, Metcalf D. Characterization of a serum factor stimulating the differentiation of myelomonocytic leukemic cells[J]. Int J Cancer, 1980, 26(5): 647-654. |
| [5] | Centola M, Capogrossi M C. Role of G-CSF and GM-CSF therapy in patients with acute myocardial infarction and critical limb ischemia[J]. G Ital Cardiol (Rome), 2014, 15(9): 465-474. |
| [6] | Simoes G F, Benitez S U, Oliveira A L. Granulocyte colony-stimulating factor (G-CSF) positive effects on muscle fiber degeneration and gait recovery after nerve lesion in MDX mice[J]. Brain Behav, 2014, 4(5): 738-753. |
| [7] | Moreau R, Rautou P E. G-CSF therapy for severe alcoholic hepatitis: targeting liver regeneration or neutrophil function?[J]. Am J Gastroenterol, 2014, 109(9): 1424-1426. |
| [8] | Wang Y, Sun Y, Yang X Y, et al. Mobilised bone marrow-derived cells accelerate wound healing[J]. Int Wound J, 2013, 10(4): 473-479. |
| [9] | Sareddy G R, Panigrahi M, Challa S, et al. Activation of Wnt/beta-catenin/Tcf signaling pathway in human astrocytomas[J]. Neurochem Int, 2009, 55(5): 307-317. |
| [10] | Auvinen E, Carpen O, Korpela T, et al. Altered expression of ezrin, E-Cadherin and beta-Catenin in cervical neoplasia[J]. Neoplasma, 2013, 60(1): 56-61. |
| [11] | Bhagat R, Premalata C S, Shilpa V, et al. Altered expression of beta-catenin, E-cadherin, and E-cadherin promoter methylation in epithelial ovarian carcinoma[J]. Tumour Biol, 2013, 34(4): 2459-2468. |
| [12] | Carre AL, James A W, MacLeod L, et al. Interaction of wingless protein (Wnt), transforming growth factor-beta1, and hyaluronan production in fetal and postnatal fibroblasts[J]. Plast Reconstr Surg, 2010, 125(1): 74-88. |
| [13] | Fathke C, Wilson L, Shah K, et al. Wnt signaling induces epithelial differentiation during cutaneous wound healing[J]. BMC Cell Biol, 2006, 7: 4. |



