2 400038 重庆,第三军医大学基础医学部生物化学与分子生物学教研室
2 Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038, China
宫颈癌是常见的妇科恶性肿瘤之一,是导致女性死亡的重要原因[1]。由于宫颈癌的发病机制不清楚,因此治疗效果较差。研究已证实宫颈癌的发生、发展与高危型人乳头瘤病毒(high risk human papilloma virus,HR-HPV)感染有密切关系[2]。HPV可能通过一些机制启动癌基因的激活进而使正常细胞发生转化,其中E6原癌蛋白在宫颈癌的发生和维持恶性表达中的作用极其重要,被认为是宫颈癌发生、发展的重要危险因素[3]。
研究发现,端粒酶活性的异常升高与包括宫颈癌在内的多种肿瘤的发生、发展密切相关[4],在宫颈癌中HPV主要通过原癌蛋白E6(HPV E6)来促进端粒酶活性。端粒酶的强效抑制因子PinX1是高度保守的核蛋白[5],是维持细胞处于最佳生存状态的平衡器。在正常的组织几乎都表达,并且在大部分的肿瘤中都可以发现PinX1的缺失[6],因此被公认为是一种重要的抑癌基因。
宫颈癌细胞系中PinX1作为野生型p53的一个新靶基因,可以被HPV E6沉默[7],参与宫颈癌的发生、发展,但是在宫颈癌组织中是否存在上述信号通路机制尚不清楚。流行病学研究证实,鳞癌的发病率更高[8]。因此,本研究选择宫颈鳞癌患者的组织标本,从基因及蛋白水平分别检测HPV E6、野生型p53、PinX1的表达,并分析探讨上述几个分子在宫颈鳞癌发生、发展中的相关性,以期为宫颈鳞癌的临床诊治提供新的思路。 1 材料与方法 1.1 临床标本和试剂
选择2013年3月至2014年2月第三军医大学大坪医院野战外科研究所妇产科17例临床分期为ⅠB1~ⅡA2期的宫颈鳞癌患者宫颈鳞癌及距病灶2 cm 的癌旁组织,标本均经病理证实,宫颈鳞癌纳入标准依据国际妇产科联盟(FIGO,2009年)临床分期标准,患者术前未行放、化疗,年龄30~58(45.1±6.7)岁。选取正常宫颈组织10例作为对照,纳入标准:无HPV感染、无恶性肿瘤、子宫颈疾病的子宫肌瘤患者,年龄44~58(49.3±5.6)岁。本研究经第三军医大学大坪医院野战外科研究所伦理委员会批准,研究对象均签署知情同意书。
TRIzol总RNA提取试剂盒购自康为世纪公司,M-MLV逆转录试剂盒购自Invitrogen公司,Oligo DT和dNTP混合液购自天根公司,HPV E6、p53、PinX1和β-actin的特异性引物由上海生工合成,2×SYBR Green Supermix 购自TaKaRa 公司;一抗:鼠抗人HPV16+HPV18 E6抗体(ab70)、鼠抗人p53抗体(ab28)、兔抗人PinX1抗体(ab118255)均购自Abcam公司,GADPH抗体购自碧云天公司;二抗:HRP标记的羊抗鼠IgG和羊抗兔IgG购自碧云天公司,二抗:二步法免疫组化试剂PV-9000购自北京中杉金桥公司。 1.2 Real-time PCR检测HPV E6、p53、PinX1 mRNA表达
根据总RNA试剂盒TRIzol使用说明书,提取宫颈组织中的总RNA并逆转录cDNA。各引物序列见表 1。Real-time PCR总反应体系20 μL:上下游引物(10 μmol/L)各0.5 μL,cDNA 1 μL,2×SYBR Green Supermix 10 μL,灭菌超纯水8 μL;Real-time PCR反应条件:95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;为计算基因的变化量,用β-actin作为内参,每个样品3个复孔,每个复孔之间循环数相差<0.5 作为有效数据取平均值(CT)。根据所得各组CT值计算宫颈鳞癌、癌旁及正常组织中HPV E6、p53、PinX1的mRNA相对表达量,用2-△△Ct值表示。
基因 | 引物序列 | 产物大 小(bp) |
| HPV E6 | 上游:5′- GCAATGTTTCAGGACCCACAG -3′ 下游:5′- ACTGTTGCTTGCAGTACACAC -3′ | 112 |
| p53 | 上游:5′-TGCGTGTGGAGTATTTGGATGAC-3′ 下游:5′-CAGTGTGATGATGGTGAGGATGC-3′ | 170 |
| PinX1 | 上游:5′-GAAAGGGTTTAGGGGCTCAG -3′ 下游:5′-TCCGAGGAATCTGTGGTTTC -3′ | 187 |
| β-actin | 上游:5′-GTGAAGGTGACAGCAGTCGGTT-3′ 下游:5′-GAAGTGGGGTGGCTTTTAGGA-3′ | 157 |
加入含有蛋白酶抑制剂(Roche)的RIPA裂解液(1 ∶10)1 mL,玻璃匀浆器充分研磨,裂解,震荡,于4 ℃、12 000 r/min离心15 min,取上清并用BCA法测量蛋白浓度,经浓度标化后进行Western blot 检测。取60 μg蛋白样品上样进行10% SDS-PAGE(12% SDS-PAGE用于HPV E6);一抗工作浓度:鼠抗人HPV16+HPV18 E6(1 ∶250),鼠抗人p53(1 ∶1 000),兔抗人PinX1(1 ∶1 000),内参GADPH(1 ∶5 000),一抗4 ℃摇床过夜;用含0.1% Tween20的PBST洗膜3次,每次10 min,二抗:使用HRP标记的羊抗鼠IgG和羊抗兔IgG(1 ∶5 000),37 ℃摇床2 h;按ECL试剂盒说明书进行电化学发光检测。 1.4 免疫组化检测HPV E6、p53、PinX1的表达、分布
标本组织用4%多聚甲醛溶液固定24 h,切片,厚度5 μm,60 ℃烤片2 h,二甲苯脱蜡,柠檬酸高温高压抗原修复;一抗4 ℃过夜,一抗工作浓度:鼠抗人HPV16+HPV18 E6(1 ∶100),鼠抗人p53(1 ∶100),兔抗人PinX1(1 ∶100);二抗pv-9000孵育;DAB染色,复染,梯度酒精脱水,中性树脂封片,40倍物镜拍片。 1.5 统计学分析
数据以x±s形式表示,采用SPSS 17.0统计软件对计量数据行单因素方差分析及t检验,采用Spearman相关分析分析HPV E6、野生型p53和PinX1表达水平的关系。 2 结果 2.1 正常组织、癌旁组织和宫颈鳞癌组织中HPV E6、p53、PinX1 mRNA 表达
在宫颈鳞癌中HPV E6的表达明显高于癌旁(P<0.01),p53及PinX1在宫颈鳞癌组织中表达下降(P<0.05),低于癌旁组织及正常组织(表 2)。
| 组别 | HPV E6 | p53 | PinX1 |
| 宫颈鳞癌组织 | 2.27±0.32 | 0.22±0.06 | 0.24±0.06 |
| 癌旁组织 | 1.09±0.19a | 0.47±0.08a | 0.46±0.09a |
| 正常组织 | - | 0.99±0.09a | 1.03±0.10a |
| a: P<0.05,与宫颈鳞癌组织比较 | |||
免疫组化结果(图 1)显示:HPV E6阳性细胞呈棕黄色,主要定位于肿瘤细胞的细胞核和细胞质,以细胞质表达为主;而p53及PinX1阳性表达主要定位于细胞核。Western blot结果(图 2)显示:10例正常组织中,8例HPV E6几乎无表达,2例HPV E6微量表达;宫颈鳞癌组织中HPV E6的表达水平明显高于癌旁组织,而p53和PinX1的表达水平在宫颈鳞癌组织中有降低。
 |
| 图 1 免疫组织化学检测HPV E6、p53和PinX1在3种组织中的表达和分布 (S-P ×400) |
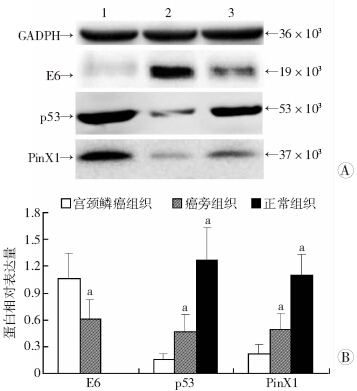 |
| A: Western blot结果 1:正常组织;2:宫颈癌组织;3:癌旁组织;B:半定量分析 a: P<0.01,与宫颈鳞癌组织比较 图 2 Western blot检测宫颈鳞癌组织、癌旁组织和正常组织中E6、p53和PinX1的蛋白表达 |
Spearman相关分析结果显示:宫颈鳞癌组织中 p53与E6的表达水平呈负相关(R=-0.605,P<0.01),PinX1与E6的表达水平呈负相关(R=-0.496,P<0.05),p53与PinX1的表达水平呈正相关(R=0.824,P<0.01)。 3 讨论
99%宫颈癌患者合并HPV感染,大多数女性在感染高致病HPV后机体能自动清除感染,少数(1%~3%)的患者存在持续的HPV感染[9]。研究已证实高致病的HPV E6蛋白是宫颈癌发生和维持恶性肿瘤表达必不可少的肿瘤蛋白[3]。本研究亦发现高危型HPV E6在宫颈鳞癌组织中表达上调,而HPV E6在正常宫颈组织中几乎不表达,或因炎症刺激所致微量表达,进一步证实高危型HPV E6可能在宫颈鳞癌发病机制中发挥着重要作用。
P53是肿瘤相关重要因子,分为野生型和突变型,野生型p53是重要的信号调节因子,称为基因组守护者[10]。研究发现,大约有一半的人类肿瘤中p53基因发生了突变,突变型p53使损伤的DNA以及发生突变的细胞进行复制,p53从抑癌基因转变成了癌基因。但在宫颈癌的相关研究中,p53很少发生突变,研究发现野生型p53的失活对宫颈癌发生起着重要作用[11]。近期研究表明,在HPV感染的宫颈癌细胞中,E6蛋白可下调野生型p53,其主要机制有:① 通过与野生型p53蛋白相互作用,并招募E6相关蛋白(E6 associated protein,E6AP),从而形成“E6-p53-E6AP”三聚体,进而通过E6AP的泛素连接酶作用,启动对野生型p53的泛素化蛋白酶体降解过程[12],致使野生型p53水平下降;② 通过抑制野生型p53的表达而下调野生型p53水平。此外,近年研究还证实,野生型p53蛋白是一种重要的转录因子,调节多个基因的表达调控[13]。高致病HPV E6通过与野生型p53的核心区域绑定从而对野生型p53表达水平进行下调[14],通过抑制野生型p53的活性进而导致促进细胞凋亡的能力明显降低,在其他因素的诱导下,进展为宫颈癌。本研究中,我们从基因及蛋白水平均发现宫颈鳞癌组织中HPV E6表达水平上调,而野生型p53表达水平下降,结合文献报道,我们推测野生型p53表达水平下降可能与HPV E6表达水平上调有关。
人体正常细胞中,端粒酶抑制因子PinX1的过度表达会抑制端粒酶的活性,诱导细胞凋亡。PinX1的主要功能包括:① 通过抑制hTERT的活性而使细胞增殖处于可控的正常过程[15];② 维持细胞在有丝分裂过程中端粒的完整性[16],并增强染色体的稳定性。体外实验和体内裸鼠成瘤实验发现,PinX1的过表达有显著的抑瘤效果,而PinX1的缺失则有显著促瘤作用[17]。在前列腺癌、胃癌、成神经管细胞瘤、卵巢癌中证实了PinX1在保持染色体的稳定性起着重要作用[6],PinX1表达下调的机制对相关肿瘤的治疗有很重要的意义,但在宫颈癌组织中其表达情况目前尚不清楚。本研究从基因及蛋白水平检测了宫颈鳞癌组织中PinX1的表达情况,结果显示宫颈鳞癌组织中PinX1表达显著低于正常对照组,提示其表达水平降低可能导致端粒酶活性增强是诱发宫颈癌发生、发展的重要机制之一。文献[6]报道PinX1与野生型p53有特异结合位点,当野生型p53受到HPV E6调节而表达降低时,野生型p53特异结合位点作用减弱,PinX1的转录因此减弱。本研究亦发现宫颈鳞癌组织中野生型p53表达水平显著下降,我们认为野生型p53的表达水平与PinX1存在正相关性,宫颈鳞癌中野生型p53表达的降低极可能是导致PinX1的表达水平下降的重要因素之一,但Pinx1是否受野生型p53以外其他基因的调控,在宫颈鳞癌中端粒酶的活性和长度的变化是否与HPV E6、野生型p53、Pinx1表达存在相关性,还需更多深入的研究。
本研究从基因及蛋白水平证实:宫颈鳞癌组织中HPV E6表达水平明显高于癌旁组织,与野生型p53以及Pinx1表达量呈负相关。PinX1在癌组织中表达水平明显低于癌旁以及正常组织,并且与野生型p53的表达量呈正相关的关系。该结果为文献[7]中宫颈癌细胞系的研究结果提供了佐证。本研究进一步证实了宫颈鳞癌的发生可能与HPV E6表达显著上调相关,表达上调的HPV E6可能通过抑制组织中野生型p53、 PinX1表达,使得端粒酶的活性增强,该途径可能是导致宫颈鳞癌的发生、发展的重要发病机制之一。本研究结果为深入研究宫颈鳞癌的发生、发展提供理论基础,有望为将来宫颈鳞癌临床诊治提供新的新靶点。
| [1] | Woodman C B, Collins S I, Young L S. The natural history of cervical HPV infection: unresolved issues [J] . Nat Rev Cancer, 2007, 7(1): 11-22. |
| [2] | Ghittoni R, Accardi R, Hasan U,et al. The biological properties of E6 and E7 oncoproteins from human papillomaviruses [J] . Virus Genes, 2010, 40(1): 1-13. |
| [3] | Jiang P, Yue Y. Human papillomavirus oncoproteins and apoptosis (Review) [J]. Exp Ther Med, 2014, 7(1): 3-7. |
| [4] | Jiang J, Zhao L J, Zhao C,et al. Hypomethylated CpG around the transcription start site enables TERT expression and HPV16 E6 regulates TERT methylation in cervical cancer cells[J]. Gynecol Oncol, 2012, 124(3): 534-541. |
| [5] | Yoo J E, Park Y N, Oh B K. PinX1, a telomere repeatbinding factor 1 (TRF1)interacting protein, maintains telomere integrity by modulating TRF1 homeostasis, the process in which human telomerase reverse Transcriptase (hTERT) plays dual roles [J]. J Biol Chem , 2014, 289(10): 6886-6898. |
| [6] | Lai X F, Shen C X, Wen Z,et al. PinX1 regulation of telomerase activity and apoptosis in nasopharyngeal carcinoma cells [J]. J Exp Clin Cancer Res, 2012, 31: 12. |
| [7] | Wu G, Liu D, Jiang K,et al. PinX1, a novel target gene of p53, is suppressed by HPV16 E6 in cervical cancer cells [J]. Biochim Biophys Acta , 2014, 1839(2): 88-96. |
| [8] | Kjaer S K, Munk C, Junge J,et al. Carcinogenic HPV prevalence and agespecific type distribution in 40, 382 women with normal cervical cytology, ASCUS/LSIL, HSIL, or cervical cancer: what is the potential for prevention?[J]. Cancer Causes Control, 2014, 25(2): 179-189. |
| [9] | Meijer C J, Snijders P J. Cervical cancer in 2013: Screening comes of age and treatment progress continues[J]. Nat Rev Clin Oncol, 2014, 11(2): 77-78. |
| [10] | Smeenk L, vanHeeringen S J, Koeppel M,et al. Role of p53 serine 46 in p53 target gene regulation [J]. PLoS One, 2011, 6(3): e17574. |
| [11] | Denk C, Butz K, Schneider A,et al. p53 mutations are rare events in recurrent cervical cancer [J]. J Mol Med (Berl), 2001, 79(5/6): 283-288. |
| [12] | Massimi P, Shai A, Lambert P,et al. HPV E6 degradation of p53 and PDZ containing substrates in an E6AP null background [J]. Oncogene, 2008, 27(12): 1800-1804. |
| [13] | Li M, He Y, Feng X,et al. Genomewide studies of the transcriptional regulation by p53 [J]. Biochim Biophys Acta, 2012, 1819(7): 684-687. |
| [14] | Shi M, Du L, Liu D,et al. Glucocorticoid regulation of a novel HPVE6p53miR145 pathway modulates invasion and therapy resistance of cervical cancer cells [J]. J Pathol, 2012, 228(2): 148-157. |
| [15] | Soohoo C Y, Shi R, Lee T H,et al. Telomerase inhibitor PinX1 provides a link between TRF1 and telomerase to prevent telomere elongation [J]. J Biol Chem, 2011, 286(5): 3894-3906. |
| [16] | Yonekawa T, Yang S, Counter C M. PinX1 localizes to telomeres and stabilizes TRF1 at mitosis [J]. Mol Cell Biol, 2012, 32(8): 1387-1395. |
| [17] | Zhou X Z, Huang P, Shi R,et al. The telomerase inhibitor PinX1 is a major haploinsufficient tumor suppressor essential for chromosome stability in mice [J]. J Clin Invest, 2011, 121(4): 1266-1282. |



