2.中西医结合科;
3.400038 重庆,第三军医大学基础医学部生物化学与分子生物学教研室;
2.Department of Integrative Western and Traditional Chinese Medicine,Xinqiao Hospital,Third Military Medical University, Chongqing,400037;
3.Department of Biochemistry and Molecular Biology,College of Basic Medical Sciences,Third Military Medical University,Chongqing,400038, China;
糖尿病是威胁人类健康的重要的慢性非传染性疾病之一,其中2型糖尿病(T2DM)约占90%。胰岛素抵抗是T2DM主要机制之一,也是T2DM的主要特征之一[1, 2]。二甲双胍是肥胖T2DM患者的一线治疗药物,能有效控制血糖,改善胰岛素抵抗,降低体重[3, 4]。
可溶性瘦素受体(soluble leptin receptor,sOB-R)是人体血液循环中最主要的瘦素结合蛋白[5],调节瘦素的生物利用度及其生理功能。它们从细胞表面瘦素受体(OB-R)的胞外区水解脱落产生,4种亚型(OB-Ra,OB-Rb,OB-Rc,OB-Rd)均可作为生成sOB-R的底物。解聚素样金属蛋白酶10(a disintegrin and metalloproteinase 10,ADAM10)、ADAM17参与了OB-R的水解脱落过程,其中ADAM10起主要作用[6]。本课题组前期研究表明,二甲双胍干预后,小鼠糖代谢的功能改善,小鼠血浆的sOB-R水平呈剂量依赖性升高[7],但机制尚不清楚。
鉴于瘦素具有广泛的生物学功能,瘦素受体广泛表达于体内多种组织,其中肝脏和肾脏组织中表达丰富[8]。为此,本研究通过观察二甲双胍灌胃的正常饮食(CD)组及高脂饮食(HF)组小鼠肝肾组织中的瘦素受体(OB-Rt,OB-Ra,OB-Rb,OB-Rc,OB-Rd)、ADAM10及ADAM17的基因及蛋白水平的改变,拟进一步探讨二甲双胍上调可溶性瘦素受体的可能机制。
1 材料与方法 1.1 动物分组及肝肾组织健康雄性C57BL/6小鼠42只,体质量(17.02±1.91)g,6~8周龄,由第三军医大学实验动物中心提供。将小鼠按随机数字表法随机分为正常饮食(CD)组(n=21)及高脂饮食(HF)组(n=21)。喂养5月后,CD组及HF组分别再随机分为3个亚组,每组7只,分别予蒸馏水,二甲双胍50、200 mg/(kg·d)灌胃,连续灌胃15 d,1次/d。剔除死亡小鼠后,CD组21只,HF组18只。眼球取血后,处死小鼠,取出肝、肾组织,储存于-80℃冰箱。血浆及肝、肾组织分组与小鼠分组一致,共分为6个亚组:①正常饮食+蒸馏水组(n=7),②正常饮食+二甲双胍50 mg/(kg·d)组(n=7),③正常饮食+二甲双胍200 mg/(kg·d)组(n=7),④高脂饮食+蒸馏水组(n=5),⑤高脂饮食+ 二甲双胍50 mg/(kg·d)组(n=6),⑥高脂饮食+二甲双胍200 mg/(kg·d)组(n=7)。
1.2 主要试剂小鼠sOB-R酶联免疫分析试剂盒(慧嘉生物公司),动物RNA提取试剂(RNAout Tiandz公司),M-MLV反转录试剂盒(美国Invitrogen公司),SYBR Premix ExTaqTMⅡ(TaKaRa公司),OB-Rt、OB-Rb、OB-Rc、OB-Rd引物由生工生物工程(上海)有限公司 合成,OB-Ra、ADAM10、ADAM17引物由百力格(上海) 公司合成。Page RulerTM Prestained Protein ladder(Thermo公司),Bio-Rad Protein Assay(Beyotime公司),兔抗Adam17多克隆抗体(美国Abcam公司),兔抗Adam10多克隆抗体(Biorbyt公司)。
1.3 酶联免疫吸附法(ELISA)检测小鼠血浆sOB-R水平小鼠血浆每孔加样小鼠sOB-R酶联免疫分析试剂50 μL,每份样品均设置复孔。严格按照试剂盒说明书进行操作。
1.4 实时荧光定量PCR严格按照动物RNA提取试剂和M-MLV逆转录试剂盒说明书操作步骤完成肝肾组织总RNA提取及cDNA合成。荧光定量PCR采用SYBR Premix ExTaqTMⅡ,按说明书完成。检测小鼠肝、肾组织OB-Rt、OB-Ra、OB-Rb、OB-Rc、OB-Rd、ADAM10、ADAM17的mRNA表达,引物见表 1。反应条件为95 ℃ 30 s 1个循环,95 ℃ 30 s,60 ℃ 30 s,40个循环。
| 基因名称 | GenBank登录号 | 引物序列(5’→3’) | 扩增片段长度(bp) |
Mice-OB-Rt | NM_001032819.1 | 上游:CAACACTGAAGGGAAGACACT 下游:CACTCTGTCCCAGTTTACA | 79 |
| Mice-OB-Ra | U49106.1 | 上游:AATGACGCAGGGCTGTATGT 下游:ATGGACTGTTGGGAAGTTGG | 194 |
| Mice-OB-Rb | U49107.1 | 上游:TGCTTTTGACTGGTGAGGCA 下游:CTGTGCGTGGAACAGGTTTG | 138 |
| Mice-OB-Rc | U49108.1 | 上游:CAAGCAGCAGAATGACGCAG 下游:GTGACCTTTTGGAAATTCAGTCCT | 133 |
| Mice-OB-Rd | U49109.1 | 上游:ACGCAGGGCTGTATGTCATT 下游:TCCTTTTGGAAATTCAGTCCTTG | 117 |
| Mice-Adam10 | NM_007399.3 | 上游:TGGAGTAGAGGAAGGAGCCC 下游:CTTTCAGCCAGAGTTGTGCG | 96 |
| Mice-Adam17 | NM_009615.6 | 上游:GTGCTGGGAAGATCACCTCC 下游:CACCACCTCTCTGGGAAACC | 81 |
| Mice-β-actin | NM_007393.3 | 上游:CTGTCCCTGTATGCCTCTG 下游:ATGTCACGCACGATTTCC | 218 |
采用组织裂解液裂解组织,采集蛋白,蛋白浓度检测用BCA(Beyotime公司)法,经Loadding Buffer混匀后煮沸10 min,变性后储存于-20 ℃冰箱。SDS-PAGE蛋白电泳后,电转移至PVDF膜上,封闭(博士徳5%封闭奶粉)4℃封闭过夜,加入抗体,抗体浓度分别为:兔抗ADAM10多克隆抗体(1 ∶500),Adam17 (1 ∶500,Abcam),单克隆小鼠B-actin IgG1(1 ∶500,Santa Cruz Biotechnology); 4 ℃摇床孵育过夜,加入辣根过氧化物酶标记的羊抗兔IgG及羊抗小鼠IgG(1 ∶5 000,中杉金桥公司)室温孵育2 h,运用化学发光剂孵育3~5 min 后显影(Bio-Rad蛋白化学发光仪)。采用Image Lab软件分析图像。
1.6 统计学分析采用SPSS 13.0统计软件,计量资料用x±s表示,多组间比较采用单因素方差分析,以Excel制图。
2 结果 2.1 二甲双胍剂量依赖性上调小鼠血浆sOB-R水平在CD组和HF组中,二甲双胍用药组的血浆sOB-R水平与蒸馏水组比较均升高,呈剂量依赖性。CD组中二甲双胍低剂量组[(28.83±5.46)ng/mL]与蒸馏水组[(18.60±1.65)ng/mL]相比升高不显著(P>0.05),高剂量组[(42.65±2.65)ng/mL]与其他 2组比较升高显著(P<0.05);HF组中二甲双胍低剂 量、高剂量组与蒸馏水组比较均显著升高[(46.67±6.86) vs (72.10±8.49)vs (27.52±2.60)ng/mL,P<0.01]。
2.2 二甲双胍上调肝脏组织中瘦素受体基因表达水平在CD组和HF组中,二甲双胍用药组小鼠肝组织OB-Rt mRNA表达与蒸馏 水组相比较均有不同程度升高。CD组 中二甲双胍50 mg/(kg·d) 组的肝组织OB-Rt mRNA表达升高不显著,二甲双胍200 mg/(kg·d)组表达明显升高(P<0.01)。HF组中与蒸馏水组比较,二甲双胍50、200 mg/(kg·d)组的肝组织OB-Rt mRNA表达显著升高(P<0.01),且呈剂量依赖。在各亚型中,OB-Ra、OB-Rc、OB-Rd的mRNA表达与OB-Rt mRNA表达变化趋势一致(表 2),OB-Rb在CD组无明显变化,而在HF组二甲双胍200 g/(kg·d)组显著升高(P<0.01)。
| 组别 | n | OB-Rt | OB-Ra | OB-Rb | OB-Rc | OB-Rd |
| 正常饮食+蒸馏水组 | 7 | 1.03±0.34 | 1.02±0.23 | 1.02±0.30 | 1.00±0.06 | 1.02±0.25 |
| 正常饮食+二甲双胍50 mg/(kg·d)组 | 7 | 1.63±0.18 | 1.71±0.16 | 0.69±0.16 | 1.02±0.13 | 0.69±0.27 |
| 正常饮食+二甲双胍200 mg/(kg·d)组 | 7 | 5.26±0.89bd | 3.01±0.60ac | 0.32±0.09 | 1.97±0.25bd | 2.48±0.15bd |
| 高脂饮食+蒸馏水组 | 5 | 2.68±0.096 | 1.08±0.73 | 0.69±0.26 | 0.97±0.12 | 1.22±0.23 |
| 高脂饮食+二甲双胍50 mg/(kg·d)组 | 6 | 4.96±0.88e | 2.84±0.18e | 0.77±0.15 | 2.60±0.18f | 2.55±0.16f |
| 高脂饮食+二甲双胍200 mg/(kg·d)组 | 7 | 9.11±1.33fg | 6.13±1.02fg | 2.39±0.59fg | 4.58±0.11fg | 4.82±0.03fg |
| a:P<0.05,b:P<0.01,与正常饮食+蒸馏水组比较;c:P<0.05,d:P<0.01,与正常饮食+二甲双胍50 mg/(kg·d)组比较;e:P<0.05,f:P<0.01,与高脂饮食+蒸馏水组比较;g:P<0.01,与高脂饮食+二甲双胍50 mg/(kg·d)组比较 | ||||||
在CD组及HF组中,二甲双胍用药组与蒸馏水组比较,ADAM10及ADAM17的mRNA水平无显著改变(表 3)。Western blot检测结果显示,ADAM10及ADAM17的蛋白水平改变也不显著(图 1)。
| 组别 | n | Adam10 | Adam17 |
正常饮食+蒸馏水组 | 7 | 1.02±0.22 | 1.00±0.01 |
| 正常饮食+二甲双胍 50 mg/(kg·d)组 | 7 | 1.06±0.14 | 1.07±0.07 |
| 正常饮食+二甲双胍 200 mg/(kg·d)组 | 7 | 0.76±0.10 | 0.85±0.10 |
| 高脂饮食+蒸馏水组 | 5 | 0.79±0.14 | 0.81±0.02 |
| 高脂饮食+二甲双胍 50 mg/(kg·d)组 | 6 | 0.82±0.75 | 0.82±0.06 |
| 高脂饮食+二甲双胍 200 mg/(kg·d)组 | 7 | 0.88±0.05 | 0.84±0.09 |
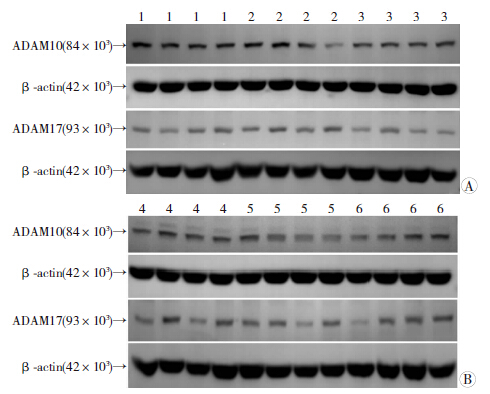 |
| 1:正常饮食+蒸馏水组;2:正常饮食+二甲双胍50 mg/(kg·d)组;3:正常饮食+二甲双胍200 mg/(kg·d)组;4:高脂饮食+蒸馏水组;5:高脂饮食+二甲双胍50 mg/(kg·d)组;6、高脂饮食+二甲双胍200 mg/(kg·d)组 A:正常饮食组;B:高脂饮食组 图 1 Western blot测各组肝组织Adam10、Adam17蛋白表达 |
sOB-R是人体血液循环中最主要的瘦素结合蛋白,通过结合瘦素,调节血浆中游离型/结合型瘦素的比值,从而调节瘦素的功能[9]。近期多项研究显示,sOB-R的水平与T2DM、肥胖、结肠癌的发生呈显著负相关[10, 11, 12, 13, 14]。肥胖者体内sOB-R水平降低,进行低热量饮食减肥后,体内sOB-R水平升高[15, 16, 17]。我们前期研究显示,二甲双胍能上调小鼠血浆sOB-R水平,该作用与糖代谢功能的改善相关[7]。上述结果提示,sOB-R水平升高不仅可能作为肥胖、T2DM患者代谢状态改善的生化指征,可能参与了二甲双胍的降糖作用。
已有研究显示,肝脏瘦素受体是血浆sOB-R的主要来源[18],本研究结果显示,二甲双胍能显著上调肝脏瘦素受体的基因表达,但对肾脏瘦素受体的表达没有显著影响。已经鉴定的瘦素受体有6种亚型(OB-Ra,-Rb,-Rc,-Rd,-Re和Rf),它们均由同一基因(db)编码,经不同的转录后加工过程形成。人体中只表达四种亚型,包括短型(OB-Ra,-Rc,Rd)及长型(OB-Rb),短型受体的表达量更为丰富[19]。为此,我们首先测定了瘦素受体基因表达的总量(OB-Rt),并进一步观察了二甲双胍对瘦素受体各亚型表达的影响,结果表明,二甲双胍主要是上调短型受体(OB-Ra、OB-Rc、OB-Rd),对肾脏中各瘦素受体亚型没有显著影响。同时,对肝、肾组织中参与瘦素受体胞外水解脱落的基质金属蛋白酶ADAM10及ADAM17表达的检测结果显示,二甲双胍并未显著影响其表达水平。综上提示,二甲双胍升高血浆sOB-R的水平主要是通过刺激肝脏组织短型瘦素受体基因表达来实现的。该作用涉及二甲双胍上调db基因转录及转录后加工过程,详细机制有待进一步阐明。
肝脏是二甲双胍降糖作用的主要靶点,目前已知的该药物的降糖机制主要包括:抑制肝糖异生从而减少肝糖输出[20, 21];抑制胰高血糖素的升糖作用[22]。新近报道,二甲双胍抑制二肽基肽酶Ⅳ(DPP-4),从而增加GLP-1的浓度,达到降糖作用[23]。本研究发现,二甲双胍能显著上调肝脏中的短型瘦素受体及血浆中sOB-R水平,同时也能显著上调具有信号转导作用的OB-Rb表达,这些结果提示二甲双胍对肝脏的瘦素信号具有调节作用。其降糖作用可能与调节肝脏瘦素信号功能有关。进一步深入研究肝脏瘦素信号在血糖调节中的作用,将拓展对二甲双胍降糖作用机制的认识。
| [1] | 甘立霞. 2型糖尿病基础研究中的难题与突破[J]. 第三军医大学学报, 2014, 36(15): 1543-1547. |
| [2] | 郭绍东. 组织特异性胰岛素抵抗及其代谢综合征的机制探讨[J]. 第三军医大学学报, 2014, 36(15): 1535-1542. |
| [3] | Miller R A, Birnbaum M J. An energetic tale of AMPK-independent effects of metformin[J]. J Clin Invest, 2010, 120(7): 2267-2270. |
| [4] | Foretz M, Guigas B, Bertrand L, et al. Metformin: from mechanisms of action to therapies[J]. Cell Metab, 2014, 20(6): 953-966. |
| [5] | Gorska E, Popko K, Stelmaszczyk-Emmel A, et al. Leptin receptors[J]. Eur J Med Res, 2010, 15 Suppl 2: 50-54. |
| [6] | Schaab M, Kausch H, Klammt J, et al. Novel regulatory mechanisms for generation of the soluble leptin receptor: implications for leptin action[J]. PLoS One, 2012, 7(4): e34787. |
| [7] | 李婧雯, 徐梓辉, 甘立霞. 二甲双胍上调小鼠血清可溶性瘦素受体水平的实验观察[J]. 中国糖尿病杂志, 2014, 22(5): 459-463. |
| [8] | Brabant G, Nave H, Horn R, et al.In vivo andin vitro evidence for a hepatic modulation of the leptin signal in rats[J] . Eur J Clin Invest, 2004, 34(12): 831-837. |
| [9] | Zhang J, Scarpace P J. The soluble leptin receptor neutralizes leptin-mediated STAT3 signalling and anorexic responses in vivo[J]. Br J Pharmacol, 2009, 158(2): 475-482. |
| [10] | Sun Q, van-Dam R M, Meigs J B, et al. Leptin and soluble leptin receptor levels in plasma and risk of type 2 diabetes in U. S. women: a prospective study [J]. Diabetes, 2010, 59(3): 611-618. |
| [11] | Catli G, Anik A, Tuhan H U, et al. The relation of leptin and soluble leptin receptor levels with metabolic and clinical parameters in obese and healthy children[J]. Peptides, 2014, 56: 72-76. |
| [12] | Owecki M, Nikisch E, Miczke A, et al. Leptin, soluble leptin receptors, free leptin index, and their relationship with insulin resistance and BMI: high normal BMI is the threshold for serum leptin increase in humans[J]. Horm Metab Res, 2010, 42(8): 585-589. |
| [13] | Aleksandrova K, Boeing H, Jenab M, et al. Leptin and soluble leptin receptor in risk of colorectal cancer in the European Prospective Investigation into Cancer and Nutrition cohort[J]. Cancer Res, 2012, 72(20): 5328-5337. |
| [14] | Song M, Zhang X, Wu K, et al. Plasma adiponectin and soluble leptin receptor and risk of colorectal cancer: a prospective study[J]. Cancer Prev Res (Phila), 2013, 6(9): 875-885. |
| [15] | Iepsen E W, Lundgren J, Dirksen C, et al. Treatment with a GLP-1 receptor agonist diminishes the decrease in free plasma leptin during maintenance of weight loss [J]. Int J Obes (Lond), 2014, [Epub ahead of print]. |
| [16] | Gajewska J, Weker H, Ambroszkiewicz J, et al. Alterations in markers of bone metabolism and adipokines following a 3-month lifestyle intervention induced weight loss in obese prepubertal children[J]. Exp Clin Endocrinol Diabetes, 2013, 121(8): 498-504. |
| [17] | Arnold T, Brandlhofer S, Vrtikapa K, et al. Effect of obesity on plasma clusterin, [corrected] a proposed modulator of leptin action[J]. Pediatr Res, 2011, 69(3): 237-242. |
| [18] | Cohen P, Yang G, Yu X, et al. Induction of leptin receptor expression in the liver by leptin and food deprivation[J]. J Biol Chem, 2005, 280(11): 10034-10039. |
| [19] | 甘立霞. 瘦蛋白信号转导及瘦蛋白抵抗机制[J]. 生命的化学, 2011, 31(5) : 656-661. |
| [20] | Jitrapakdee S. Transcription factors and coactivators controlling nutrient and hormonal regulation of hepatic gluconeogenesis[J]. Int J Biochem Cell Biol, 2012, 44(1): 33-45. |
| [21] | Foretz M, Hebrard S, Leclerc J, et al. Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state[J]. J Clin Invest, 2010, 120(7): 2355-2369. |
| [22] | Miller R A, Chu Q, Xie J, et al. Biguanides suppress hepatic glucagon signalling by decreasing production of cyclic AMP[J]. Nature, 2013, 494(7436): 256-260. |
| [23] | Cuthbertson J, Patterson S, O’Harte F P, et al. Addition of metformin to exogenous glucagon-like peptide-1 results in increased serum glucagon-like peptide-1 concentrations and greater glucose lowering in type 2 diabetes mellitus[J]. Metabolism, 2011, 60(1): 52-56. |



