超声内镜(endoscopic ultrasonography,EUS)在判断消化道黏膜层、黏膜下层及壁外病变的来源、黏膜层次及测定病变的径线方面具有独特优势,被认为是目前最精确可靠的无创检查方法[1, 2, 3],但其对于病变良恶性的鉴别能力一直存在争议[4, 5]。如何在尚未获取病理学诊断的情况下,通过EUS及相关辅助技术预见性的判定病变的良恶性成为了困扰内镜医师的一大难题。本研究通过建立基于乳腺超声的诊断标准[6],回顾性分析我院2006-2012年相关病例,尝试设计一个合理的超声内镜评分体系,用以初步预判病变性质,并辅助临床后续诊疗方案的制订。
1 资料与方法 1.1 病例来源收集2006年6月至2012年12月,于重庆医科大学附属第二医院消化内科行超声内镜检查发现消化道黏膜层、黏膜下及壁外压迫性病变并最终获取病理学标本的门诊及住院病例。纳入标准:①签署超声内镜检查知情同意书,经超声内镜检查发现存在消化道黏膜层、黏膜下及壁外压迫性病变;②该病灶最终由外科手术切除、内镜下手术切除、内镜下组织钳活检或穿刺针获取组织学或细胞学标本;③性别、年龄、入院诊断、门诊或住院病例无限制。排除标准:经超声内镜检查发现的消化道黏膜层、黏膜下及壁外压迫性病变,而最终未获取该病灶组织学或细胞学诊断的病例。共收集 509例符合上述纳入标准的病例,患者的年龄跨度13~ 85岁,平均55.44岁,男女比例为1 ∶1.28。509例病变中良恶性例数分别为422 ∶87。对收集的病例资料进行回顾性分析。
1.2 仪器和操作Pentax EPM-3500内镜主机,Hitachi公司EUB-5500彩色超声仪,Pentax EG-3830UT超声内镜,COOK公司ECHO-HD 22-G穿刺针。
所有EUS检查分别由2位经验丰富的内镜医师完成。术前准备同常规胃镜,病变处多采用水浸法显示,必要时配合水囊直接接触显示,并记录病灶表面及超声图像特征。
1.3 病理学检查与分析509例病变均为细针穿刺活检、内镜下手术或外科手术获取细胞学或组织学标本。在未参考EUS报告情况下,由1位经验丰富的病理学医师或病理科科室共同讨论后出具病理诊断报告。外院行手术或随访得知的病理结果同样记录在案。509例病理诊断结果依据与其对应的病理学资料将良性病变记为0分,恶性病变记为1分。
1.4 统计分析采用SPSS 19.0软件分析数据。对各赋值项的评估采用二元Logistic回归分析。通过Pearsonχ2检验、McNemarχ2检验及计算敏感度、特异度、阳性预测值、阴性预测值、Youden指数、诊断符合率、Kappa值等来评估超声内镜评分体系的诊断能力。Pearsonχ2检验及 McNemarχ2检验的P值取小于0.05为差异有统计学意义。
2 结果 2.1 图像分析 2.1.1 建立评分体系在参考BI-RADS超声诊断标准的基础上,结合我科在EUS应用中的判读经验,制订出适用于消化道黏膜层、黏膜下及壁外压迫性病变的超声下量化标准(表 1)。
| 观察内容 | 描述 | 分值 |
| 病灶径线 | 病灶径线或全层增厚范围≥2 cm | 1 |
| 病灶径线或全层增厚范围<2 cm | 0 | |
| 黏膜层次 | 清晰:黏膜层次分明,易于区分。 | 0 |
| 欠清晰:介于两者之间。 | 1 | |
| 不清晰或消失:黏膜层次紊乱、局部层次消失。 | 2 | |
| *溃疡表现为其底部黏膜层次,胰腺等胃外病变评估其是否侵及黏膜层次。 | ||
| 边缘 | 病灶或者肿块的边缘部分(不规则只用于描述形状) | |
| 完整清晰:病灶的边缘比较容易界定,病灶与周围组织之间界限清晰。 | 0 | |
| 不完整清晰:病灶与周围组织之间界限不清晰,边缘呈锐角改变,呈扇贝样或毛刺样变。 | ||
| *整层增厚改变者无边缘,视为不完整。 | 1 | |
| 血供 | 无 | 0 |
| 有 | 1 | |
| 肿大 | 无 | 0 |
| 淋巴结 | 有 | 1 |
| 内部回声 | 分为无回声、低回声、等回声、高回声。 | |
| 均匀:任何一种回声单独存在。 | 0 | |
| 不均匀:几种回声模式的混合存在。*溃疡病变则评价其为底部回声。 | 1 | |
| 形状 | 规则:类圆形,上下径等于或接近左右径;椭圆形或卵圆形,或略呈梭形,可有不多于三个的钝角的弯曲。 | 0 |
| 不规则:既不是圆形又不是椭圆形的都认为是不规则。 | ||
| *溃疡表现为其本身形状或其底部回声改变的形状,若无明显改变,则为规则。 | ||
| 若合并占位性病变,则只要一项满足不规则定义就视为不规则。 | ||
| *整层增厚者若合并有结构紊乱则视为不规则,反之视为规则。 | 1 | |
| 方向 | 平行:病灶的长轴与黏膜层平行,称之为水平状或宽大于高(胰腺占位的方向视为平行)。 | 0 |
| 不平行:病灶的长轴与黏膜层不平行,垂直或成角或高大于宽。 | 1 | |
| 表面 | 光滑完整,与周围正常黏膜组织无差异。 | 0 |
| 不光滑完整,或明显异于正常组织表面。 | 1 | |
| 钙化 | 有 | 0 |
| 无 | 1 | |
| 后方声像 | 增强:声波通过肿块未受阻碍 。 | 0 |
| 不变:肿块后方的组织回声与周围一致。 | 1 | |
| 衰减:肿块后方有声影 。 | 2 | |
| 混合:某些病灶后方可出现不同的回声形式。 | 3 | |
| 蒂结构 | 有 | -1 |
| 无 | 0 | |
| 积分实行累加计分,分值≤6分倾向于良性,分值>6分倾向于恶性 | ||
对获取的509例资料(包括EUS图像及其病理诊断结果)通过计算机赋予一个适当位数的随机数,作为每组资料编号。然后从每组资料中抽取已编号的EUS图像,并隐藏患者姓名、年龄、性别信息。对于每1组图像的量化均在2名有经验的超声内镜医师指导下完成,具体评分准则见EUS评分体系(表 1,图 1)。

|
| A:患者,女性,49岁,超声内镜考虑:胃底间质瘤,EUS评分3分(内部回声、后方声像、钙化项各1分),病理:(胃底)向平滑肌方向分化的间质瘤(极低危险度);B、C、D:患者,男性,68岁,超声内镜考虑:胃体间质瘤伴表面糜烂。评分9分(大小、黏膜层次、形状、方向、内部回声、后方声像、钙化、血供、表面项各1分),病理:(胃)间质瘤(高危险度) 图 1 消化道病变良恶性患者超声内镜观察 |
本研究设计的评分体系共纳 入12项量化指标,最低分可达-1分,最高分可达13分。 纳入研究的509例病变的赋值分布于1~11分(图 2)。由图 2可知,超声赋值呈非正态分布,主要集中在2、3、4分(占60.51%),3分及9分处形成大小2个峰值。据ROC曲线(AUG=0.947)给出的各界点值对应的敏感度和特异度,计算各界点处的Youden指数,取Youden指数最大处(6.5分)为参考分界点后,拟定超声赋分>6分时病变倾向于恶性,≤6分时病变倾向于良性。
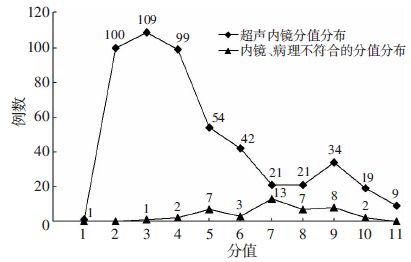
|
| 图 2 超声内镜分值分布 |
以6分为界检验EUS评分预判病灶良恶性与病理结果的一致性。结果示EUS诊断与病理诊断不符的病例共43例,其分值分布于3~10分,主要集中在7、8、9分,占65.11%(图 2)。进一步分析以3~10分(包涵所有误判分值)为界点的EUS、病理一致性数据(表 2)。示以6、7分为界时,两者在Youden指数、诊断符合率上各有优势。但相较于以6分为界,以7分为界时假阴性病例增加8例,假阳性病例减少12例。由于假阴性病例可能造成更严重的损失,故综上考虑,最终确定以6分为临界值。
| 分值 | 超声·病理 | Youden指数 | 诊断符合率 | |||
| + + | + - | - + | -- | |||
| 3 | 85 | 214 | 1 | 209 | 0.482 5 | 57.8% |
| 4 | 83 | 118 | 3 | 305 | 0.686 2 | 76.2% |
| 5 | 76 | 70 | 10 | 353 | 0.718 2 | 84.3% |
| 6 | 74 | 30 | 13 | 392 | 0.779 5 | 91.6% |
| 7 | 65 | 18 | 21 | 405 | 0.713 3 | 92.3% |
| 8 | 52 | 10 | 34 | 413 | 0.581 0 | 91.4% |
| 9 | 26 | 2 | 60 | 421 | 0.297 6 | 87.8% |
| 10 | 9 | 0 | 77 | 423 | 0.104 7 | 84.9% |
将收集的病例资料分为3组,全病例组(509例)、梭形细胞肿瘤及息肉组(278例)、其他组(231例),并以6分为界对EUS、病理诊断结果进行检验。结果见表 3。
| 组别 | n | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 | Youden指数 | 诊断符合率 | Kappa值 | Pearsonχ 2检验 | McNemarχ 2检验 | |
| P值 | R值 | P值 | |||||||||
| 全病例组 | 509 | 85.1% | 92.9% | 71.2% | 96.8% | 0.7795 | 91.6% | 0.7234 | 0.000 | 0.728 | 0.014 |
| 梭形细胞肿瘤及息肉组 | 278 | 100% | 98.5% | 42.9% | 100% | 0.9855 | 98.6% | 0.5939 | 0.000 | 0.650 | — |
| 其他组 | 231 | 84.5% | 82.3% | 73.2% | 90.3% | 0.6684 | 83.1% | 0.6469 | 0.000 | 0.651 | 0.053 |
Logistic回归分析:在单因素分析中,除后方声像、钙化、蒂结构外,余量化项的P<0.05。肿大淋巴结、黏膜层次、病灶径线长度(≥20 mm)分别引入可使回归模型预测病理良恶性的准确率由最初的82.9%分别提升至89%、88%、83.7%。在多因素分析中,模型最终入选6个量化项,分别为:黏膜层次、周围肿大淋巴结、边缘、方向、黏膜表面、血供,拟合后的回归模型对病理良恶性预测的准确率为92.9%。
3 讨论超声内镜检查已广泛应用于临床实践,但至今还未形成或建立一个针对超声内镜图像量化的评分体系。2003年建立BI-RADS超声诊断标准的作者们认为BI-RADS评分应作为影像医师、病理医师、外科医师们检查、阐述、判断和沟通的共同基础,并在报告中使用[6]。为此,我科结合多年EUS检查经验,尝试在EUS诊断中借鉴BI-RADS超声诊断标准并加以改进,以期辅助临床医师预判病灶性质及制定诊疗计划。
本研究在设计评分量表时,结合文献资料[1, 2, 3, 4, 7, 8, 9, 10, 11, 12, 13, 14, 15]、 BI-RADS超声诊断标准及我科EUS判读经验,最终选入12项量化项(如表 1所示)。在单因素分析中,蒂结构、钙化及后方声像的P值均>0.05,其余量化项P值均<0.05。其中,肿大淋巴结、黏膜层次、病灶径线长度(≥20 mm)的单独引入均提升了预判的准确度。多因素分析提示黏膜层次、周围肿大淋巴结、边缘、方向、黏膜表面、血供这6项参量具有意义。
对509例病变EUS与病理诊断结果进行检验:Pearsonχ2检验(χ2值= 269.573,P<0.001)表明EUS诊断与病理诊断不独立,列联系数R= 0.728表明两种数据检验方法所得结果之间具有正相关性,说明EUS对病灶良恶性的诊断有较好的参考价值。而McNemarχ2检验(P=0.014)表明EUS诊断与病理诊断之间仍存在差异,即EUS的诊断尚不能等同于病理学诊断。在509例病例组中EUS预判病变良恶性的敏感度、特异度、PPV、NPV分别为85.1%、92.9%、70.2%、96.8%。本试验中假阴性病例共13例。有8例(61.5%)被内镜医师不同程度地怀疑为恶性病变。13例病灶在径线长度、黏膜层次、肿大淋巴结、血供这4个核心量化项上总分均低(5例得1分、8例得0分),而在边缘项中有8例得1分,5例得0分。
Amer等提出应用EUS评价黏膜下占位性病变时,包括病灶大小、黏膜层次、内部血供、黏膜表面、淋巴结、病灶与周围结构的关系等指标应予以记录[2]。也有研究显示在EUS对消化道隆起性病变的诊断中,病变径线长度、黏膜表面情况、黏膜层次、血供、肿大淋巴结、不均匀的内部回声、不规则的边缘这7项指标对判断病变性质有意义[1, 2, 3, 4, 7, 8, 9, 10, 11]。这与我科既往EUS检查的经验相符合。另有研究指出当病灶径线<20 mm时存在较低恶变风险[12],但任何径线上的增大都提示恶变风险增加及建议手术切除[13, 14]。故本试验在设定病变径线的赋值标准时,综合多位学者的研究[3, 4, 7, 12, 13, 14, 15],结合降低EUS诊断的假阴性病例的考虑,决定以20 mm作为判定良恶性的界限。多因素分析中入选的6个参量也得到了既往相关研究的支持[2, 3, 4, 7]。本试验的敏感度、特异度、PPV、NPV均与多位学者的研究结果大致符合[1, 4, 8, 9, 11]。
在Martínez-Ares等研究中,EUS诊断黏膜下恶性肿瘤的敏感性、特异性、PPV、NPV分别为89.5%、90.9%、89.5%和90.9%,其入组病变的平均径线长度达37.42 mm[1],而本试验中多数病灶(377/509)径线长度小于20 mm 。当病灶径线大于3 cm时,相较于小病灶而言,更常出现边缘不规则、内部回声不均匀等多项改变[3, 5](图 1),故这可能是其敏感性、PPV优于本试验的原因。
本试验中,231例病例组的EUS、病理诊断结果正相关性及诊断方法的一致性均劣于总病例组(509例),但其McNemarχ2检验却出现更理想的结果(P>0.05,EUS病理诊断之间的差异无统计学意义),这与实际临床经验不符,其原因可能为:在剔除部分病例得到的231例新样本中,假阴性与假阳性病例数更为接近,造成其结果得到统计学公式上的“惩罚”,使得P值不合理的增大,从而得出了EUS、病理诊断结果无差异,EUS诊断可以取代病理诊断的不合理结论[17, 18]。
笔者认为,本研究中入组含有蒂结构、有钙化及后 方声像有特殊改变的例数分别为22(4.3%)、8(1.6%)、 8(1.6%)例,例数少可能是造成此三项指标在单因素分析中无统计学意义的原因。其中,对于“钙化”项的赋值仍存在争议。Kim等在中等大小的胃肠道间质瘤研究中,认为钙化灶对于良恶性的鉴别并无显著意义[16]。另外,“蒂结构”作为“方向”的修正因子被引入,其主要作用是修正带蒂息肉(绝大多数为良性病变)在“方向”这一量化项上的加分,两者具有明显的负相关(Person Correlation=-0.305,P<0.01),故可能削减了“蒂结构”指标在单因素分析中的意义。在单因素分析中,具有重要意义的量化项“病灶径线长度≥20 mm”却未被选入多因素分析的拟合模型,其原因可能为随病灶径线增大,更常合并边缘不规则、内部回声不均匀、黏膜层次紊乱等情况,从而影响了该量化项的纳入。笔者认为,在后续多中心、大样本的试验中,仍需要根据临床资料、试验结果及统计学结果对入组量化项在评分量表中的权重予以调整。
Chien等提到在应用EUS观察、评估病灶时,边缘异化是最具意义的参量之一,提示存在潜在恶变风险[3]。结合本试验对假阴性病例的分析,也许提示在EUS检查中相较于其他量化项,病灶边缘异化可作为一个更为敏感的早期指标。
新建立的EUS-BIRADS评分体系对于消化道黏膜隆起性病变良恶性的预判与病理诊断之间有较好一致性,可以辅助临床医师在未获取病理标本之前或无法获取病理学标本时预判病变性质,制定后续治疗方案。但本研究也存在以下不足之处:①对于每一组超声图像的评价,在很大程度上也取决于观察者的易变性,故经验丰富的内镜医师是客观、准确评分的保证。本研究中,每一组图像的量化值由两位内镜医师共同商议决定,故缺乏对观察者组间一致性的论证。②对于入组病例缺乏长期的、完善的随访,可能导致假阴性病例增多。③对于各个量化项标的赋值标准及合理赋值分数,更有待于临床实践去修正、完善。④我们采用的是单中心的回顾性分析。因此,对于该评分体系的应用价值,更有待于精心设计一个多中心、大样本的前瞻性研究加以证实。
| [1] | Martinez-Ares D, Souto-Ruzo J, Yanez-Lopez J, et al. Usefulness of endoscopic ultrasonography in the preoperative diagnosis of submucosal digestive tumours[J]. Rev Esp Enferm Dig, 2005, 97(6): 416-426. |
| [2] | Alkhatib A A, Faigel D O. Endoscopic ultrasonography-guided diagnosis of subepithelial tumors[J]. Gastrointest Endosc Clin N Am, 2012, 22(2): 187-205, vii. |
| [3] | Chien C H, Chien R N, Yen C L, et al. The role of endoscopic ultrasonography examination for evaluation and surveillance of gastric subepithelial masses[J]. Chang Gung Med J, 2010, 33(1): 73-81. |
| [4] | Will U, Fueldner F, Mueller A K, et al. A prospective study on endoscopic ultrasonography criteria to guide management in upper GI submucosal tumors[J]. Pol Przegl Chir, 2011, 83(2): 63-69. |
| [5] | Seo S W, Hong S J, Han J P, et al. Accuracy of a scoring system for the differential diagnosis of common gastric subepithelial tumors based on endoscopic ultrasonography[J]. J Dig Dis, 2013, 14(12): 647-653. |
| [6] | Levy L, Suissa M, Chiche J F, et al. BIRADS ultrasonography[J]. Eur J Radiol, 2007, 61(2): 202-211. |
| [7] | Nishida T, Kawai N, Yamaguchi S, et al. Submucosal tumors: comprehensive guide for the diagnosis and therapy of gastrointestinal submucosal tumors[J]. Dig Endosc, 2013, 25(5): 479-489. |
| [8] | Brand B, Oesterhelweg L, Binmoeller K F, et al. Impact of endoscopic ultrasound for evaluation of submucosal lesions in gastrointestinal tract[J]. Dig Liver Dis, 2002, 34(4): 290-297. |
| [9] | Palazzo L, Landi B, Cellier C, et al. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours[J]. Gut, 2000, 46(1): 88-92. |
| [10] | Lok K H, Lai L, Yiu H L, et al. Endosonographic surveillance of small gastrointestinal tumors originating from muscularis propria[J]. J Gastrointestin Liver Dis, 2009, 18(2): 177-180. |
| [11] | Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study[J]. Scand J Gastroenterol, 2002, 37(7): 856-862. |
| [12] | Al-Haddad M, Dewitt J. EUS-guided sampling of suspected GI mesenchymal tumors: cells, cores, or a combination?[J] Gastrointest Endosc, 2009, 69(7): 1224-1227. |
| [13] | Tanaka J, Oshima T, Hori K, et al. Small gastrointestinal stromal tumor of the stomach showing rapid growth and early metastasis to the liver[J]. Dig Endosc, 2010, 22(4): 354-356. |
| [14] | Okada K, Maruyama K, Nagase H, et al. A case of gastrointestinal stromal tumor of the stomach with rapid growth in a short term[J]. Gan To Kagaku Ryoho, 2008, 35(12): 2080-2082. |
| [15] | Demetri G D, von-Mehren M, Antonescu C R, et al. NCCN Task Force report: update on the management of patients with gastrointestinal stromal tumors[J]. J Natl Compr Canc Netw, 2010, 8(Suppl 2): S1-S44. |
| [16] | Kim M N, Kang S J, Kim S G, et al. Prediction of risk of malignancy of gastrointestinal stromal tumors by endoscopic ultrasonography[J]. Gut Liver, 2013, 7(6): 642-647. |
| [17] | Cochran W G. The comparison of percentages in matched samples[J]. Biometrika, 1950, 37(3/4): 256-266. |
| [18] | 陆运清. 相关四格表数据资料检验方法的进展与应用[J].统计与决策, 2011(17): 30-32. |



