高血压是危害人类健康的重大疾病。高血压血管重构是高血压靶器官损害的病理基础,也是心脑血管疾病发生的主要原因。血管平滑肌细胞 (vascular smooth muscle cells,VSMCs)异常增殖是血管重构发生、发展过程中的重要病理机制[1]。大量增殖的VSMCs直接导致动脉内膜中膜增厚,致使血管管腔缩小,壁腔比值增加,发生肥厚性内向性动脉重构[2]。因此,抑制VSMCs异常增殖是防治高血压动脉重构和靶器官损害的关键步骤。
瞬时受体电位香草醛亚家族1(transient receptor potential vanilloid 1,TRPV1)属于瞬时受体电位 (transient receptor potential,TRP) 中TRPV亚家族,是一个非选择性的阳离子通道,可被膳食辣椒素(红辣椒中的辛辣成分)强效激活[3]。研究显示TRPV1的活化可以减轻动脉粥样硬化、降低血压、改善心肌重构等[4, 5, 6]。膳食辣椒素激活TRPV1可改善易卒中型高血压大鼠血管内皮舒张功能,进而减轻脑动脉管壁肥厚,延缓脑卒中的发作[7],提示TRPV1可以改善高血压血管重构,但具体机制尚不清楚。我们推测TRPV1可能通过抑制VSMCs增殖而改善血管重构。本研究观察TRPV1对培养的自发性高血压大鼠(spontaneously hypertensive rats,SHR)来源的VSMCs增殖的影响及其可能的分子机制,旨在寻找调控高血压动脉重构的新靶点。 1 材料与方法 1.1 实验动物及主要试剂
SPF级10周龄雄性SHR和正常对照Wistar Kyoto大鼠 (WKY)各3只,体质量200~250 g,均购自北京维通利华实验动物中心,实验动物质量许可证号为SCXK (京) 2012-0001。胎牛血清、DMEM培养基均购自美国Gibco公司。胰酶细胞消化液、青霉素-链霉素
溶液(100X)均购自江苏碧云天生物技术研究所。辣椒素、5’-iodo-resiniferatoxin (iRTX )、二甲基亚砜 (DMSO) 均购自美国Sigma公司。CCK-8试剂盒购自日本Dojindo公司。α-SMA一抗购英国Abcam公司。p-Akt(S473)、t-Akt一抗均购自美国Cell Signaling Technology公司。TRPV1一抗体购自美国Santa Cruz公司。GAPDH一抗、山羊抗兔的二抗均购自北京中杉金桥生物技术有限公司。 1.2 方法 1.2.1 原代VSMCs培养及鉴定 1.2.1.1 VSMCs的培养
应用组织贴块法取大鼠胸主动脉进行VSMCs原代培养。大鼠用戊巴比妥钠麻醉消毒后,迅速取出胸主动脉,剪开血管,刮去内膜,剪碎约1 mm×1 mm×1 mm大小,均匀贴在细胞培养瓶底,加入含有20%胎牛血清和1%双抗的DMEM培养液,培养4~10 d可见VSMCs爬出组织块,约2周可用胰酶细胞消化液传代。在倒置相差显微镜下观察细胞形态。取3~10代细胞用于实验。 1.2.1.2 VSMCs鉴定
取培养的第3代VSMCs,接种到预先放置有盖玻片的24孔板中培养,细胞贴壁过夜后,用4%的多聚甲醛固定30 min,PBS洗5min×3次;加入0.3%Triton X-100 打孔破膜15 min,PBS洗5 min×3次;山羊血清室温下封闭30 min;加入兔抗α-SMA一抗 (稀释浓度为1 ∶200),放入湿盒,4 ℃过夜。次日,PBS洗5 min×3次,加入驴抗兔荧光标记二抗 (稀释度为1 ∶200),37 ℃避光孵育1 h,PBS洗5 min×3次;Hochest33342室温避光染核5 min,PBS洗5 min×3次;封片用抗荧光淬灭封片剂,激光共聚焦显微镜下观察并拍照。 1.2.2 实验分组
将SHR大鼠、WKY大鼠来源的VSMCs分别命名为SHR-VSMCs、WKY-VSMCs。细 胞增殖实验:细胞分为对照组、辣椒素(TRPV1激动剂)浓 度梯度组 (0.1、1、10 μmol/L)、 辣椒素(1 μmol/L)+ iRTX组(TRPV1拮抗剂1 μmol//L),分别干预两种来源的细胞。对于第1个Western blot实验,细胞分为对照组、辣椒素组(1 μmol/L),分别干预两种来源细胞,对于第2个Western blot实验,细胞分对照组、辣椒素组 (1 μmol/L)、辣椒素(1 μmol/L)+iRTX组(1 μmol/L),分别干预两种来源的细胞。 1.2.3 CCK-8法检测细胞增殖
按照说明书操作,取对数生长期VSMCs,常规消化后制成细胞悬液,以每孔5 000个细胞接种至96孔板中,待细胞贴壁,换用无血清培养液饥饿细胞24 h后,分别加入不同浓度的辣椒素或者辣椒素+iRTX继续培养,每组设置3个复孔。培养24 h后,每孔加入10 μL CCK-8溶液,继续培养1 h后,用酶标仪测定各组样品的D(450)值。实验重复3次。 1.2.4 Western blot检测TRPV1、p-Akt、t-Akt蛋白表达
药物干预后收集细胞,常规方法提取细胞总蛋白,BCA法测定蛋白浓度。蛋白上样后行SDS-PAGE凝胶电泳,将蛋白转移到经甲醇激活的PVDF膜上,5%脱脂奶粉室温摇床封闭2 h,加入TRPV1、p-Akt、t-Akt、GAPDH一抗(稀释度分别为1 ∶500,1 ∶1 000,1 ∶1 000,1 ∶1 000),4 ℃孵育过夜。次日用TBST洗膜10 min×3次,用山羊抗兔的二抗(稀释度为1 ∶2 000)室温孵育2 h,再次用TBST洗膜10 min×3次,光化学发光,显影。LabWorks46软件分析蛋白条带灰度值。实验重复3次。 1.3 统计学分析
数据用x±s表示。使用SPSS 17.0统计软件。多组之间比较用单因素方差分析,2组间的比较用t检验。 2 结果 2.1 VSMCs鉴定
倒置相差显微镜下观察细胞从组织块周边爬出,为长梭形,放射性生长(图 1A)。细胞免疫荧光检测结果显示,α-SMA在细胞 质中丰富表达,证实原代培养 出来细胞的为VSMCs (图 1B、C),符合实验要求。
 |
| A:VSMCs原代培养第10天(×100);B:细胞免疫荧光鉴定WKY-VSMCs(×400);C:细胞免疫荧光鉴定SHR-VSMCs(×400)图 1 原代VSMCs培养及鉴定 |
Western blot结果显示:SHR-VSMCs对照组TRPV1蛋白相 对表达量较WKY-VSMCs对照组显著降低(0.32± 0.05 vs 0.55±0.11,P<';0.05);辣椒素干预两种来源的细胞后,TRPV1蛋白相对表达量(WKY-VSMCs:0.65±0.19,SHR-VSMCs:0.89±0.13)均较对照组显著升高(P<0.05,图 2)。
 |
| 1:WKY-VSMCs对照组;2:WKY-VSMCs辣椒素组(1 μmol/L);3:SHR-VSMCs对照组;4:SHR-VSMCs辣椒素组(1 μmol/L) 图 2 Western blot检测VSMCs中TRPV1蛋白表达 |
CCK-8实验结果显示:SHR-VSMCs对照组的D(450)值大于WKY-VSMCs对照组(P<0.05)。梯度浓度的TRPV1激动剂辣椒素(0.1、1、10 μmol/L)分别作用于培养的VSMCs,结果发现1、10 μmol/L辣椒素组的D(450)值均小于对照组(P<0.05)。辣椒素对WKY-VSMCs细胞增殖具有轻度的抑制作用,但 差异没有统计学意义(P>0.05)。在辣椒素(1 μmol/L)作用的同时,加用TRPV1拮抗剂iRTX(1 μmol/L),结果发现:对于SHR-VSMCs,1 μmol/L 辣椒素组的D(450)值小于1 μmol/L辣椒素+1 μmol/L iRTX组(P<0.05,图 3)。
 |
| 1:对照组;2~4组分别为辣椒素0.1、1、10 μmol/L组;5:辣椒素1 μmol/L+iRNX 1 μmol/L组;a:P<0.05,与WKY-VSMCs对照组比较;b:P<0.05,与SHR-VSMCs对照组比较;c:P<0.05,与辣椒素1 μmol/L组比较 图 3 CCK-8法检测TRPV1对VSMCs增殖的影响 |
Western blot结果显示:SHR-VSMCs对照中Akt磷酸化水平较WKY-VSMCs对照组显著升高(0.44±0.02 vs 0.29±0.09,P<0.05);应用辣椒素激活TRPV1受体后,发现Akt的磷酸化水平在WKY-VSMCs 和SHR-VSMCs中均显著降低(WKY-VSMCs:0.13±0.02,SHR-VSMCs: 0.23±0.03,P<0.05);而TRPV1拮抗剂iRTX(1 μmol/L)则显著拮抗辣椒素的作用,使得WKY-VSMCs、SHR-VSMCs中Akt的磷酸化 水平较各自的对照组升高(分别为0.37±0.07,0.43± 0.10,P<0.05,图 4)。
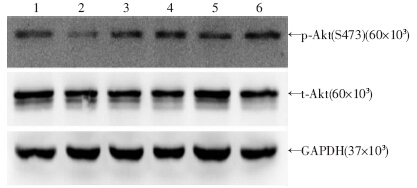 |
| 1:WKY-VSMCs对照组;2:WKY-VSMCs辣椒素1 μmol/L组;3:WKY-VSMCs辣椒素1 μmol/L+iRTX 1 μmol/L 组;4:SHR-VSMCs对照组;5:SHR-VSMCs辣椒素1 μmol/L组; 6:SHR-VSMCs辣椒素1 μmol/L+iRTX 1 μmol/L组图 4 Western blot检测VSMCs中p-Akt(S473)、t-Akt蛋白的表达 |
对于中小动脉而言,高血压引起的血管重构多以内向性和肥厚性重构为主,造成管壁增厚和管腔狭窄,直接影响组织器官的血液供应[8]。在此过程中,VSMCs增殖既是重要的始动因素,也是增厚管壁的最主要的原因。因此,抑制VSMCs异常增殖,对于防治高血压动脉重构具有重要的意义。抑制VSMCs增殖是近年来的研究热点,过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor gamma,PPAR-γ)、核受体相关因子(Nurr1)、miR-145等均显示对VSMCs增殖具有一定的抑制作用[9, 10, 11]。但是,目前仍需探索能够抑制VSMCs增殖的有效靶点。
TRPV1是TRPV亚家族中研究最多的一个,能被辣椒素高效激活,介导钙离子内流,从而使细胞内的钙离子浓度升高,参与疼痛、免疫和炎症、胃肠运动、咳嗽、血压调节、脂肪代谢、糖代谢、肿瘤、心肌肥厚和纤维化多种疾病的病理过程[3, 12, 13]。TRPV1在多种组织细胞中广泛表达。我们既往的研究发现TRPV1存在于脂肪前体细胞中,TRPV1受体活化可抑制细胞内成脂过程和成熟脂肪细胞的分化[14]。TRPV1在VSMCs中也有表达。研究发现辣椒素激活TRPV1可能通过上调ABCA1蛋白表达和下调LRP1蛋白表达,减少VSMCs内脂质沉积,减少高脂饮食小鼠主动脉中的动脉粥样斑块形成[4]。我们的前期研究发现辣椒素激活TRPV1通过诱导自噬减轻氧化低密度脂蛋白诱导的VSMCs泡沫化,进而减少动脉粥样硬化斑块形成[15]。Wang等[13]发现辣椒素激活TRPV1可抑制血管紧张素Ⅱ诱导的小鼠心肌成纤维细胞增殖,改善心肌纤维化,发挥心血管保护作用。该研究提示TRPV1对细胞增殖具有抑制作用。但目前TRPV1对于VSMCs增殖,尤其是高血压时的VSMCs增殖的作用尚不清楚。本项研究重点探讨TRPV1对高血压时的VSMCs增殖的影响及其分子机制。
本研究原代培养SHR和WKY来源的主动脉VSMCs,发现与对照组的WKY-VSMCs相比较,SHR-VSMCs的增殖能力显著升高,这与以往的研究报道相一致[9],提示慢性高血压可促进VSMCs的增殖能力,这可能是高血压诱导动脉重构的一个重要机制。蛋白定量检测发现TRPV1在2组VSMCs中均有丰富表达,且SHR来源的VSMCs中TRPV1的表达较WKY组显著降低,提示TRPV1不仅在VSMCs中表达,还可能参与了高血压时VSMCs功能改变的调控过程。应用TRPV1激动剂辣椒素可显著上调培养的VSMCs中TRPV1的表达,这为我们下一步的干预实验提供了条件。为了明确TRPV1在VSMCs增殖中的作用,本研究应用梯度浓度的辣椒素对培养的VSMCs进行干预。结果发现辣椒素可呈剂量依赖性地抑制SHR-VSMCs的增殖,但对WKY-VSMCs增殖的抑制作用并不显著;应用TRPV1拮抗剂iRTX可减弱辣椒素的抗增殖能力。上述结果提示,高血压导致的VSMCs增殖活跃可能与TRPV1的表达减少有关,TRPV1在VSMCs增殖过程中起到重要的调控作用,其表达上调可有效抑制高血压时的VSMCs增殖,这可能是TRPV1发挥其心血管保护作用的一个重要机制。
为了进一步探讨TRPV1调控VSMCs增殖的胞内信号机制,我们对磷脂酰肌醇-3-激酶/丝苏氨酸蛋白 激酶(phosphoinositide 3-kinase /serine-threonine kinase,PI3K/Akt) 通路的表达改变进行研究。PI3K/Akt信号通路是经典的参与调节细胞增殖、迁移、分化等的信号途径。大量研究发现PI3K/Akt在VSMCs增殖中发挥着重要作用。Choi等[16]发现,白皮杉醇通过PI3K/Akt信号通路抑制血小板衍生生长因子诱导的VSMCs增殖和迁移。我们以往的研究发现PPAR-γ通过抑制Akt磷酸化过程抑制SHR-VSMCs增殖、迁移和表型转化[10]。文献报道TRPV1同家族成员TRPV5/6能在正常的Ca2+浓度情况下降低Akt磷酸化水平,抑制IGF1R-PI3K-Akt信号通路,阻止细胞进入细胞周期进而抑制异常上皮细胞增殖[17]。Li等[18]的研究发现TRPV1拮抗剂AMG9810可促进表皮细胞中Akt的磷酸化并激活下游的mTOR信号途径,促进皮肤肿瘤生成。与前述研究类似,本研究发现,与WKY-VSMCs对照组比较,SHR-VSMCs对照组的Akt磷酸化水平升高,提示激活的Akt通路参与了高血压VSMCs的增殖过程;辣椒素激活TRPV1可显著降低SHR-VSMCs中 Akt的磷酸化水平,而应用TRPV1拮抗剂iRTX则拮抗辣椒素的作用,使得SHR-VSMCs中Akt的磷酸化水平升高。提示Akt信号通路参与了TRPV1抑制VSMCs 增殖的过程,TRPV1可能通过抑制Akt的磷酸化而抑制高血压时的VSMCs增殖。
综上所述,本研究发现高血压时的VSMCs的增殖活跃与TRPV1表达减少有关,应用辣椒素激活TRPV1可能通过抑制Akt信号通路而抑制高血压时的VSMCs增殖。本研究为进一步探讨TRPV1的心血管保护机制提供了思路,并提示TRPV1可能成为防治高血压血管重构的新的干预靶点。
| [1] | Owens G K, Kumar M S, Wamhoff B R. Molecular regulation of vascular smooth muscle cell differentiation in development and disease [J]. Physiol Rev, 2004, 84(3): 767-801. |
| [2] | Schiffrin E L. Vascular remodeling in hypertension: mechanisms and treatement [J]. Hypertension, 2012, 59(2): 367-374 . |
| [3] | Zhu Z, Luo Z, Ma S,et al. TRP channels and their implications in metabolic diseases [J]. Pflugers Arch, 2011, 461(2): 211-223. |
| [4] | Ma L, Zhong J, Zhao Z,et al. Activation of TRPV1 reduces vascular lipid accumulation and attenuates atherosclerosis [J]. Cardiovasc Res, 2011, 92(3): 504-513. |
| [5] | Yang D, Luo Z, Ma S,et al. Activation of TRPV1 by dietary capsaicin improves endothelium-dependent vasorelaxation and prevents hypertension [J]. Cell Metab, 2010, 12(2): 130-141 . |
| [6] | Huang W, Rubinstein J, Prieto A R,et al. Transient receptor potential vanilloid gene deletion exacerbates inflammation and atypical cardiac remodeling after myocardial infarction [J]. Hypertension, 2009, 53(2): 243-250. |
| [7] | Xu X, Wang P, Zhao Z,et al. Activation of transient receptor potential vanilloid 1 by dietary capsaicin delays the onset of stroke in stroke-prone spontaneously hypertensive rats [J]. Stroke, 2011, 42(11): 3245-3251. |
| [8] | Savoia C, Burger D, Nishigaki N,et al. Angiotensin II and the vascular phenotype in hypertension [J]. Expert Rev Mol Med, 2011, 13: e11. |
| [9] | 〖JP3〗Zhang L, Xie P, Wang J,et al. Impaired peroxisome proliferator-activated receptor-gamma contributes to phenotypic modulation of vascular smooth muscle cells during hypertension [J]. J Biol Chem, 2010, 285(18): 13666-13677. |
| [10] | 〖ZK(#〗Bonta P I, Pols T W, van-Tiel C M,et al. Nuclear receptor Nurr1 is expressed in and is associated with human restenosis and inhibits vascular lesion formation in mice involving inhibition of smooth muscle cell proliferation and inflammation [J]. Circulation, 2010, 121(18): 2023-2032. |
| [11] | 皮燕, 张莉莉, 胡子成, 等. miR-145表达状态对大鼠高血压动脉内膜增生的影响[J]. 第三军医大学学报, 2013, 35(8): 707-711. |
| [12] | 李魁君, 李春刚, 刘兴君. 辣椒素受体(TRPV1)的生物学作用及其作为药物靶点的研究进展[J]. 沈阳药科大学学报, 2011, 28(11): 917-927. |
| [13] | Wang Q, Ma S, Li D,et al. Dietary capsaicin ameliorates pressure overload-induced cardiac hypertrophy and fibrosis through the transient receptor potential vanilloid type 1[J]. Am J Hypertens, 2014, 27(12): 1521-1529. |
| [14] | Zhang L L, Yan-Liu D, Ma L Q,et al. Activation of transient receptor potential vanilloid type-1 channel prevents adipogenesis and obesity[J]. Circ Res, 2007, 100(7): 1063-1070. |
| [15] | Li B H, Yin Y W, Liu Y,et al. TRPV1 activation impedes foam cell formation by inducing autophagy in oxLDL-treated vascular smooth muscle cells[J]. Cell Death Dis, 2014, 5: e1182. |
| [16] | Choi K H, Kim J E, Song N R,et al. Phosphoinositide 3-kinase is a novel target of piceatannol for inhibiting PDGF-BB-induced proliferation and migration in human aortic smooth muscle cells [J]. Cardiovasc Res, 2010, 85(4): 836-844. |
| [17] | Dai W, Bai Y, Hebda L,et al. Calcium deficiency-induced and TRP channel-regulated IGF-PI3K-Akt signaling regulates abnormal epithelial cell proliferation [J]. Cell Death Differ, 2014, 21(4): 568-581. |
| [18] | Li S, Bode A M, Zhu F,et al. TRPV1-antagonist AMG9810 promotes mouse shin tumorigenesis through EGFR /Akt signaling [J]. Carcinogenesis, 2011, 32(5): 779-785. |



