强迫症(obsessive compulsive disorder,OCD)是一种在临床上较常见的精神心理疾病,发病率为2%~3%[1]。目前对于强迫症的发病机制还不是十分清楚,国外利用功能磁共振技术发现OCD患者可能存在皮层- 纹状体- 丘脑- 皮层(cortical - striatal- thalamic -cortical,CSTC)环路的功能异常,因而提出强迫症的发病与该环路的神经功能异常有关[2],然而对于OCD患者是否存在着脑结构的改变,目前的研究结果还不是十分一致[3] ,但有研究证实抗精神病药物治疗以及长期的病程可对OCD患者的脑结构或功能造成显著的影响[4]。本研究拟采用基于体素的形态学分析(voxel-based morphometry,VBM)技术观察未经药物治疗的强迫症患者的脑灰质结构改变,其结果有望更准确地描述疾病状态下脑形态学改变的真实状态,有助于临床医生加深对强迫症病因的了解,从而为诊治强迫症提供新的思路。
1 资料与方法 1.1 研究对象选取2010年9月至2012年3月到西南医院临床心理科就诊的强迫症患者21例,均为初次到医院就诊,之前未接受过任何相关的药物治疗。其中男性11例,女性10例,年龄17~43(25.3±6.9)岁,病程2~10(4.6±2.3)年。患者根据美国精神疾病诊断与统计手册第4版(DSM-Ⅳ)[5]和中国精神障碍分类与诊断标准第3版(CCMD-3)[6]诊断标准筛选入组;强迫症临床症状严重性利用耶鲁-布朗量表(Y-BOCS量表)来评估;强迫症患者抑郁和焦虑程度分别用汉密尔顿抑郁量表和汉密尔顿焦虑量表来评估。纳入标准为:符合强迫症的诊断标准;从未使用过任何精神类药物;Y-BOCS量表评分> 16分;右利手;知情同意后自愿参加本研究的强迫症患者。排除标准为:既往有其他精神病或神经系统病史;药物或酒精依赖病史;伴有严重躯体障碍而不能完成磁共振检查的患者;有磁共振检查禁忌证的患者。同时选取年龄、性别、受教育程度匹配的 21例健康志愿者作为正常对照组,其中男性11例,女性10例,年龄19~49(28.1±6.3)岁。本研究经第三军医大学西南医院医学伦理委员会批准,并获得所有受试者知情同意。
1.2 数据采集采用德国西门子公司生产的3.0 T超导磁共振扫描仪(TIM Trio),应用正交8通道头部线圈。首先行常规T1、T2序列扫描排除脑器质性病变,然后采用3D MP-RAGE序列进行结构磁共振扫描。成像参数如下:矢状位扫描;层数176层;TR=1900 ms;TE=2.52 ms;翻转角15°;FOV=256 mm×256 mm;层厚1 mm;矩阵=256×256;体素为1 mm×1 mm×1 mm。
1.3 数据处理数据预处理和分析采用运行于 Matlab 2010b环境下的SPM8软件包和VBM8工具包完成,主要处理步骤如下:①首先利用Segment功能将所有受试者的结构像分割成灰质、白质和脑脊液;②然后利用DARTEL功能,创建所有受试者的脑灰质模版:先对经过头动校正的个体脑结构MRI进行分割,得到灰质图像,然后将各受试个体灰质图像进行平均,得到灰质平均图像,再以平均图像作为初始模板;利用流场理论,将被试个体的灰质图像分别以模板进行配准,对配准的图像再进行平均,得到下一次迭代的模板;重复此过程,直到获得最优模板。③配准至MNI空间:将所有处理后的图像和制作的模板配准到MNI空间中,利用所得到的参数文件及前面获得的流场将个体映射到MNI空间中;④用6 mm的半高宽值对所有受试的灰质图像进行高斯平滑,接着运用SPM8建立统计模型和进行两组间的脑灰质体积比较;⑤最后利用REST软件提取存在差异区域的相对灰质体积来进行相关性分析。
1.4 统计学分析采用SPSS 18.0统计软件包,对两组间的年龄、受教育程度进行双样本t检验,性别分析用χ2检验。运用SPM8软件里的双样本t检验探索两组间的脑灰质体积的差异。统计结果运用FDR多重比较校正方法,以校正后P<0.05、相连体素(voxels)大于30个以上的团块(cluster)视为有统计学差异的脑区。
2 结果 2.1 两组基本临床资料比较本试验共有21例强迫症患者和21例健康志愿者完成了MRI检查,两组间在年龄、性别以及受教育程度上无统计学差异(P>0.05)。两组间的临床资料详见表 1。
| 项目 | 强迫症组 | 正常对照组 | P值 |
| 性别(男︰女) | 11∶10 | 11∶10 | 1 |
| 年龄(年) | 25.3±6.9 | 28.1±6.3 | 0.79 |
| 受教育程度(年) | 8.6±4.2 | 9.5±3.9 | 0.72 |
| 病程(年) | 4.6±2.3 | - | - |
| 耶鲁布朗量表评分 | 21.3±5.9 | - | - |
| 汉密尔顿抑郁评分 | 16.1±5.3 | - | - |
| 汉密尔顿焦虑评分 | 13.2±5.6 | - | - |
强迫症患者大脑灰质总体积为(652.83±65.21)× 103 mm3,正常对照大脑平均灰质总体积为(659.37±62.87)×103 mm3,两组间脑灰质总体积无统计学差异(P>0.05)。运用协方差分析,在排除了年龄和性别以及全脑体积等因素的影响后,强迫症患者右侧小脑、双侧眶额叶、前扣带回以及右侧丘脑的灰质体积明显低于正常对照组(P<0.05,经FDR校正)。见图 1,表 2。强迫症患者与正常对照者相比,未见灰质体积增加的脑区(P<0.05,经FDR校正)。相关性分析结果显示,强迫症患者左侧眶额叶的灰质体积与耶鲁布朗量表评分之间存在负相关(r=-0.63,P<0.01)。本研究同时表明,强迫症患者的灰质结构改变与汉密尔顿抑郁量表和汉密尔顿焦虑量表评分之间不存在相关性(r=0.24,P>0.05)。
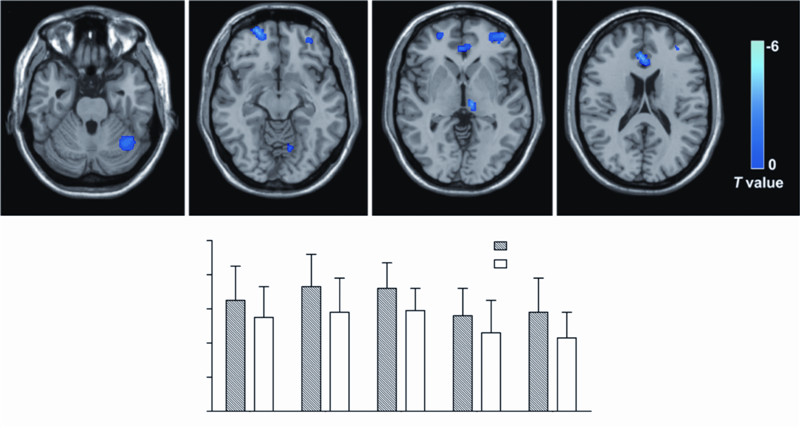 |
| 图像左侧代表患者真实的左侧;A:右侧小脑;B:双侧眶额叶、右侧小脑;C:双侧眶额叶前扣带回及右侧丘脑;D:前扣带回、右侧眶额叶;E:两组研究对象相对灰质体积比较 经FDR校正,P<0.05,与正常对照组比较图 1 脑灰质结构萎缩的区域及两组研究对象相对灰质体积比较 |
| 脑区 | 位置 | 灰质体素 | 相对灰质体积 | MNI 坐标 | t值 | ||
| x | y | z | |||||
| 小脑 | 右 | 46 | 0.58 | 23 | -83 | -40 | -4.13 |
| 眶额叶 | 左 | 65 | 0.59 | -18 | 60 | -4 | -4.65 |
| 眶额叶 | 右 | 93 | 0.61 | 30 | 41 | -11 | -5.37 |
| 前扣带回 | 左/右 | 51 | 0.51 | 4 | 43 | 10 | -5.53 |
| 丘脑 | 右 | 32 | 0.49 | 19 | -20 | -2 | -4.62 |
近年来,随着社会生活节奏的加快,强迫症的发病率呈逐渐上升趋势。病因较为复杂,临床表现多种多样。至今,研究者们已从神经生化、遗传学、心理学等多角度探讨OCD的成因,但是结论并不十分一致,其致病关键因素尚未能明确。目前对强迫症研究的经典理论模型是CSTC环路的结构和功能障碍[2],CSTC环路与大脑内众多神经结构存在广泛连接,该环路的异常目前认为与强迫症的一些临床症状有关,比如对认知和行为的抑制力减弱、受损的执行功能、过度的错误监测能力等[7, 8]。
本研究利用磁共振VBM结构分析技术,探查未用药的OCD患者脑灰质结构异常的区域,结果显示未用
药的OCD患者存在双侧眶额叶、前回以及右侧丘脑区域的灰质萎缩,这些差异脑区全部涉及到目前公认的强迫症神经环路,进一步证实了该环路的存在,也提示这些脑区功能异常可能在强迫症的病理机制中起到了重要的作用。在CSTC环路中,一些脑结构被认为是关键区域,比如眶额叶、前扣带回及丘脑等区域。眶额叶的功能目前认为与 决策的处理、情感以及认知行为的 控制有关[9]。眶额叶的功能异常可能导致了OCD患者过度评估外界行为所带来的危险,对自身行为 的抑制力减弱,从而导致反复出现的想法或行为。本研究发现OCD患者左侧眶额叶灰质体积与耶鲁-布朗量表评分呈负相关,说明左侧眶额叶萎缩越严重,患者的临床症状越严重,进一步证实了眶额叶在强迫症发病中的重要作用。前扣带回可以对正在进行的目标定向行为实施监控,在出现反应冲突或错误时提供信号,以便能及时调整与分配注意资源,因此可能是一个行为规划与执行的高级调控结构[10]。我们认为前扣带回结构的萎缩可能导致了强迫症患者监测功能的异常,从而可能导致了强迫症的一些临床症状,比如持续感受到外界行为的错误,导致自发产生的纠正外界错误或不完美事物的行为。丘脑作为一个大脑皮层与皮层下核团联系的重要中继结构,传导与处理大脑核团与皮层的交互信息。当丘脑结构异常时,可以放大外界行为或刺激带来的信息,使大脑皮层产生过度的应对反应[11]。
除了经典理论认为的OCD存在眶额叶-纹状体环路异常外,越来越多的相关学者报道了其他脑区的异常。Menzies等[2]通过Meta分析指出在研究OCD的发病机制时,后脑区的作用不容忽视。本研究发现了OCD患者存在着小脑的灰质结构异常。近年来有研究发现小脑除了运动功能之外,还参与了人脑的一些高级认知功能,例如注意力、语言学习和记忆、认知计 划和处理等[12]。文献[13, 14]报道OCD患者存在着认知 功能方面的异常,我们推测可能部分与本研究发现的小脑萎缩有关。虽然目前关于小脑异常在OCD发病机制中所起作用的研究还不多,结论也不一致,但是这些实验结论提示我们在探索OCD发生的具体病理生理学通路时,不能仅局限于公认的CSTC环路,其他脑区也可能起了不容忽视的作用。
尽管fMRI技术已发现了OCD患者多个脑区存在异常,但是这些研究结果却不十分一致。比如有的研究发现纹状体体积增加,有的研究发现纹状体体积减少,还有的研究却没有发现纹状体体积异常[3]。造成这些差异的部分原因可能是这些研究招募的OCD患者大多存在着长短不一的抗精神病药物治疗的病史,而国外有研究证实,抗精神病药物可以使患者之前萎缩的脑结构得到部分恢复[15]。因而本研究采用了未经药物治疗的强迫症患者,可以相对排除抗精神病药物治疗对强迫症真实发病机制造成的干扰。
总之,本研究采用神经影像学VBM的分析方法,初步探索了未服药强迫症患者与正常对照者相比脑灰质结构存在异常的区域。研究结果进一步证实了CSTC环路的结构异常在OCD发病中起着重要作用,同时还表明强迫症患者还存在着CSTC环路外的异常,与其他功能性脑影像研究资料相一致;后续研究拟根据疾病的亚型选择同质的样本,将功能和结构影像联合进一步探讨OCD的病理生理学特点,同时,追踪观察OCD 患者在治疗前后脑灰质结构的变化,得到对临床诊断和治疗评估更具真实意义的指标。
| [1] | Horwath E, Weissman M M. The epidemiology and cross-national presentation of obsessive-compulsive disorder[J]. Psychiatr Clin North Am, 2000, 23(3): 493-507. |
| [2] | Menzies L, Chamberlain S R, Laird A R, et al. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: the orbitofronto-striatal model revisited[J]. Neurosci Biobehav Rev, 2008, 32(3): 525-549. |
| [3] | Hou J, Song L, Zhang W, et al. Morphologic and functional connectivity alterations of corticostriatal and default mode network in treatment-naive patients with obsessive-compulsive disorder [J]. PLoS One, 2013, 8(12): e83931. |
| [4] | Hoexter M Q, de-Souza-Duran F L, D’Alcante C C, et al. Gray matter volumes in obsessive-compulsive disorder before and after fluoxetine or cognitive-behavior therapy: a randomized clinical trial[J]. Neuropsychopharmacology, 2012, 37(3): 734-745. |
| [5] | American Psychiatric Association. Diagnostic and statistical manual of mental disorder ( DSM-IV )[M]. Washington: American Psychiatric Association,1994. |
| [6] | 《中国精神障碍分类与诊断标准第3版(CCMD-3)》工作组. 中国精神障碍分类与诊断标准[M]. 3 版. 济南: 山东科学技术出版社, 2001: 9-168. |
| [7] | Van-den-Heuvel O A, Veltman D J, Groenewegen H J, et al. Frontal-striatal dysfunction during planning in obsessive-compulsive disorder[J]. Arch Gen Psychiatry, 2005, 62(3): 301-309. |
| [8] | Maltby N, Tolin D F, Worhunsky P, et al. Dysfunctional action monitoring hyperactivates frontal-striatal circuits in obsessive-compulsive disorder: an event-related fMRI study [J]. Neuroimage, 2005, 24(2): 495-503. |
| [9] | Murray E A, O'Doherty J P, Schoenbaum G. What we know and do not know about the functions of the orbitofrontal cortex after 20 years of cross-species studies [J]. J Neurosci, 2007, 27(31): 8166-8169. |
| [10] | Salgado-Pineda P, Landin-Romero R, Fakra E, et al. Structural abnormalities in schizophrenia: further evidence on the key role of the anterior cingulate cortex[J]. Neuropsychobiology, 2014, 69(1): 52-58. |
| [11] | Rotge J Y, Aouizerate B, Amestoy V, et al. The associative and limbic thalamus in the pathophysiology of obsessive-compulsive disorder: an experimental study in the monkey [J]. Transl Psychiatry, 2012, 2: e161. |
| [12] | Moberget T, Gullesen E H, Andersson S, et al. Generalized role for the cerebellum in encoding internal models: evidence from semantic processing [J]. J Neurosci, 2014, 34(8): 2871-2878. |
| [13] | Schirmbeck F, Rausch F, Englisch S, et al. Stable cognitive deficits in schizophrenia patients with comorbid obsessive-compulsive symptoms: a 12-month longitudinal study [J]. Schizophr Bull, 2013, 39(6): 1261-1271. |
| [14] | Kikul J, Van-Allen T S, Exner C. Underlying mechanisms of verbal memory deficits in obsessive-compulsive disorder and major depression—the role of cognitive self-consciousness [J]. J Behav Ther Exp Psychiatry, 2012, 43(3): 863-870. |
| [15] | Csigo K, Harsanyi A, Demeter G, et al. Long-term follow-up of patients with obsessive-compulsive disorder treated by anterior capsulotomy: a neuropsychological study [J]. J Affect Disord, 2010,126(1/2): 198-205. |



