2.基础医学部全军免疫学研究所;
3.400013 重庆,重庆市妇幼保健医院妇产科;
2.Institute of Immunology, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038;
3.Department of Obsterics and Gynecology, Maternal and Child Health Hospital, Chongqing, 400013, China;
压力性尿失禁(stress urinary incontinence,SUI)的发病机制主要与尿道内平滑肌和横纹肌的减少有关。临床上治疗SUI的最佳治疗手段是运用组织替代物进行盆底修复[1],目前用于盆底修复的组织工程支架包括合成聚合物、天然细胞外基质、脱细胞基质衍生物三大类。脱细胞基质衍生物因其组织完整性好,免疫原性低等优点被广泛运用于膀胱壁的修补和皮肤、气管的重建[2, 3, 4]。猪膀胱细胞外基质(urinary bladder matrix,UBM)属脱细胞基质衍生物的一种,近年来逐渐被运用于盆底修复[5]。但是目前无法有效控制UBM的降解周期,单纯的靠增加植入的UBM材料来缓解降解周期的方法只会导致严重的免疫排斥反应,造成手术失败。临床上一直对种子细胞——骨髓间充 质干细胞(bone marrow mesenchymal stem cells,BMSCs) 寄予厚望,然而BMSCs向平滑肌分化的机制研究不足,以至于临床运用欠佳。众多研究发现UBM的基底层中含有Laminin蛋白[6],而Laminin蛋白具有促进多种成体干细胞等细胞增殖并向其他细胞分化的能力[7, 8, 9]。但在UBM材料Laminin蛋白是否具有诱导BMSCs向平滑肌细胞分化增殖的能力尚不清楚。本研究旨在对现有的UBM材料进行完善,使其具有诱导BMSCs向植入部位分化的能力,从而达到组织修复的目的。
1 材料与方法 1.1 实验动物3~4周龄雌性清洁级SD大白鼠10只,体质量约120 g。封闭饲养猪(体质量约200 kg),取处死30 min以内猪的新鲜膀胱,保存于4 ℃磷酸盐缓冲液内,实验动物由第三军医大学实验动物中心提供。
1.2 试剂与仪器三羟甲基氨基甲烷(Tris),苯甲基磺酰氟(PMSF),十二烷基硫酸钠(SDS),DNA 酶及RNA 酶(北京鼎国生物技术有限公司),DMEM-F12、双抗、胰酶购于HyClone 公司,DAPI、CCK-8试剂盒购于碧云天公司,胎牛血清( FBS ) 购于Gbico公司,FITC标记的小鼠抗大鼠CD29、CD31和CD34抗体购于Santa Cruze公司,兔抗猪Laminin抗体、兔抗鼠α-SMA抗体购于Abcam公司,Laminin蛋白购于Sigma公司,PBS 缓冲液(中杉金桥公司);冻干机,60COγ辐照仪,流式细胞仪,CO2培养箱,CK2 型倒置相差显微镜,Bio-Rad 680 XR 型酶标仪等。
1.3 脱细胞材料UBM的制备①机械分离:参照Freytes法[10],用PBS清净膀胱中残留尿,将膀胱内装满1.0 mmol/L的氯化钠,用机械分离法去除脂肪组织:浆膜层以及肌肉层,其余残留的黏膜层及固有鞘膜即UBM。②脱细胞,去污迹法,将分离下来的组织浸泡于含 0.035 mmol/L PMSF 的50 mmol/L Tris(pH=8.0)缓冲液中,室温下反复浸泡8次,每次12 h。酶消化,将上述处理后组织经PBS洗涤后置入含DNA酶及RNA酶的双酶消化液中,浸泡处理2次,每次12 h;使用PBS漂洗后,置入含1%SDS的TRIS缓冲液,室温反复浸泡处理4次,每次12 h。取出后用大量PBS缓冲液 充分漂洗4次,每12小时更换1次。③冻干及消毒处理:上述处理后的膀胱已经成为脱细胞基质,取出后程序性降温至-80 ℃,16 h,再置于冷冻机干燥(第三军医大学药学院),60COγ射线照射灭菌(第三军医大学辐照中心),4 ℃无菌保存备用。
1.4 组织形态学观察取成品脱细胞材料用4%多聚甲醛固定、石蜡包埋、切片(4 μm),分别用HE及 Masson染色后光学显微镜下观察。另一组材料用体积分数为2.5%戊二醛和1%锇酸固定,梯度酒精逐级脱水,置换,临界干燥后喷金,扫描电镜学观察其脱细胞情况和纤维排列情况。
1.5 大鼠BMSCs的分离、培养及鉴定大鼠BMSCs分离、培养采用全骨髓贴壁法,具体如下:颈椎脱臼法处死大鼠,无菌操作下取双侧胫骨、股骨,用DMEM-F12培养液反复冲洗骨髓腔,1 000 r/min离心10 min,弃上清液,用密度梯度离心法收集白色雾状细胞层,用含10%胎牛血清、100 U/mL链霉素和青霉素的DMEM-F12培养液重悬,并接种于培养瓶,置37 ℃的5% CO2培养箱中培养。24 h后首次换液,隔天换液,细胞接近80%~ 90%融合时按1 ∶2~1 ∶3 传代。应用流式细胞仪对BMSCs的表面分子CD29、CD31、CD34进行鉴定。本实验主要使用第3代细胞。
1.6 UBM+laminin及UBM+Anti-laminin的制备根据Lindner等方法[9, 11]将UBM材料剪成直径约1.6 cm大小,置入24孔板内,加入75%的乙醇1 mL,置于超净工作台上待乙醇自然彻底挥发。加灭菌PBS 2 mL浸泡洗涤2次,每次2 h。将Laminin蛋白及Anti-Laminin抗体分别用PBS溶液配制成终浓度30 μg/mL 的溶液,每孔加入2 mL Laminin蛋白溶液或Anti-Laminin溶液,无菌密封后,置于4 ℃冰箱,孵育12 h。
1.7 免疫组化观察UBM材料上Laminin表达取成品脱细胞材料(UBM、UBM+Laminin及UBM+ Anti-Laminin)用4%多聚甲醛固定,石蜡包埋、切片(8 μm)。常规脱蜡水化,PBS漂洗后3%过氧化氢溶液室温孵育20 min,PBS漂洗后柠檬酸组织抗原修复液高压修复,待自然冷却后加兔非免疫血清(S-P试剂盒)孵育10 min,除去血清,每张玻片加50 μL兔抗猪Laminin抗体(1 ∶25稀释),置湿盒4 ℃过夜,PBS漂洗3次,每次5 min,加二抗孵育10 min,链霉素抗过氧化物酶溶液孵育10 min,DAB溶液显微镜下显色,苏木精复染,梯度酒精脱水,二甲苯透明,封片后光学显微镜观察。
1.8 BMSCs负载UBM材料上将预处理的3组材料置于24孔板中,取第3代BMSCs按1×105/cm2接种于不同支架上,对照组为单纯UBM材料。每组加1 mL细胞培养液,置于37 ℃、5%CO2及饱和湿度下培养,隔日换液,并观察培养液有无浑浊。分别取培养3、5、7、14 d的组织行HE染色,观察细胞迁移情况。并取14 d的组织行免疫组化染色,观察干细胞向平滑肌细胞分化情况。
1.9 CCK-8法检测BMSCs在材料上的增殖将预处理的3组材料平铺于96孔板,取第3代BMSCs,按3×103/孔接种于96孔板,空白对照组为单纯UBM材料,每孔加120 μL的细胞培养液,每组5孔,置于37 ℃、5%CO2及饱和湿度下培养,隔日换液,并观察培养液有无浑浊。分别取培养1、3、5、7、9、12、14 d的组织行CCK-8检测(在450 nm波长测光密度值)。
1.10 统计学分析应用SPSS 17.0统计软件,计量资料以x±s表示,组间比较采用单因素方差分析和t检验。
2 结果 2.1 猪膀胱细胞外基质组织结构和显微形态学观察HE染色观察 UBM由质地均匀的基质和细丝状的胶原纤维构成(图 1A),Masson染色可见UBM胶原结构完整(图 1B)。扫描电镜显示UBM的胶原构成多个三维立体的孔隙,有利于细胞的黏附(图 2)。均未发现蓝色核染样结构,表明脱细胞处理彻底。
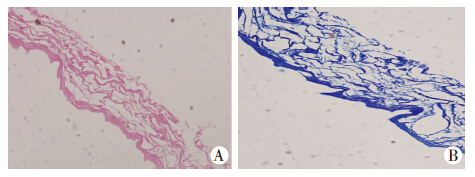 |
| 图 1 HE(A)和Masson(B)染色观察UBM组织结构 (×200) |
 |
| A:×500;B×1 000;C:×4 000 图 2 扫描电镜观察UBM组织超微结构 |
倒置显微镜下观察可见原代分离的大鼠BMSCs呈针尖样贴壁生长,培养7~8 d细胞达90%融合,细胞呈多克隆、旋涡状生长(图 3A)。传代BMSCs呈较均一的长梭型,分布均匀,增殖旺盛( 图 3B)。流式细胞仪检测显示,BMSCs稳定表达中胚层来源细胞的CD29 分子,阳性率为98%,内皮细胞的特征性表型分子CD31及造血干细胞系的特征性分子CD34表达阴性,阳性率分别为4.56%和3.30%( 图 3C),符合间充质干细胞的特征。
 |
| A: 倒置显微镜下观察BMSCs P0代 (×100); B: 倒置显微镜下观察BMSCs P3代(×100);C~E:分别为流式细胞仪检测BMSCs CD29、CD31、CD24表达 图 3 BMSCs的鉴定 |
3组材料上Laminin蛋白均表达阳性,单纯UBM组基底层的黏膜面可见不连续的线状染色(图 4A),UBM+Laminin组相比其他2组基底层黏膜面线条增粗,且染色加深(图 4B)UBM+Anti-Laminin组黏膜面线条染色减弱,仍可见部分染色阳性的血管腔样结构 (图 4C)。Laminin蛋白可以复合到UBM材料上,UBM材料表面的部分Laminin可以被抗体封闭。
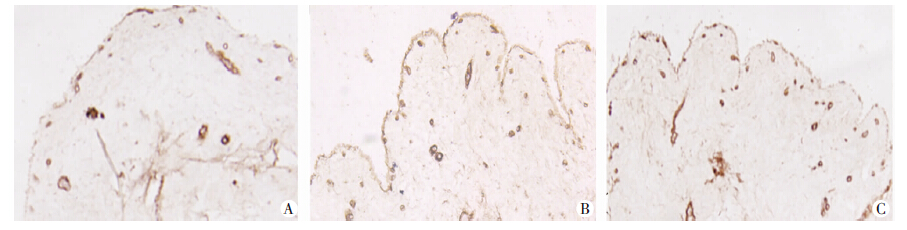 |
| A:脱细胞UBM; B:UBM+Laminin; C: LBM+Anti-Laminin 图 4 免疫组化观察3组材料上Laminin蛋白表达 (S-P ×100) |
CCK-8法检测表明3组材料上BMSCs细胞生长曲线变化趋势类似(图 5),在培养7 d内,细胞增殖不明显,处于潜伏适应期,培养7~9 d,BMSCs细胞进入对数生长期,9 d以后达到平台期。培养7 d以后,3组的增殖速度出现差异,与UBM组比较,UBM+Laminin组对BMSCs细胞增殖有显著促进作用(P<0.01),而UBM+Anti-Laminin组与UBM组比较差异无统计学意义(P>0.05)。
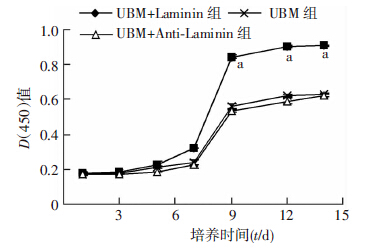 |
| a: P<0.01,与UBM组比较 图 5 CCK-8法检测3组材料上BMSCs细胞增殖 |
BMSCs负载支架上培养第3天,所有支架表面均有细胞生长,而UBM+Laminin组有多层细胞附着,并且随着接种时间的延长,明显见细胞向深层迁移,于第14天可到达基底层顶端,细胞与基底膜融合,细胞核拉伸延长;UBM组绝大部分BMSCs依旧聚集在UBM内部,尚未达基底层顶端。但在UBM+Anti-Laminin组绝大部分BMSCs依旧附着在材料表面,仅有少数细胞迁移至材料内部(图 6)。
 |
| 图 6 HE染色观察3组材料上负载BMSCs迁移 (×200) |
接种14 d的组织行α-SMA免疫组化检测发现,UBM+Laminin组平滑肌标志性蛋白α-SMA表达呈明显阳性,单纯UBM组α-SMA表达呈弱阳性,UBM+Anti-Laminin组α-SMA表达阴性(图 7)。
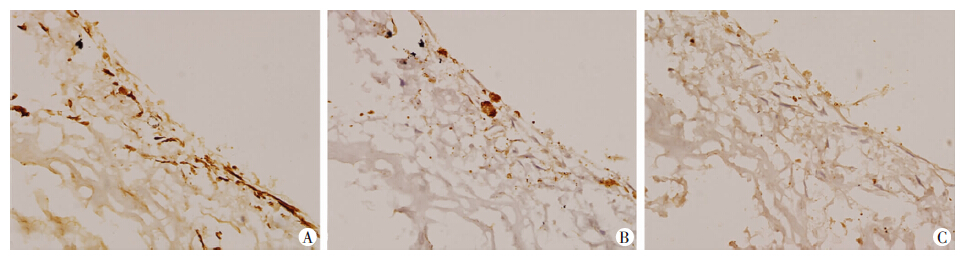 |
| A:UBM+Laminin组α-SMA染色阳性的BMSCs; B:UBM组α-SMA染色弱阳性的BMSCs;C:UBM+Anti-Laminin组α-SMA染色阴性的BMSCs 图 7 免疫组化染色检测BMSCs接种第14天3组材料上α-SMA的表达 (S-P ×200) |
SUI是一个普遍的社会和卫生问题,其发病率较高,严重影响患者家庭和生活质量[12]。研究表明其病因与尿道内平滑肌和横纹肌的减少有关[13],目前针对该类疾病的治疗中,生物类材料具有诱人的前景。猪膀胱脱细胞基质易于获得和处理,保留了较多生物活性因子,如:黏附分子、层粘连蛋白(Laminin)等[6],并具有一定的力学性能和较好的组织相容性[5],是目前研究的热点。BMSCs具有增殖和多项分化潜能[14],被寄予希望在盆底功能修复和尿失禁治疗中担负重要角色,然而其向平滑肌方向分化的机制研究尚不足,以至于临床运用效果欠佳。
Laminin蛋白是构成细胞外基质的主要成分之一,近年来多项在器官发育领域的研究报道了Laminin蛋白能诱导胚胎干细胞及神经干细胞等多种成体干细胞定向分化[7, 8]。同时体外研究发现Laminin蛋白具有促进骨髓间充质干细胞增殖[11],并且诱导其向成骨细胞等方向分化的能力[15]。但它对参与盆底修复的BMSCs的作用却尚不清楚。
本研究通过机械分离、酶消化、冻干及消毒获得成品UBM材料,脱细胞处理干净,胶原纤维保留完整,符合实验要求,且免疫组化发现在UBM的基底层有Laminin蛋白的表达,验证了Brown等[6]的报道。随后使用共孵育法将Laminin蛋白与UBM制成Laminin复合支架,同时用抗Laminin单克隆抗体成功封闭UBM材料浅层Laminin蛋白做对照实验组。用CCK-8检测并绘制出细胞生长曲线图,发现细胞在接种第9天后UBM+Laminin支架组增殖率明显高于其余2组,并且差异有统计学意义(P<0.01)。再者我们发现UBM+Anti-Laminin组细胞绝大多数仅在表面生长,未见明
显细胞向深层迁移,并且总体细胞密度低于UBM+Laminin组及UBM组。类似的实验结果在Badylak及Soiderer等[16]的报道中也能看到。有报道UBM的基底层面中含有层粘连蛋白(Laminin)、胶原蛋白、串珠素等结构蛋白,这些蛋白与相应受体结合,来调节细胞生长、迁移和分化,在组织工程运用中起重要作用[17]。 Laminin蛋白通过其LG功能域[18]与干细胞的受体-integrin a6β1[19]结合,从而诱导干细胞定向分化。而本实验结果进一步明确了Laminin蛋白可以促进BMSCs的生长、增殖以及向材料深部迁移的作用。
新型生物材料在解决排斥反应的基础上,若能诱导潜能干细胞定向分化为修复部位细胞,则是解决问题的关键。因此,我们更进一步检测了共培养第14天材料上平滑肌标志性蛋白α-SMA的表达,结果显示在UBM+Laminin组细胞胞核染色呈明显阳性,UBM组个别细胞检测阳性,而抗体封闭组检测阴性。这表明UBM+Laminin上BMSCs已有部分细胞向平滑肌细胞分化,表达平滑肌细胞标志物,所以我们认为Laminin也具有诱导BMSCs向平滑肌方向分化的能力。
综上,本研究结果表明UBM材料上的Laminin蛋白具有促进负载BMSCs增殖、迁移并向平滑肌分化的能力。为尝试运用Laminin复合UBM支架作为新型盆底修复材料提供了理论依据,为治疗压力性尿失禁提供了诱人前景。本研究存在的不足之处在于仅体外研究了UBM上Laminin蛋白对骨髓间充质干细胞生长的影响,下一步可将支架植入体内,观察骨髓间充质干细胞在植入部位迁移及分化情况,在体内进一步验证UBM上Laminin蛋白对骨髓间充质干细胞生长的影响,如结果与本实验结果一致,可考虑将此法进一步应用到临床试验。
| [1] | Kim C H, Kim T B, Oh J K, et al. Modified distal urethral polypropylene sling (canal transobturator tape) procedure: efficacy for persistent stress urinary incontinence after a conventional midurethral sling procedure[J]. Int Neurourol, 2013, 17(1): 18-23. |
| [2] | Agrawal V, Brown B N, Beattie A J, et al. Evidence of innervation following extracellular matrix scaffold-mediated remodelling of muscular tissues[J]. J Tissue Eng Regen Med, 2009, 3(8): 590-600. |
| [3] | Boruch A V, Nieponice A, Qureshi I R, et al. Constructive remodeling of biologic scaffolds is dependent on early exposure to physiologic bladder filling in a canine partial cystectomy model[J]. J Surg Res, 2010, 161(2): 217-225. |
| [4] | Parekh A, Mantle B, Banks J, et al. Repair of the tympanic membrane with urinary bladder matrix[J]. Laryngoscope, 2009, 119(6): 1206-1213. |
| [5] | Liu L, Li D, Wang Y, et al. Evaluation of the biocompatibility and mechanical properties of xenogeneic (porcine) extracellular matrix (ECM) scaffold for pelvic reconstruction[J]. Int Urogynecol J, 2010, 22(2): 221-227. |
| [6] | Brown B, Lindberg K, Reing J, et al. The basement membrane component of biologic scaffolds derived from extracellular matrix[J]. Tissue Eng, 2006, 12(3): 519-526. |
| [7] | Howard C, Murray P E, Namerow K N. Dental pulp stem cell migration[J]. J Endod, 2010, 36(12): 1963-1966. |
| [8] | Stabenfeldt S E, Munglani G, Garcia A J, et al. Biomimetic microenvironment modulates neural stem cell survival, migration, and differentiation [J]. Tissue Eng Part A, 2010, 16(12): 3747-3758. |
| [9] | Lindner U, Kramer J, Behrends J, et al. Improved proliferation and differentiation capacity of human mesenchymal stromal cells cultured with basement-membrane extracellular matrix proteins [J]. Cytotherapy, 2010, 12(8): 992-1005. |
| [10] | Freytes D O, Badylak S F, Webster T J, et al. Biaxial strength of multilaminated extracellular matrix scaffolds[J]. Biomaterials, 2004, 25(12): 2353-2361. |
| [11] | Matsubara T, Tsutsumi S, Pan H, et al. A new technique to expand human mesenchymal stem cells using basement membrane extracellular matrix[J]. Biochem Biophys Res Commun, 2004, 313(3): 503-508. |
| [12] | Minassian V A, Drutz H P, Al-Badr A. Urinary incontinence as a worldwide problem[J]. Int J Gynaecol Obstet, 2003, 82(3): 327-338. |
| [13] | Fatton B. Urinary incontinence and menopause epidemiological data[J]. Pelvic Perineologie, 2007, 2(2): 149-155. |
| [14] | McCarty R C, Gronthos S, Zannettino C, et al. Characterisation and developmental potential of ovine bone marrow derived mesenchymal stem cells[J]. J Cell Phyiol, 2009, 219(2): 324-333. |
| [15] | 刘印, 詹智, 田京. 纤维蛋白原与层黏连蛋白对兔骨髓间充质干细胞在PEGDA支架中成骨作用的影响[J]. 中国医学科学院学报, 2013, 35(3): 265-269. |
| [16] | Soiderer E E, Lantz G C, Kazacos E A, et al. Morphologic study of three collagen materials for body wall repair[J]. J Surg Res, 2004, 118(2): 161-175. |
| [17] | Wilschut K J, Haagsman H P, Roelen B A. Extracellular matrix components direct porcine muscle stem cell behavior[J]. Exp Cell Res, 2010, 316(3): 341-352. |
| [18] | Susman S, Soritau O, Rus-Ciuca D, et al. Placental stem cell differentiation into islets of Langerhans-like glucagon-secreting cells[J]. Rom J Morphol Embryol, 2010, 51(4): 733-738. |
| [19] | Carrion B, Kong Y P, Kaigler D, et al. Bone marrow-derived mesenchymal stem cells enhance angiogenesis via their α6β1 integrin receptor[J]. Exp Cell Res, 2013, 319(19): 2964-2976. |



