胶质瘤作为颅内最常见的肿瘤,约占颅内肿瘤的35%~50%[1]。尽管目前胶质瘤的治疗方式包括有手术、放疗及化疗在内的多种手段,但仍是颅内肿瘤中治愈率最低的肿瘤[2]。据研究,超过50%的高度恶性胶质瘤患者会在术后1年内复发,究其原因,主要是胶质瘤细胞对放化疗的高度抵抗性[3, 4]。为解决这一科学难题,研究者着手研究术后高压氧联合放化疗对胶质瘤患者生存率的影响。传统观点认为高压氧可以增加氧弥散量及弥散距离,使得肿瘤内血液氧浓度提高,进而促进肿瘤快速生长。然而,最新研究发现术后高压氧联合放化疗可以明显增强放化疗的敏感性并显著延长患者生存期[5],而这些研究成果是建立在肿瘤内部的缺氧微环境[6]。缺氧微环境下的肿瘤细胞可以通过自身改变来适应外部环境进而成为肿瘤复发及治疗失败的根本原因[7]。关于缺氧,最新研究证实缺氧微环境可以促进肿瘤干细胞干性持续,进而增强肿瘤恶性[8]。为了更进一步了解缺氧微环境对胶质瘤患者的影响,我们拟采用小鼠胶质瘤成瘤模型,通过体外缺氧模拟肿瘤内缺氧微环境来探讨缺氧对小鼠肿瘤形成及生存期的影响。
1 材料与方法 1.1 实验材料实验所用GL261胶质瘤细胞系由第三军医大学西南医院高压氧实验室赠送。DMEM/F12培养基、0.25% 胰蛋白酶(100 mL)和胎牛血清均购于美国HyClone公司。脑立体定位仪[精度(0.10±0.01)mm] 由深圳瑞沃德生命科技有限公司提供。5 μL微量注射器购自宁波镇海玻璃仪器厂。Luc慢病毒由第三军医大学西南医院高压氧实验室赠送, 慢病毒基因序列:上游5′-GAAGATCTCACCATGGAAGACGCCAA-3′, 下游:5′-GCGTCGAC TTACACGGCGATCTTTCCGC-3′。活体成像底物D-虫荧光素钾盐购自北京泛博生物化学科技有限公司。
1.2 实验动物清洁健康级雌性6周龄C57小鼠45只,体质量(17.5±2.3)g,购自第三军医大学西南医院实验动物中心,自由进食、饮水。荷瘤后小鼠通过SPSS 17.0统计软件随机分为缺氧及常氧饲养2组。常氧饲养条件:21%O2,5%CO2,74%N2;缺氧饲养条件:10%O2,5%CO2,85%N2;缺氧饲养采用12/12 h昼夜循环方式,缺氧时间具体为:早8:00-晚20:00。
1.3 实验方法 1.3.1 细胞培养GL261胶质瘤细胞系置于完全培养基(DMEM/F12+10%FBS+100 U/mL 青霉素+100 μg/mL链霉素,pH=7.2)中,于37 ℃,5%CO2恒 温孵箱内培养。每日于倒置相差显微镜(奥林巴斯I× 71)下观察细胞密度及形态改变,待细胞密度80%时予细胞传代,取对数生长期细胞行相关实验处理。
1.3.2 GL261-Luc细胞制备及活性检测GL261细胞按每孔2×105接种到6孔板内培养,待细胞密度60%~70%时,换液并加入Luc慢病毒液(MOI=50),继续培养2 d后换成筛选培养基(内含Blasticidin,终浓度5 μg/mL)。以后每天细胞用筛选培养基换液,筛选14 d后镜下见大量死细胞,移除死亡细胞并将剩下活细胞行单克隆生长。每日观察细胞生长状况,每隔3~4 d传一次代。培养1周后,检测GL261-Luc荧光素酶活性。
1.3.3 小鼠GL261-Luc胶质瘤颅内种植5%的水合氯醛腹腔内注射麻醉小鼠(0.7 mL/100 g),然后予立体定位仪上俯卧位固定。75%酒精消毒后剪开小鼠头部中部皮肤,长约1 cm,显示前囟及矢状缝。前囟外后0.15 mm,往右2 mm处行颅骨转孔。用微量注射器抽取GL261-Luc单细胞悬液5 μL(共计104细胞),然后沿针孔垂直缓慢进针,进针深度4 mm,后退1 mm,重复该步骤10次后缓慢注射荷瘤细胞,速度1 μL/min。 细胞颅内注射并维持5 min后缓慢退出微量注射器样针,75%酒精消毒伤口,骨蜡骨孔封闭,缝合头皮切口。由于麻醉意外死亡小鼠3只,剩余42只小鼠通过SPSS 17.0统计软件随机分为2组:常氧饲养组和低氧饲养组,每组21只,其中6只用于活体成像观察肿瘤形成,另外15只用于小鼠生存期观察,时限30 d。
1.3.4 小鼠活体成像分别于荷瘤7、14、21 d后行活体成像观察肿瘤形成。异氟烷气体麻醉动物,每只腹腔注射200 μL活体成像底物D-虫荧光素钾盐(15 mg/kg),注射15 min后开始NightOWL Macro显像系统 (LB983 NC320,Berthold Technologies,Germany)图像采集。依据活体成像活细胞“GL261-Luc-底物”氧化反应发光原理,图像中有荧光者记为肿瘤形成,无荧光者记为无肿瘤形成[9]。根据颅内荷瘤细胞病毒活性强度,通过NightOWL Macro分析软件计算并得到肿瘤体积。
1.3.5 小鼠肿瘤大体标本取材、HE染色及GFAP胶质瘤鉴定尸检全部死亡小鼠。对于所有30 d仍存活小鼠予麻醉处死后再行解剖。剪开小鼠颈部中部皮肤,沿头皮中线剪开皮肤及肌肉层,轻轻打开颅顶骨,取出脑组织,观察有无肿瘤形成。脑组织固定于4%多聚甲醛内,常规石蜡包埋后切片,片厚5 μm,脱蜡后行HE染色及免疫组化GFAP胶质瘤鉴定。
1.3.6 小鼠生存期分析及计入标准以成功颅内荷瘤后麻醉苏醒作为生存期计入起点,每日观察小鼠有无偏瘫、走路不稳、体质量消瘦、食欲下降等异常症状,待出现上述相关症状后密切观察小鼠生存情况,小鼠死亡后记下时间值作为生存期观察终点。小鼠死亡前期出现偏瘫、走路不稳两者之一症状且经解剖及HE染色验证有肿瘤形成者计为肿瘤所致小鼠死亡;小鼠死亡但解剖或HE验证无肿瘤形成者考虑为缺氧致小鼠死亡,不计入生存期观察。
1.4 统计学分析数据以x±s表示,采用SPSS 17.0统计软件分析。 不同组活体成像肿瘤体积比较采用配对样本t 检验;生存率分析采用单因素方差分析,生存曲线采用 Kaplan-Meier法,并用Log-rank Test对各组生存曲线予以调整并进行比较。
2 结果 2.1 GL261及GL261-Luc胶质瘤细胞培养Luc慢病毒转染成功后细胞培养3代,于倒置相差显微镜下(奥林巴斯I×71)观察细胞形态,GL261-Luc胶质瘤细胞与GL261细胞形态相似,均贴壁生长,呈长梭形。细胞生长状态好,无明显悬浮死细胞。检测荧光素酶活性示该病毒活性大于3×105,可以作为荷瘤细胞行小鼠颅内种植(图 1)。
 |
| A: GL261胶质瘤细胞; B: GL261-Luc胶质瘤细胞 图 1 GL261及GL261-Luc胶质瘤细胞形态学观察(奥林巴斯I×71) |
C57小鼠分别荷瘤7、14、21 d后,予活体成像观察肿瘤形成。根据荧光强度肉眼可见分别缺氧、常氧饲养7 d后均无肿瘤形成;14 d后缺氧饲养组有肿瘤形成,常氧饲养组无肿瘤形成;21 d后缺氧饲养组肿瘤体积进一步增大,常氧饲养组仍未形成肿瘤。通过NightOWL Macro分析软件得到肿瘤体积,经统计学分析,差异具有统计学意义(P<0.05),表明与常氧相比,缺氧饲养可以加快肿瘤形成(图 2)。
 |
| A:常氧-缺氧组活体成像 ↑示肿瘤部位; B:常氧-缺氧组肿瘤体积统计分析(n=6,x±s,a:P<0.05,与21%O2比较) 图 2 荷瘤小鼠条件饲养后活体成像及肿瘤体积统计分析 |
缺氧饲养组于荷瘤后1 d死亡小鼠1只,考虑急 性缺氧所致,不计入生存期观察;其余14只死亡第1只 小鼠为荷瘤后11 d,最后1只死亡时间为荷瘤后27 d,根据生存期计入标准,共有12只小鼠计为肿瘤致死。经GraphPad Prism 5计算后得缺氧组小鼠平均生存期22.5 d。常氧饲养组仅在荷瘤后23 d死亡小鼠1只,解剖后可见肿瘤,计入生存期观察组,其余小鼠饲养30 d未死亡。经Kaplan-Meier法生存率分析,并用Log-rank Test对各组生存曲线予以调整后比较得P<0.01,具有统计学意义,表明缺氧饲养组小鼠生存率低于常氧组(图 3)。
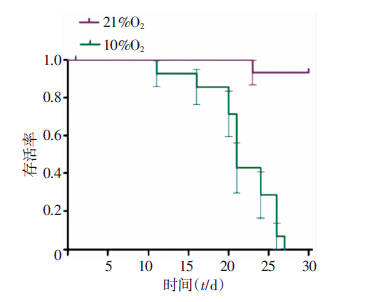 |
| 图 3 不同饲养组荷瘤鼠生存曲线 (n=15,x±s) |
大体观察及HE染色可见缺氧饲养组21只小鼠中有18只(活体成像组6只,生存分析组12只)有肿瘤形成,位于额顶叶,边界不清,浸润样生长,正常脑组织未明显受压,中线结构无移位。常氧饲养组仅2只有肿瘤形成。免疫组化GFAP鉴定示肿瘤内高表达,证明该肿瘤为胶质瘤(图 4)。
 |
| A-B:常氧脑组织:A:脑组织标本;B:脑内HE(无肿瘤形成);C-E:低氧脑组织:C 脑组织标本;D:脑内HE(有肿瘤形成);E:组化GFAP鉴定 ↑:示肿瘤部位 图 4 GL261荷瘤C57小鼠脑标本、HE染色及免疫组化鉴定 |
作为颅内恶性程度最高的肿瘤,胶质瘤特征性的 特点为浸润性生长且边界不清,因此常规外科手术不能彻底清除肿瘤细胞,从而使得大多数患者预后不良[10]。目前研究者认为胶质瘤的这种高度恶性与肿瘤内缺氧微环境密切相关。事实上,颅内肿瘤生理状态下即为一缺氧微环境,平均氧浓度范围波动在0.5%~7%[11]。 研究者将氧浓度范围2.5%~7%定义为轻度缺氧,0.5%~2.5%为中度缺氧,0.1%~0.5%为重度缺氧,严重缺氧或无氧则被认为是氧浓度少于0.1%[8]。其中Ⅱ级胶质瘤表现为轻度缺氧(2.5%~7%),Ⅲ级胶质瘤表现为中度缺氧(0.5%~2.5%),Ⅳ级胶质瘤表现为严重缺氧或无氧(<0.1%)[8]。既往研究主要着力于解决缺氧与肿瘤干细胞之间的相关关系并进而发现缺氧可以通过增强肿瘤干细胞干性而表达更高程度的耐药性。2009年,Li[12]通过研究发现肿瘤缺氧可以加快肿瘤干细胞自我更新并促进肿瘤细胞增殖,其他一些报道也得到了类似结果[13]。
为了改善肿瘤内部缺氧并提高肿瘤血管的血流灌注力及通透性,研究者开始研究高压氧在这方面的可能性。理论依据基于高压氧可以增加血流中物理溶解的氧含量,从而增加活性氧自由基的产生并进一步杀死肿瘤细胞。2007年,Raa[14]发现高压氧治疗后可以明显减缓肿瘤的形成速度,肿瘤细胞凋亡率也低于常氧组,通过光学显微镜还发现肿瘤组织内的缺氧坏死区域也明显下降。其他一些研究也证实了高压氧联合放化疗可以明显提高患者生存率[15, 16, 17]。基于此,我们认为肿瘤缺氧微环境本身会增强肿瘤细胞恶性并影响患者生存期,本实验通过GL261胶质瘤C57小鼠成瘤模型缺氧环境下饲养模拟颅内肿瘤缺氧微环境,探讨缺氧对小鼠胶质瘤形成及生存期的影响,发现小鼠在缺氧环境下饲养14 d就有肿瘤形成,21 d后肿瘤体积进一步增大,而常氧饲养21 d后仍未见肿瘤形成。在缺氧环境下,小鼠的生存期也明显低于常氧饲养组,其平均生存期仅为22.5 d,而常氧饲养组饲养30 d后仅 死亡小鼠1只。这些研究结果再次证明了缺氧微环境可以促进胶质瘤恶性进展,从而为高压氧联合放化疗治疗胶质瘤提供了新的理论依据。
| [1] | Li P, Zhou C, Xu L, et al. Hypoxia enhances stemness of cancer stem cells in glioblastoma: an in vitro study[J]. Int J Med Sci, 2013, 10(4): 399-407. |
| [2] | Wen P Y, Kesari S. Malignant gliomas in adults[J]. N Engl J Med, 2008, 359(5): 492-507. |
| [3] | Cong Z X, Wang H D, Zhou Y, et al. Temozolomide and irradiation combined treatment-induced Nrf2 activation increases chemoradiation sensitivity in human glioblastoma cells[J]. J Neurooncol, 2014, 116(1): 41-48. |
| [4] | Ahmed A U, Auffinger B, Lesniak M S. Understanding glioma stem cells: rationale, clinical relevance and therapeutic strategies[J]. Expert Rev Neurother, 2013, 13(5): 545-555. |
| [5] | Suzuki Y, Tanaka K, Negishi D, et al. Pharmacokinetic investigation of increased efficacy against malignant gliomas of carboplatin combined with hyperbaric oxygenation[J]. Neurol Med Chir (Tokyo), 2009, 49(5): 193-197. |
| [6] | Soeda A, Park M, Lee D, et al. Hypoxia promotes expansion of the CD133- positive glioma stem cells through activation of HIF-1alpha[J]. Oncogene, 2009, 28(45): 3949-3959. |
| [7] | Yeh W L, Lin C J, Fu W M. Enhancement of glucose transporter expression of brain endothelial cells by vascular endothelial growth factor derived from glioma exposed to hypoxia[J]. Mol Pharmacol, 2008, 73(1): 170-177. |
| [8] | Bar E E, Lin A, Mahairaki V, et al. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres[J]. Am J Pathol, 2010, 177(3): 1491-1502. |
| [9] | Maguire C A, Bovenberg M S, Crommentuijn M H, et al. Triple bioluminescence imaging for in vivo monitoring of cellular processes[J]. Mol Ther Nucleic Acids, 2013, 2: e99. |
| [10] | Oike T, Suzuki Y, Sugawara K, et al. Radiotherapy plus concomitant adjuvant temozolomide for glioblastoma: Japanese mono-institutional results[J]. PLoS One, 2013, 8(11): e78943. |
| [11] | Jensen R L. Brain tumor hypoxia: tumorigenesis, angiogenesis, imaging, pseudoprogression, and as a therapeutic target[J]. J Neurooncol, 2009, 92(3): 317-335. |
| [12] | Li Z, Bao S, Wu Q, et al. Hypoxia-inducible factors regulate tumorigenic capacity of glioma stem cells[J]. Cancer Cell, 2009, 15(6): 501-513. |
| [13] | Bar E E. Glioblastoma, cancer stem cells and hypoxia[J]. Brain Pathol, 2011, 21(2): 119-129. |
| [14] | Raa A, Stansberg C, Steen V M, et al. Hyperoxia retards growth and induces apoptosis and loss of glands and blood vessels in DMBA-induced rat mammary tumors[J]. BMC Cancer, 2007, 7: 23. |
| [15] | Ogawa K, Ishiuchi S, Inoue O, et al. Phase II trial of radiotherapy after hyperbaric oxygenation with multiagent chemotherapy (procarbazine, nimustine, and vincristine) for high-grade gliomas: long-term results[J]. Int J Radiat Oncol Biol Phys, 2012, 82(2): 732-738. |
| [16] | Abe M, Shioyama Y, Terashima K, et al. Successful hyperbaric oxygen therapy for laryngeal radionecrosis after chemoradiotherapy for mesopharyngeal cancer: case report and literature review[J]. Jpn J Radiol, 2012, 30(4): 340-344. |
| [17] | Karakullukcu B, van-der-Vlies D, Hoebers F J. A rare late complication after concomitant chemoradiation of an oropharyngeal tumor: cervical necrotizing fasciitis[J]. Kulak Burun Bogaz Ihtis Derg, 2012, 22(2): 105-108. |



