膀胱逼尿肌收缩功能障碍常继发于下尿路梗阻、神经源性膀胱、糖尿病膀胱或某些药物作用后,在临床上十分常见,且各种药物疗效均不理想[1]。膀胱逼尿肌的收缩特性是膀胱最重要的生理功能,而长期的下尿路梗阻、神经系统病变或慢性代谢性疾病等可导致逼尿肌细胞骨架或肌丝结构的完整性受到不可逆的损伤,可能是导致膀胱功能难以恢复的重要因素之一,严重的损害甚至可导致膀胱收缩功能的丧失[2]。在我们的前期研究中发现热休克蛋白27(heat shock protein 27,HSP27)作为一种分子伴侣,对维持各类平滑肌细胞骨架结构的稳态发挥了重要作 用,在膀胱平滑肌收缩功能的调控中可发挥积极作用,尤其在下尿路梗阻引起的膀胱收缩乏力中其表达水平和磷酸化程度均发生了明显的变化,并与梗阻的程度密切相关,其表达与膀胱收缩力的亦有密切的关系[3]。
本研究拟通过体外培养膀胱平滑肌细胞,利用siRNA干扰的方法下调HSP27表达,研究HSP27的表达对膀胱逼尿肌细胞肌动蛋白结构以及收缩特性的影响并探讨其初步的作用机制。 1 材料与方法 1.1 材料
人膀胱平滑肌细胞株购于美国Lifenline cell Technology公司,病毒载体pGreenPuro购于System Biosciences公司,Lipofectamine2000脂质体试剂购于Invitrogen公司,人膀胱平滑肌细胞培养基购于Lifeline cell Technology 公司,FITC标记的鬼笔环肽试剂购于Alexis公司,DAPI购于江苏碧云天公司,鼠尾胶原蛋白购于杭州生友生物技术有限公司,兔抗人HSP27多克隆抗体购于Abcam公司,其余常规试剂均为国产分析纯。 1.2 方法 1.2.1 人膀胱平滑肌细胞株的体外培养
BSMCs细胞株复苏后培养于膀胱平滑肌细胞的培养基(含5% FBS),在37 ℃,5% CO2恒温细胞培养箱中培养3~5 d传代1次,5~7代的细胞用于后续实验。 1.2.2 pGreenPuro-sh-HSP27质粒构建及病毒制备
根据pGreenPuroTM shRNA Lentivector说明书设计3条HSP27 shRNA干扰靶点如下: HSP27 target 1: CT-CAAATAAAGTTCAAAGCAAC HSP27 target 2: ATGAG-ACTGCCGCCAAGTAAAG HSP27 target 3: GCGCGTGT-CCCTGGATGTCAAC并合成下列寡核苷酸链。HSP27
sh 1正义: GATCCCTCAAATAAAGTTCAAAGCAACTTC-AA GAGAGTTGCTTTGAACTTTATTTGAGTTTTTG。HSP27 sh 1反义: AATTCAAAAACTCAAATAAAGTTC-AAAGCAACT CTCTTGAAGTTGCTTTGAACTTTATTTG-AGG。HSP27 sh 2正义: GATCCATGAGACTGCCGCC-AAGTAAAGTTCAAG AGACTTTACTTGGCGGCAGTCTC-ATTTTTTG。HSP27 sh 2反义: AATTCAAAAAATGA-GACTGCCGCCAAGTAAAGT CTCTTGAACTTTACTTGG-CGGCAGTCTCATG。HSP27 sh 3正义: GATCCGCG-CGTGTCCCTGGATGTCAACTTCAAGAGAGTTGACATC-CAGGGACACGCGCTTTTTG。 HSP27 sh 3反义: AAT-TCAAAAAGCGCGTGTCCCTGGATGTCAACTCTCTTGA-AGTTGACATCCAGGGACACGCGCG。
寡核苷酸链分别退火,pGreenPuro载体经BamH Ⅰ和EcoRⅠ双酶切、切胶回收后与退火产物连接,转化入DH5α感受态细胞,氨苄青霉素筛选阳性克隆,经测序验证后命名为pGreenPuro-sh-HSP27-1,pGreenPuro-sh-HSP27-2和pGreenPuro-sh-HSP27-3。利用Lipofecta mine2000转染系统将pMD2.G、pSPAX2及3种pGreenPuro-sh-HSP27质粒分别共转染处于对数生长期的293FT细胞,37 ℃培养48 h收集病毒上清液,10 000×g离心10 min,然后将上清用0.45 μm滤器过滤。 1.2.3 慢病毒转染BSMCs及鉴定
消化培养的BSMCs铺入24孔板,2.5×104/孔的密度接种细胞。 培养24 h细胞贴壁生长,分别取干扰病毒液200 μL,加入到培养板的孔内,并将空病毒感染和未感染BSMCs 作为对照。24 h后,将上清换为新鲜BSMCs培养基,继续培养48 h后,在荧光显微镜下观察细胞感染状况,Western blot检测HSP27蛋白水平并筛选干扰效果最好的1组进行后续实验。 1.2.4 鬼笔环肽荧光染色
取培养5 d左右的BSMCs,吸出多余培养基,多聚甲醛固定30 min后,PBS漂洗3次,加入FITC标记的鬼笔环肽(1 ∶200稀释)和DAPI核染液,室温下避光染色30 min。PBS漂洗后激光共聚焦显微镜下观察。 1.2.5 Western blot检测F/G-actin比值
检测体外培养BSMCs中的F-actin和G-actin的含量比值(F/G-actin 比值)用来评估细胞内肌动蛋白的聚合/结聚状态。根据F/G actin in vivo assay kit(Cytoskeleton Inc)说明书提供方法进行检测。简述如下:对照组和HSP27干扰组BSMCs分别在细胞裂解溶液中裂解10 min(裂解液成分:50 mmol/L PIPES,50 mmol/L NaCl,5 mmol/L MgCl2,5 mmol/L EGTA,5%甘油,0.1% NP-40,0.1% Triton X-100,0.1% Tween 20,0.1% 2巯基乙醇,0.001% 抗泡剂和蛋白酶抑制剂),然后37 ℃,100 000×g超速离心1 h以分离 F-actin 和G-actin,移液器小心吸出上清液,分别加入F-actin解聚液100 μL,充分混匀后冰上孵育1 h后加入5×SDS缓冲液后进行Western blot检测[8]。 1.2.6 三维细胞培养模型的构建及收缩力检测
消化体外培养的BSMCs,调整细胞密度约3×106/mL,放置于冰浴中,取5 mL的离心管,用移液器取24 μL 0.1 mol/L NaOH,再加入400 μL鼠尾胶原蛋白Ⅰ型(5 mg/mL),立即混匀。先加入46 μL 10×PBS,混匀。再加入1 520 μL人的膀胱平滑肌细胞的悬浮液,混匀后立即加入到三维培养皿中(参考Oishi[4]的实验方法制作)。室温中放置20 min待胶凝固后,加入适当体积的细胞培养基,转移到培养箱中培养7 d,HE染色鉴定胶原中BSMCs的分布情况。
取出待检测的肌条,一端固定于麦氏皿(平滑肌槽)的底部,另一端垂直悬挂于张力换能器上,37 ℃恒温水槽,持续通以95% O2、5% CO2的混合气体,在Krebs液中平衡30 min,然后加入80 mmol/L的KCl,用RM6248多功能生理电记录仪记录加药前后肌条收缩幅度的变化,将加入KCl后5 min内记录到的最大收缩幅度定为Fmax。 1.3 统计学分析
应用SPSS 18.0统计软件,计量资料以x±s表示,组间比较采用t检验。 2 结果 2.1 慢病毒包装及转染BSMCs
pGreenPuro-sh-HSP27质粒转染293FT细胞,包装病毒后,孔稀释法测得病毒滴度>108 TU/mL。优化条件,转染 BSMCs最适 MOI=10,嘌呤霉素筛选1周后,转染效率>95%,且细胞保持较为完好的形态及活力(图 1)。
 |
| 图 1 慢病毒转染并经过嘌呤霉素筛选后的BSMCs(荧光显微镜 ×100) |
Western blot检测结果提示对照组HSP27蛋白相对表达水平为(0.415±0.031),空病毒载体对照蛋白相对表达水平为(0.430±0.028),3组干扰细胞
的HSP27蛋白表达水平分别为(0.145±0.014),(0.034±0.008)和(0.039±0.009),均显著低于正常对照和空病毒载体对照(P<0.05)。而其中第2组干扰效率最高,据此,我们筛选pGreenPuro-sh-HSP27-2进行后续研究(图 2)。
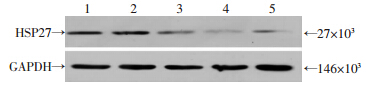 |
| 1:对照组; 2: pGreenPuro-sh; 3: pGreenPuro-sh-HSP27-1; 4:pGreenPuro-sh-HSP27-2;pGreenPuro-sh-HSP27-3 图 2 Western blot检测各组干扰细胞的HSP27蛋白表达水平 |
激光共聚焦显微镜下可见正常BSMCs内肌动蛋白在细胞质内均匀呈放射状分布,在细胞边缘及外伸的伪足处更为丰富并呈束状相互连接,形成周边肌动蛋白丝带,而HSP27干扰组BSMCs肌动蛋白皱缩成小团状或短小的束状,周边肌动蛋白丝带模糊,细胞形态发生改变(图 3)。
 |
| A:对照组;B:低表达HSP27;绿色荧光为FITC标记的F-actin;蓝色荧光为DAPI染色的细胞核 图 3 激光共聚焦显微镜观察体外培养BSMCs中肌动蛋白 细胞骨架结构的变化 |
Western blot检测结果提示HSP27干扰组BSMCs的F/G-actin比值为(0.116±0.001),显著低于正常对照组[(8.717±0.500),P<0.05,图 4],表明干扰组细胞骨架结构的构成出现了反向的改变,提示HSP27低表达对膀胱逼尿肌细胞内肌动蛋白骨架结构的合成和聚合造成明显的影响,从而可能进一步引起其收缩功能的减弱。
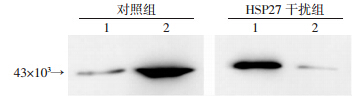 |
| 1:G-actin;2:F-actin 图 4 Western blot检测干扰HSP27表达对BSMCs细胞F-actin和G-actin含量比(F/G)的影响 |
HE染色提示BSMCs可在三维培养皿中正常生长,且形态特征符合平滑肌细胞体外培养特性(图 5)。图 6结果显示,向水浴槽内加入80 mmol/L KCl后能诱发正常BSMCs的收缩,平均最大收缩力Fmax为 (8.4±0.6)mg,而HS27基因干扰组细胞在KCL刺激下没有发生明显收缩幅度的改变,记录到的平均Fmax为 (3.8±0.2)mg,明显低于对照组(P<0.05)。80 mmol/L KCl可诱导正常对照BSMCs产生明显收缩,而在HSP27干扰组细胞中检测到的最大收缩力明显下降。
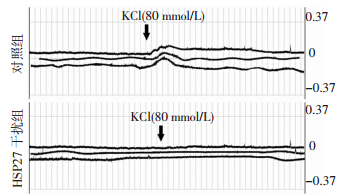 |
| 图 5 三维培养BSMCs收缩力检测 |
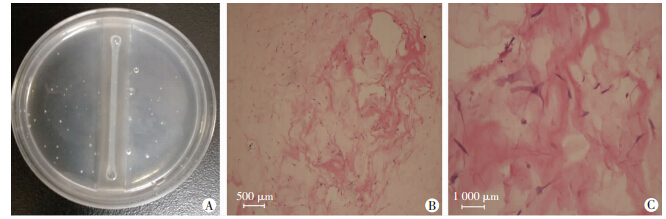 |
| A:BSMCs在鼠尾胶原中培养7 d的哑铃形三维模型;B:HE染色鉴定在胶原中生长的BSMCs细胞;C:高倍镜下可见细胞呈长梭形生长,形态学符合平滑肌细胞生长特征 图 6 BSMCs三维培养模型的制作及HE染色鉴定细胞分布 |
膀胱正常的储/排尿生理功能在很大程度上取决于膀胱逼尿肌细胞的舒张与收缩特性。平滑肌细胞的收缩和舒张在很大程度上依赖于肌动蛋白细胞骨架的完整性,因此稳定的肌丝结构是保证逼尿肌正常收缩的基础,同时也是多种损伤机制导致的平滑肌收缩功能障碍的共同通路[5]。研究表明平滑肌的机械稳定性与肌动蛋白聚合的动态平衡有密切关系,肌动蛋白构成的细肌丝处于聚合/解聚的动态平衡状态,一旦外界损伤导致其失衡,就可能对逼尿肌细胞收缩造成不可逆的损伤[6, 7]。而在气道平滑肌、胃肠道和血管平滑肌中的研究也提示平滑肌肌动蛋白细胞骨架的聚合/解聚状态失衡是哮喘、便秘和心血管疾病发生的重要机制[8, 9, 10, 11]。我们既往的研究也发现,在急性尿潴留导致的膀胱收缩乏力中膀胱平滑肌超微结构出现明显损害并影响其收缩功能[3]。因此,在各种伤害性刺激后保护膀胱平滑肌的细胞骨架对于维护膀胱的收缩功能十分重要。
HSP27作为一种重要的分子伴侣,是最早发现、也是最具代表性的 小分子热休克蛋白之一,在平滑肌的 收缩功能的调节中起重要作用。HSP27的表达和磷酸 化在多种平滑肌器官和组织的收缩功能调节中发挥了重要的作用,研究表明HSP27在平滑肌细胞中可通过影响肌丝细胞骨架的动态平衡调节平滑肌的舒张和收缩[12],但是在膀胱平滑肌中的研究较少。HSP27的磷酸化是其活性形式,现已明确,p38 MAPK 及p38 MAPK激活的蛋白激酶、蛋白激酶C(protein kinaseC,PKC) 是其磷酸化的上游信号通路。HSP27 有3 个磷酸化位点,分别为Ser15、Ser78和Ser82[13, 14]。我们既往的研究发现急性尿潴留后不同时相点HSP27的表达和3个磷酸化位点的磷酸化状态会出现可逆性的变化,而该变化与膀胱收缩力的大小呈正相关,强烈提示HSP27可能是膀胱平 滑肌的重要保护性蛋白,在细胞受到伤害性刺激后可通过代偿性增强表达和磷酸化状态的改变保护细胞正常的生理功能,增强细胞抗损伤能力[3, 15]。在本研究中,我们用RNA干扰的方法下调了体外培养BSMCs中HSP27的表达,结果显示HSP27的低表达可直接影响BSMCs的F-actin细胞骨架结构,导致其细胞结构松散,可能是收缩功能下降的主要结构基础。
肌动蛋白是构成平滑肌细肌丝的主要结构,在平滑肌细胞内有两种主要存在的形式,即丝状肌动蛋白F-actin和球状肌动蛋白G-actin,在血管平滑肌中的研究表明,F-actin和G-actin处于一种动态平衡状态,在调节细胞的运动、分化和增值以及平滑肌细胞的收缩功能及肌张力的维持方面发挥重要的作用[16],但是在膀胱平滑肌中的肌动蛋白稳态相关研究罕有报道,为了观察HSP27的表达对于逼尿肌细胞内肌动蛋白构成的影响,我们对不同组别的细胞内F/G-actin比值进行了检测,结果表明HSP27低表达可显著影响F/G-actin比值,使得细胞内大量F-actin结聚,这可能是导致细胞骨架动态失衡的原因。为了验证HSP27低表达导致的肌动蛋白损伤对平滑肌细胞收缩性能的影响,我们构建了三维BSMCs细胞培养模型,并在KCl刺激下检测到了正常平滑肌细胞肌条的细微收缩力,而在HSP27低表达的细胞中并没有检测到明显的收缩力变化。
因此,我们推测HSP27可以作为膀胱平滑肌细胞内的重要保护因子,通过参与G/F-actin聚合的动态平衡调节细胞收缩。而针对HSP27的表达或磷酸化的调控亦可能为治疗膀胱收缩功能障碍性疾病提供一条新思路。本研究针对HSP27的表达在膀胱收缩功能障碍中的作用进行了初步探讨,关于HSP27磷酸化位点的变化特征及HSP27对于actin聚合状态的具体调控机制的信号转导通路等方面可能是今后更深入研究的探索方向。
| [1] | Levin RM, Chichester P, Hass M A, et al. Obstructive Bladder Dysfunction: Morphological, Biochemical and Molecular Changes[J]. Eur Urol Suppl, 2002, 1(9): 14-20. |
| [2] | Saito M, Miyagawa I. Bladder dysfunction after acute urinary retention in rats[J]. J Urol, 2001, 165(5): 1745-1747. |
| [3] | Xiong Z, Wang Y, Gong W, et al. Expression of Hsp27 correlated with rat detrusor contraction after acute urinary retention[J]. Mol Cell Biochem, 2013, 381(1/2): 257-265. |
| [4] | Oishi K, Itoh Y, Isshiki Y, et al. Agonist-induced isometric contraction of smooth muscle cell-populated collagen gel fiber[J]. Am J Physiol Cell Physiol, 2000, 279(5): C1432-C1442. |
| [5] | Zheng J P, Ju D, Shen J, et al. Disruption of actin cytoskeleton mediates loss of tensile stress induced early phenotypic modulation of vascular smooth muscle cells in organ culture[J]. Exp Mol Pathol, 2010, 88(1): 52-57. |
| [6] | Bosse Y, Chin L Y, Pare P D, et al. Adaptation of airway smooth muscle to basal tone: relevance to airway hyperresponsiveness[J]. Am J Respir Cell Mol Biol, 2009, 40(1): 13-18. |
| [7] | Chaudhuri S, Smith P G. Cyclic strain-induced HSP27 phosphorylation modulates actin filaments in airway smooth muscle cells[J]. Am J Respir Cell Mol Biol, 2008, 39(3): 270-278. |
| [8] | Kostenko S, Johannessen M, Moens U. PKA-induced F-actin rearrangement requires phosphorylation of Hsp27 by the MAPKAP kinase MK5[J]. Cell Signal, 2009, 21(5): 712-718. |
| [9] | MacIntyre D A, Tyson E K, Read M, et al. Contraction in human myometrium is associated with changes in small heat shock proteins[J]. Endocrinology, 2008, 149(1): 245-252. |
| [10] | Chen H F, Xie L D, Xu C S. Role of heat shock protein 27 phosphorylation in migration of vascular smooth muscle cells[J]. Mol Cell Biochem, 2009, 327(1/2): 1-6. |
| [11] | Walker S, Danton M, Peng E W, et al. Heat shock protein 27 is increased in cyanotic tetralogy of Fallot myocardium and is associated with improved cardiac output and contraction[J]. Cell Stress Chaperones, 2013, 18(3): 269-277. |
| [12] | Salinthone S, Tyagi M, Gerthoffer W T. Small heat shock proteins in smooth muscle[J]. Pharmacol Ther, 2008, 119(1): 44-54. |
| [13] | Meier M, King G L, Clermont A, et al. Angiotensin AT(1) receptor stimulates heat shock protein 27 phosphorylation in vitro and in vivo[J]. Hypertension, 2001, 38(6): 1260-1265. |
| [14] | Chen H F, Xie L D, Xu C S. The signal transduction pathways of heat shock protein 27 phosphorylation in vascular smooth muscle cells[J]. Mol Cell Biochem, 2010, 333(1/2): 49-56. |
| [15] | Vidyasagar A, Wilson N A, Djamali A. Heat shock protein 27 (HSP27): biomarker of disease and therapeutic target[J]. Fibrogenesis Tissue Repair, 2012, 5(1): 7. |
| [16] | McGregor E, Kempster L, Wait R, et al. F-actin capping (CapZ) and other contractile saphenous vein smooth muscle proteins are altered by hemodynamic stress: a proteonomic approach[J]. Mol Cell Proteomics, 2004, 3(2): 115-124. |



