4 中西医结合科;
2 400042 重庆,第三军医大学大坪医院野战外科研究所第一研究室,创伤、烧伤与复合伤国家重点实验室;
3 70118-5698 美国 洛杉矶 新奥尔良,杜兰大学生理学教研室
4 Department of Integrated Chinese and Western Medicine, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037;
2 State Key Laboratory of Trauma, Burns and Combined Injury, Department 1, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China;
3 Department of Physiology, Tulane University, Los Angeles, NO 70118-5698, USA
2型糖尿病是以胰岛素抵抗及胰岛β细胞功能障碍为特征的一种综合征,许多因素(如高血糖/糖毒性、脂毒性、自身免疫、炎症、脂肪因子、胰岛淀粉样蛋白)均可影响胰岛β细胞功能。慢性高血糖对胰岛素合成/释放、细胞存活以及胰岛素敏感性产生不利影响,其中涉及多种机制,包括破坏体内钙平衡[1]。钙平衡的紊乱(例如葡萄糖介导的钙离子内流改变、内质网钙损耗)对β细胞生长/功能以及胰岛素分泌信号通路均有不利作用[2]。胰岛β细胞上分布有L型、P/Q型、T型钙离子通道,不同于高电压钙离子通道 (L、N、P/Q、R型钙离子通道),T型钙通道是低电压钙离子通道,是唯一一类允许钙离子在膜静息电位内流的钙离子通道[3],从而改变β细胞胞内基础钙离子浓度。
与特异性T型和L型钙离子通道拮抗剂(前者如NNC 55-0396,后者如尼卡地平)不同,Mibefradil是一类同时拮抗T型和L型钙离子通道的钙离子通道阻滞剂,但它对T型钙离子通道拮抗作用为L型钙离子通道拮抗作用的30~100倍。新近发现,在瘦素受体敲除小鼠db/db小鼠肝脏、脑组织中,较野生型小鼠T型钙通道cav3.1、cav3.2亚基蛋白表达明显增高,予Mibefradil腹腔注射后,db/db小鼠较野生型小鼠空腹胰岛素、血糖、血脂明显降低[4],但Mibefradil降低血糖的机制仍不清楚,且无相关体外实验研究。本研究拟采用高糖培养INS-1细胞构建细胞高糖模型,再用Mibefradil作用于INS-1细胞,同时采用NNC 55-0396、尼卡地平作为对照药物,观察其对正常培养以及高糖培养INS-1细胞分泌胰岛素的影响,以及对INS-1细胞T型钙通道cav3.1、cav3.2亚基表达的作用,以期初步探讨Mibefradil对胰岛细胞功能的作用以及其降低血糖可能的机制。 1 材料与方法 1.1 实验材料及试剂
大鼠胰岛瘤β细胞株(INS-1)购自北京协和细胞库。Mibefradil、NNC 55-0396和尼卡地平均购自美国Sigma公司,以DMSO稀释,储备浓度为1 mmol/L,-20 ℃保存,使用时用含10%胎牛血清RPMI1640培养基稀释。其余试剂、设备名称和厂家如下:改良型1640培养基、胰酶、胎牛血清(美国Hyclone公司)、CCK-8试剂(武汉碧云天生物技术公司),RT-PCR逆转录试剂盒、扩增试剂盒(TaKaRa公司),抗cav3.1兔多克隆抗体、抗cav3.2兔多克隆抗体(美国Santa Cruz公司,工作浓度为1 ∶200),抗β-actin兔单克隆抗体(北京中杉金桥公司,工作浓度为1 ∶4 000),辣根过氧化物酶标记山羊抗兔IgG二抗(北京中杉金桥公司,工作浓度为1 ∶5 000),ECL化学发光显影剂(武汉碧云天生物技术公司);光学显微镜(日本Nikon公司),电泳仪、转膜仪、凝胶成像仪、酶标仪(美国Bio-Rad公司),脱色摇床(美国Thermo公司)。 1.2 实验方法 1.2.1 细胞培养方法
复苏冻存的INS-1细胞株,置于含10%胎牛血清的1640培养液中,于37 ℃,5% CO2的恒温箱进行培养,当细胞贴壁生长融合至70%~80%时用0.25%胰酶进行消化并传代。 1.2.2 RT-PCR检测T型钙通道cav3.1、cav3.2亚基基因表达。 1.2.2.1 总RNA制备
选取对数生长期、约70%~ 80%贴壁的INS-1细胞,5.5 mmol/L葡萄糖培养基培养过夜,经0.25%胰酶消化后,按2×105/mL接种于6孔板内,每孔500 μL,正常培养基补足溶液体积为2 mL,待细胞贴壁后,分组培养细胞,分组一:①对照组(NG):正常培养(即含11.1 mmol/L葡萄糖的RPMI1640培养基培养);②HG1 24 h组:16.7 mmol/L葡萄糖培养24 h;③HG1 48 h组:16.7 mmol/L葡萄糖培养48 h;④HG1 72 h组:16.7 mmol/L葡萄糖培养72 h;⑤HG2 24 h组:33.3 mmol/L葡萄糖培养24 h;⑥HG2 48 h组:33.3 mmol/L葡萄糖培养48 h;⑦HG2 72h组:33.3 mmol/L葡萄糖培养72 h;分组二:①对照组(NG):正常培养72 h;②药物组(+Mib):正常培养48 h后加入1 μmol/L Mibefradil继续培养24 h;③高糖组(HG):33.3 mmol/L葡萄糖培养72 h,④高糖+药物组(HG+Mib):33.3 mmol/L葡萄糖培养48 h后再加入1 μmol/L Mibefradil继续培养24 h。在相应时间点,按试剂说明书用TRIzol一步提取法提取总RNA(6孔板每孔加入0.5 mL TRIzol)。 1.2.2.2 RT-PCR
以500 ng总RNA为模板逆转录成cDNA,根据TaKaRa扩增试剂盒说明分别加入cav3.1、cav3.2、β-actin特异性引物、相应试剂、cDNA分别进行扩增,反应体系为10 μL,采用高温启动法进行PCR循环(表 1)。取不同目的基因扩增产物进行琼脂糖凝胶电泳,电泳结束后用凝胶图像采集系统进行图像采集,并拍照保存。RT-PCR图片用Quantity One行相对光密度值量化分析。
| 目的基因 | 引物序列 | 扩增片 段(bp) | 退火 温度 | 循环数 (个) |
| cav3.1 | 上游: 5′-TCTTCCAGGACAGGTGGAAC-3′ 下游: 5′-TCAGCACGAAGGACACAAAG-3′ | 501 | 57.3 ℃,30 s | 35 |
| cav3.2 | 上游: 5′-TCAGCACGAAGGACACAAAG-3′ 下游: 5′-AGTTTCCTCTTTGGGGGCTA-3′ | 402 | 57.3 ℃,30 s | 35 |
| β-actin | 上游: 5′-ACCCCGTGCTGGACCGAG-3′ 下游: 5′-TCCCGGCCAGCCAGGTCCA-3′ | 249 | 50.3 ℃,30 s | 35 |
选取约50%~60%贴壁细胞经5.5 mmol/L 葡萄糖培养基培养过夜后,分组同1.2.2.1,在相应时间点按照哺乳动物细胞裂解液说明书步骤于冰上进行蛋白提取,采用分光光度计法测定蛋白浓度,调整蛋白浓度,变性蛋白保存于-80 ℃。每孔上样100 μg做SDS-PAGE电泳,用湿转法将蛋白转至0.45 μmol/L PVDF膜上,5%脱脂奶粉室温置于脱色摇床上封闭1~2 h,孵育兔抗cav3.1以及兔抗cav3.2(工作浓度为1 ∶200),4 ℃孵育过夜,1×TBST缓冲液洗膜(15 min/次,3次),室温孵育对应辣根标记物二抗(工作浓度为1 ∶7 000~9 000)1~2 h,再次予1×TBST缓冲液洗膜(15 min/次,3次),显影液显色后置凝胶成像仪拍照保存。Western blot图片用Quantity One行相对光密度值量化分析。 1.2.4 胰岛素含量检测
按1.2.1要求收集细胞,按2.5×104/mL接种于48孔板内,每孔1 mL,待细胞贴壁后,分组培养细胞,分组如下:①对照组(NG):正常培养72 h;②高糖组(HG):33.3 mmol/L葡萄糖培养72 h;③药物组(+Mib、+NNC、+Nic、+NNC+Nic):正常培养48 h后再按分组分别加入药物(1 μmol/L Mibefradil、1 μmol/L NNC55-0396、10 μmol/L 尼卡地平、1 μmol/L NNC55-0396+10 μmol/L 尼卡地平)继续培养24 h;④高糖+药物组(HG+Mib、HG+NNC、HG+Nic、HG+NNC+Nic):33.3 mmol/L葡萄糖培养48 h后再按分组分别加入药物(1 μmol/L Mibefradil、 1 μmol/L NNC55-0396、10 μmol/L 尼卡地平、1 μmol/L NNC55-0396+10 μmol/L 尼卡地平)继续培养24 h,在相应时间点吸出培养液,每孔加入500 μL无糖Krebs-Ringer缓冲液37 ℃细胞培养箱孵育30 min,吸出缓冲液,每孔分别加入含3.3 mmol/L葡萄糖的 Krebs-Ringer缓冲液,37 ℃细胞培养箱继续培养1 h,从每孔吸取500 μL上清,依次做好标记。每孔再分别加入含16.7 mmol/L葡萄糖的Krebs-Ringer缓冲液,37 ℃细胞培养箱继续培养1 h,从每孔吸取500 μL上清,依次做好标记,将所有上清于离心机以4 ℃、3 000 r/min 离心30 min,每组吸取300 μL上清[4],做好标记,送往第三军医大学西南医院核医学科放射免疫实验室行放免法检测胰岛素含量。 1.3 统计学分析
采用SPSS 17.0软件进行统计处理,数据以x±s表示。计量资料两组间比较用t检验,多组间比较用单因素方差分析。 2 结果 2.1 INS-1细胞体外培养
在倒置显微镜下观察INS-1细胞形态,正常的INS-1细胞贴壁生长,形态呈多角形(图 1)。
 |
| 图 1 倒置显微镜观察INS-1细胞形态变化(×100) |
随高糖浓度、作用时间不同,cav3.1、cav3.2亚基基因表达不同程度升高,其中cav3.1在16.7 mmol/L葡萄糖、33.3 mmol/L葡萄糖作用48、72 h表达均明显升高(P<0.05,图 2A、2B),cav3.2在16.7 mmol/L葡萄糖作用72 h,33.3 mmol/L葡萄糖作用48、72 h表达均明显升高(P<0.05,图 2A、2C)。随高糖浓度、作用时间不同,cav3.1、cav3.2亚基蛋白表达不同程度升高,cav3.1在16.7 mmol/L葡萄糖作用48、72 h表达均明显升高、33.3 mmol/L葡萄糖作用24、48、72 h表达均明显升高(P<0.05,图 3A、3B),cav3.2在16.7、33.3 mmol/L葡萄糖作用72 h表达均明显升高(P<0.05,图 3A、3C)。结合高糖对T型钙通道两个亚基 基因及蛋白表达的作用,将33.3 mmol/L高糖作用72 h 作为后续实验条件。
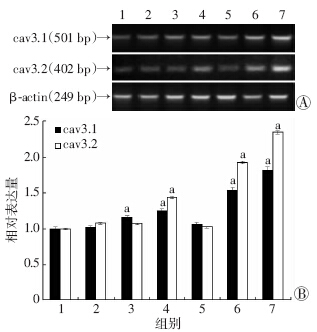 |
| 1:对照组;2:HG1 24 h组;3:HG1 48 h组;4:HG1 72 h组;5:HG2 24 h组;6:HG2 48 h组;7:HG2 72 h组; A:RT-PCR检测结果;B:半定量分析结果 a:P<0.05,与对照组比较图 2 T-PCR检测不同浓度高糖对INS-1细胞T型钙 通道cav3.1、cav3.2亚基基因表达的影响 |
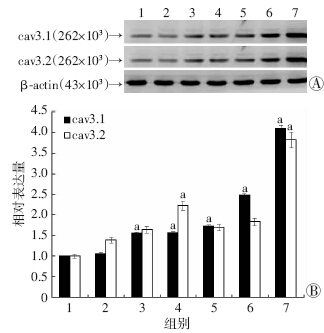 |
| 1:对照组;2:HG1 24 h组;3:HG1 48 h组;4:HG1 72 h组;5:HG2 24 h组;6:HG2 48 h组;7:HG2 72 h组;A:Western blot检测结果;B:半定量分析结果 a:P<0.05,与对照组比较图 3 Western blot不同浓度高糖对INS-1细胞T型钙 通道cav3.1、cav3.2亚基蛋白表达的影响 |
据预实验结果,高糖作用浓度及时间为33.3 mmol/L 高糖作用72 h,最佳药物作用浓度及时间分别为 1 μmol/L Mibefradil、1 μmol/L NNC 55-0396、10 μmol/L 尼卡地平作用24 h,应用于本实验中,各组细胞予不同浓度葡萄糖培养48 h后再按分组再予药物继续培养24 h,以达到最佳作用时间,按分组培养细胞。结果表明:高糖组(HG)较对照组(NG)显著升高细胞基础胰岛素分泌(3.3 mmol/L葡萄糖刺激)和葡萄糖刺激胰岛素分泌(16.7 mmol/L葡萄糖刺激)(P<0.05);与对照组比较,药物干预组细胞胰岛素分泌(基础分泌以及葡萄糖刺激胰岛素分泌)均无显著差异(P>0.05);与高糖组相比,高糖+药物干预组均能不同程度降低细胞胰岛素分泌(基础分泌以及葡萄糖刺激胰岛素分泌),但其中仅Mibefradil作用显著(P<0.05,表 2)。
| 组别 | NG | +Mib | +NNC | +Nic | +NNC+Nic |
| 3.3 mmol/L葡萄糖刺激 | 78.96±7.67 | 72.92±3.51 | 71.12±5.28 | 73.74±4.19 | 65.34±13.66 |
| 16.7 mmol/L葡萄糖刺激 | 96.62±14.15 | 82.31±9.16 | 71.12±5.28 | 85.31±9.55 | 88.19±5.42 |
| 组别 | HG | HG+Mib | HG +NNC | HG+Nic | HG+NNC+Nic |
| 3.3 mmol/L葡萄糖刺激 | 101.77±4.15a | 77.83±11.15b | 86.36±15.25 | 87.35±12.20 | 86.59±6.25 |
| 16.7 mmol/L葡萄糖刺激 | 125.98±14.66a | 91.24±9.53b | 104.51±12.38 | 106.62±11.81 | 107.31±21.15 |
| NG:对照组 a:P<0.05,与对照组比较;HG:高糖培养组 b:P<0.05,与高糖培养组比较 | |||||
基于Mibefradil对INS-1细胞胰岛素分泌的抑制作用明显优于NNC 55-0396以及尼卡地平,以Mibefradil为最佳药物进行本实验,分组如1.2.2.1分组二,结果表明:与对照组相比,药物组T型钙通道cav3.1、cav3.2亚基的基因及蛋白表达无显著差异(P>0.05);而高糖+药物组较高糖组显著降低T型钙通道cav3.1、cav3.2亚基的基因(图 4A、4B)及蛋白(图 5A、5B)表达(P<0.05),Mibefradil对胰岛细胞cav3.1、cav3.2亚基基因及蛋白表达的作用与其对胰岛细胞胰岛素分泌的作用是一致的。
 |
| 1:对照组(NG);2:药物组(+Mib);3:高糖组(HG);4:高糖+药物组(HG+Mib); A:RT-PCR检测结果;B:半定量分析结果 a:P<0.05,与同期HG组比较图 4 RT-PCR检测Mibefradil对正常和高糖作用后INS-1 细胞T型钙通道cav3.1、cav3.2亚基基因表达的影响 |
 |
| 1:对照组(NG);2:药物组(+Mib);3:高糖组(HG);4:高糖+药物组(HG+Mib); A:Western-blot检测结果;B:半定量分析结果 a:P<0.05,与同期HG组比较图 5 Western-blot检测Mibefradil对正常和高糖作用后INS-1 细胞T型钙通道cav3.1、cav3.2亚基蛋白表达的影响 |
本研究发现,高糖培养INS-1细胞明显增高T型钙通道cav3.1、cav3.2亚基表达,Mibefradil作用于INS-1细胞,对正常培养胰岛细胞胰岛素分泌无明显作用,而对高糖培养胰岛细胞胰岛素分泌有抑制作用,且较NNC 55-0396、尼卡地平以及NNC 55-0396与尼卡地平联合应用作用更显著,这与前述研究发现Mibefradil较NNC 55-0396、尼卡地平更显著降低db/db小鼠血糖、空腹胰岛素而对野生型小鼠无此作用这一研究结果[5]基本一致。在此基础上,进一步观察Mibefradil对INS-1细胞T型钙通道cav3.1、cav3.2亚基表达的作用,发现Mibefradil对正常培养组细胞T型钙通道亚基表达无明显作用,而对高糖培养组细胞cav3.1、cav3.2亚基表达有显著降低作用,由此推断,Mibefradil可能通过下调T型钙通道表达抑制高糖诱导INS-1细胞的胰岛素分泌。
既往对T型钙通道研究主要集中于其在癫痫病理生理过程中作用以及对调节各种细胞功能的作用,如细胞增殖、神经递质释放、树突整合、感觉信号传播、疼痛信号通路等[6]。新近研究发现Mibefradil显著降低db/db小鼠空腹胰岛素、血糖、血脂,而对野生型小鼠无此作用[5],但在胰腺组织中对T型钙通道以及T型钙通道拮抗剂Mibefradil的研究尚未涉及。事实上,有研究发现T型钙通道通过增强全细胞兴奋性有利于大鼠胰岛素瘤细胞株INS-1细胞胰岛素释放[7],但本实验进一步研究T型钙通道拮抗剂的作用并初步探讨了T型钙通道表达与胰岛素的关系。由于Mibefradil既能作用于T型钙通道又能作用于L型钙离子通道,且已有基础[8}及临床研究[9]证实了Mibefradil的降血压作用,那么能否将Mibefradil应用于糖尿病并发高血压患者,以期改善其高胰岛素血症同时在降压治疗上获益这将是我们今后研究的重点。
本研究发现Mibefradil能显著抑制高糖诱导的INS-1细胞胰岛素分泌,培养上清中的胰岛素含量一方面取决于胞内胰岛素合成量,另一方面取决于胞内 胰岛素的胞外分泌量。而Mibefradil降低高糖作用下胰岛细胞胰岛素分泌是通过降低胞内胰岛素合成还是通过减少胰岛细胞胞内胰岛素胞外分泌尚需进一步研究证实。胰岛β细胞典型的电活动是一系列葡萄糖诱导潜在动作电位爆发以及同步发生的钙离子振荡,早有研究证实T性钙通道激活降低INS-1细胞动作电位阈值,动作电位阈值减低会导致发生频率增加[7},而动作电位发生同步发生钙离子振荡[10],胰岛素释放的波动与钙离子振荡的变化也是同步的[11]。本研究中Mibefradil对体外培养INS-1细胞胰岛素分泌的作用与其对T型钙通道cav3.1、cav3.2表达的作用是一致的,由此推测Mibefradil可能通过拮抗T型钙通道导致胰岛细胞动作电位阈值升高,从而抑制高糖作用下INS-1细胞胰岛素分泌,但本研究缺乏相关体内实验进行验证。近期研究通过免疫共沉淀发现神经细胞中突触融合蛋白1A/cav3.2复合体的存在,而突触融合蛋白1A/cav3.2复合体可介导神经细胞中神经递质低阈值胞外分泌[3]。但Mibefradil是否可作用于神经细胞中突触融合蛋白1A/cav3.2复合体以及胰岛细胞中是否存在突触融合蛋白1A/cav3.2复合体尚需进一步研究证实。
综上,本研究揭示Mibefradil可能通过下调T型钙通道抑制高糖诱导INS-1细胞的胰岛素分泌水平,从而为深入研究Mibefradil在2型糖尿病中的作用机制和新的治疗靶点提供新的依据,以期为糖尿病伴发高血压患者治疗提供一种新的治疗思路。
| [1] | Cernea S, Dobreanu M. Diabetes and beta cell function: from mechanisms to evaluation and clinical implications[J]. Biochem Med (Zagreb), 2013, 23(3): 266-280. |
| [2] | Herchuelz A, Nguidjoe E, Jiang L, et al. β-Cell preservation and regeneration in diabetes by modulation of β-cell Ca2+ homeostasis[J]. Diabetes Obes Metab, 2012, 14(Suppl 3): 136-142. |
| [3] | Weiss N, Hameed S, Fernandez-Fernandez J M, et al. A Ca(v)3.2/syntaxin-1A signaling complex controls T-type channel activity and low-threshold exocytosis[J]. J Biol Chem, 2012, 287(4): 2810-2818. |
| [4] | 张阳, 卢永辉, 缪洪明, 等. 肿瘤坏死因子-α拮抗瘦素抑制胰岛素合成及分泌作用的实验观察[J]. 第三军医大学学报, 2011, 33(6): 558-561. |
| [5] | Lu Y, Long M, Zhou S, et al. Mibefradil reduces blood glucose concentration in db/db mice[J]. Clinics (Sao Paulo), 2014, 69(1): 61-67. |
| [6] | Cueni L, Canepari M, Adelman J P, et al. Ca2+ signaling by T-type Ca2+ channels in neurons[J]. Pflugers Arch, 2009, 457(5): 1161-1172. |
| [7] | Bhattacharjee A, Whitehurst R M Jr, Zhang M, et al. T-type calcium channels facilitate insulin secretion by enhancing general excitability in the insulin-secreting beta-cell line, INS-1[J]. Endocrinology, 1997, 138(9): 3735-3740. |
| [8] | Verma S, Bhanot S, Hicke A, et al. Chronic T-type Ca2+ channel blockade with mibefradil in hyperinsulinemic, insulin-resistant and hypertensive rats[J]. Cardiovasc Res, 1997, 34(1): 121-128. |
| [9] | Oparil S, Kobrin I, Abernethy D R, et al. Dose-response characteristics of mibefradil, a novel calcium antagonist, in the treatment of essential hypertension[J]. Am J Hypertens, 1997, 10(7 Pt 1): 735-742. |
| [10] | Gilon P, Henquin J C. Influence of membrane potential changes on cytoplasmic Ca2+ concentration in an electrically excitable cell, the insulin-secreting pancreatic B-cell[J]. J Biol Chem, 1992, 267(29): 20713-20720. |
| [11] | Gilon P, Henquin J C. Distinct effects of glucose on the synchronous oscillations of insulin release and cytoplasmic Ca2+ concentration measured simultaneously in single mouse islets[J]. Endocrinology, 1995, 136(12): 5725-5730. |



