血管内皮细胞(vascular endothelial cell,VEC)在各种损伤因素作用下,导致细胞功能障碍、单核细胞黏附增加,并伴随后者转化为巨噬细胞形成泡沫化是动脉粥样硬化(atherosclerosis,AS)早期主要病理特征[1]。同时,肾素-血管紧张素系统(rennin-angiotensin system,RAS)在调节血流、血压以及内环境稳态等方面起着十分重要的作用,与AS的发生、发展密切相关[2]。血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)是2000年Donoghue等[3]研究发现的RAS新成员,其具有一定的组织特异性,主要分布于心脏和肾脏等组织及血管内皮细胞、血管平滑肌细胞和巨噬细胞。ACE2为血管紧张素转化酶(angiotensin-converting enzyme,ACE)的同源物,一种可将血管紧张素Ⅰ(angiotensin Ⅰ,AngⅠ)和血管紧张素Ⅱ(angio-tensin Ⅱ,AngⅡ)水解成血管紧张素1-7(angiotensin1-7,Ang1-7)的羧肽酶,并作用于其特异性受体Mas,发挥保护心血管系统的作用[4]。但其是否参与对抗损伤内皮细胞黏附性增加的过程及可能的作用机制,目前国内外尚少见报道。本研究通过建立血管内皮细胞损伤模型,检测不同实验组ACE2表达及上清中AngⅡ和Ang1-7等RAS成员的含量,分析比较单核细胞黏附作用的变化,探讨ACE2在LPS诱导HUVEC损伤中抗黏附的作用,为后续研究药物治疗AS提供新靶点、新思路。
1 材料与方法 1.1 材料脂多糖(lipopolysaccharide,LPS)购自Sigma公司;氯沙坦钾购自Santa Cruz公司;A779购自重庆惠而利生物技术有限公司;pH荧光探针(BCECF-AM)试剂盒购自碧云天生物技术研究所;AngⅡ、Ang1-7、细胞间黏附分子-1(intercellular adhesion molecule 1,ICAM-1)的酶联免疫吸附剂测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自武汉优尔生科技股份有限公司;TRIzol 总RNA提取试剂盒购自TaKaRa公司;逆转录试剂盒(iScriptTM cDNA Synthesis Kit)购自Bio-Rad实验室试剂公司;PCR Mix 试剂盒购自广州东盛生物科技有限公司;ACE2及内参β-actin引物由重庆泽恒生物技术有限公司合成;ACE2一抗购自Abcam公司;GADPH一抗及二抗购自Proteintntech公司;ECL超灵敏化学发光底物购自Advansta公司;RPMI1640培养基、胎牛血清(fetal calf serum,FBS)、胰酶购自HyClone公司;其余试剂均为国产分析纯。人脐静脉内皮细胞(umbilical vein endothelial cell,HUVEC)及人单核细胞白血病细胞(Human acute monocytic leukemia cell line,THP-1)由重庆医科大学生物化学与分药理重点实验室保存。
1.2 构建人脐静脉内皮细胞损伤模型及实验分组将HUVEC细胞用含10%FBS的RPMI1640培养基在37 ℃,5%CO2的条件下培养。取对数生长期细胞,接种于24孔培养板中,待细胞贴壁铺满后,更换为含不同浓度LPS的1%FBS培养基,继续培养不同时 间,诱导血管内皮细胞损伤,以确定最佳LPS诱导浓度及时间。后续实验将内皮细胞随机分为4组(n=3): ①1 000 ng/mL LPS处理6 h为模型组,②加入与LPS等体积PBS为空白对照组,③以10 μmol/L氯沙坦钾预处理0.5 h的模型组为氯沙坦钾组,④以10 μmol/L A779预处理0.5 h的空白对照组为A779组。
1.3 单核细胞黏附实验经5 μmol/L BCECF-AM荧光染色0.5 h的THP-1细胞,PBS冲洗3次,以5×105重悬于含1%FBS培养基 中。将上述单核细胞加入分别经0、10、100、1 000 ng/mL LPS诱导24 h的接种有HUVEC细胞的24孔培养板中,于CO2培养箱共培养2 h。取出培养板,PBS冲洗2次,洗去未黏附的THP-1,置于荧光倒置显微镜下观察,每孔采集5个不同视野图像,并用Image-Pro Plus 6.0图像处理软件,对采集图像中荧光斑点计数。将上述实验重复于分别经1 000 ng/mL LPS诱导0、1.5、6、24 h的同一批HUVEC细胞。
1.4 RT-PCR检测ACE2的基因表达水平按照Trizol试剂盒说明书提取总RNA。逆转录体系为:5×iScript reaction mix 2 μL,iScript reverse transcriptase 0.5 μL,RNA template 1 μg,Nuclease-free water配成10 μL体系,25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min逆转录合成cDNA。以此为模板进行PCR扩增,根据基因库设计引物序列见表 1。PCR反应体系为cDNA 2 μL,PCR上游引物1 μL,PCR下游引物1 μL,2×PCR Mix 12.5 μL,RNase free dH2O 8.5 μL配成25 μL体系。PCR扩增条件:(1)95 ℃ 3 min,(2)95 ℃ 30 s,(3)68 ℃ 30 s -1 ℃/循环,(4)72 ℃ 20 s,(5)重复步骤(2)13个循环, (6)95 ℃ 30 s, (7)57 ℃ 30 s, (8)72 ℃ 20 s, (9)重复步骤(6)31个循环, (10)72 ℃ 10 min。取5 μL PCR产物进行4%琼脂糖凝胶电泳,于Bio-Rad化学发光成像系统仪(Chemi DOCTM XRS)中观察,并用该仪器系统中Image LabTM软件对收集的图像进行分析。目的条带与内参β-actin条带的光密度比值作为目的基因mRNA相对含量。
| 基因 | 基因库序列号 | 引物序列 | 产物大小(bp) |
| ACE2 | NM 021804.2 | 上游:5′-GGTGGGAGATGAAGCGAGAGATA-3′ | 190 |
| 下游:5′-TGTGCAGAGGGCCTTCATGTTTA-3′ | |||
| β-actin | NM 001101.3 | 上游:5′-CGCAGAAAACAAGATGAGATTG-3′ | 237 |
| 下游:5′-GCAAGGGACTTCCTGTAACAAC-3′ |
弃去6孔板中各组细胞培养液,并用冷PBS洗2次,加入200 μL/孔细胞裂解液于冰上充分裂解,并将收集的细胞裂解液于4 ℃、12 000 r/min离心10 min,取上清分别加入适量上样缓冲液并于沸水中煮10 min。取等量蛋白制备液进行SDS-PAGE电泳,并将分离的蛋白转移至PVDF膜上,用5%牛血清蛋白于摇床上封闭1 h。分别与相应一抗于4 ℃孵育过夜,用TBST洗5 min/次×3次后,与二抗于室温孵育1.5 h,用TBST洗5 min/次×3次。用ECL超灵敏化学发光底物显影后,于Bio-Rad化学发光成像系统仪(Chemi DOCTMXRS)中观察并采集图像。目的条带与内参GADPH条带的光密度比值作为目的蛋白的相对含量。
1.6 ELISA检测Ang Ⅱ、Ang1-7、ICAM-1含量分别收集各组HUVEC细胞上清,按照相应ELISA试剂盒说明书操作,酶标仪于λ=450 nm处检测OD值,计算Ang Ⅱ、Ang1-7及ICAM-1的蛋白含量。
1.7 统计学处理实现数据以x±s表示,采用SPSS 13.0统计软件包进行单因素方差分析。
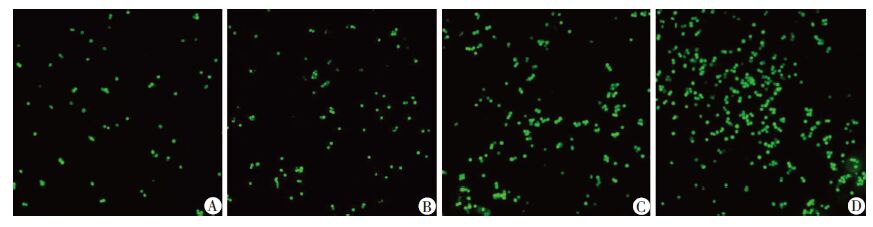
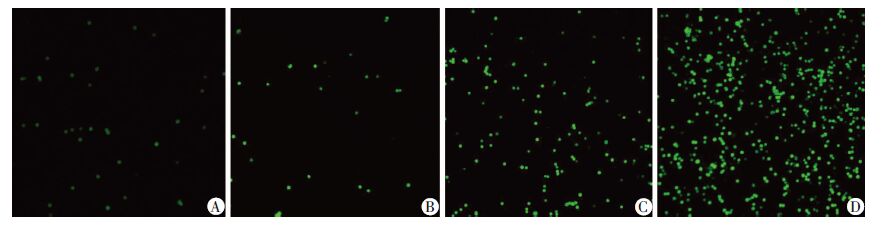
2 结果 2.1 LPS诱导血管内皮细胞黏附性改变显微镜自然光下观察可见圆形THP-1细胞黏附于呈梭形或三角形HUVEC贴壁细胞上,荧光显微镜下仅可见呈绿色荧光的THP-1单核细胞(图 1、2)。为量化血管内皮细胞对THP-1黏附作用的改变程度,采用Image-Pro Plus 6.0图像分析软件对采集图像中的荧光斑点计数,所得结果即为被黏附的THP-1数量。用不同浓度LPS处理HUVEC细胞24 h后,黏附在HUVECs上的THP-1数量分别为PBS组(748.7±26.0);10 ng/mL组(1 040.7±106.9)(P<0.05); 100 ng/mL组(2 204.3±91.8)(P<0.01);1 000 ng/mL 组(2 882.3±129.9),差异有统计学意义(P<0.01)。由此可见LPS处理组细胞黏附数较空白对照组(即PBS组)呈浓度依赖性显著增加(P<0.05,P<0.01),在1 000 ng/mL时达最大效应。于是选用1 000 ng/mL LPS诱导HUVECs不同时间,黏附在HUVECs上的THP-1数量分别为0 h组(267.7±17.3);1.5 h组 (241.3±17.2);6 h组(424.7±24.8)(P<0.01);24 h 组(677.0±22.9),差异有统计学意义(P<0.01)。由此可见LPS处理6h细胞黏附数已较空白对照组(0 h组)显著增加(P<0.01),处理24 h达最大效应。
|
| A:PBS;B:10 ng/mL;C:100 ng/mL;D:1 000 ng/mL 图 1 THP-1对不同浓度LPS诱导24 h后HUVEC的黏附情况 (荧光显微镜 ×100) |
|
| A:0 h;B:1.5 h;C:6 h;D:24 h 图 2 THP-1对1 000 ng/mL LPS处理不同时间后HUVEC的黏附情况 (荧光显微镜 ×100) |
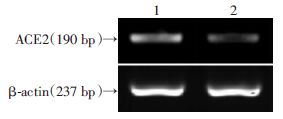
采用RT-PCR检测ACE2 mRNA表达,结果如图 3所示,1 000 ng/mL LPS处理HUVEC细胞6 h的模型组较空白对照组ACE2 mRNA表达水平显著降低了(26.31±2.19)%(P<0.01)。
|
| 1:空白对照组;2:模型组 图 3 RT-PCR检测各组HUVEC细胞ACE2 mRNA表达 |
采用Western blot检测ACE2蛋白表达,如图 4所示,模型组较空白对照组ACE2 蛋白表达水平显著降低了(37.33±3.50)%(P<0.01)。

|
| 1:空白对照组;2:模型组 图 4 Western blot检测各组HUVEC细胞的ACE2蛋白表达 |
采用ELISA检测Ang Ⅱ及Ang1-7的蛋白含量,模型组与空白对照组相比,其细胞上清中AngⅡ含量分别为空白对照组(38.71±4.88)pg/mL;模型组(91.70±8.33)pg/mL;同时细胞上清中Ang1-7含量分别为空白对照组(114.33±24.51)pg/mL;模型组(48.38±17.24)pg/mL。由此可见,与空白对照组相比,模型组中AngⅡ含量显著升高(P<0.01),同时细胞上清中Ang1-7含量则显著降低(P<0.05)。
2.5 血管内皮细胞中ICAM-1的含量如图 5所示,以1 000 ng/mL LPS处理HUVEC 6 h的损伤模型组细胞上清中ICAM-1含量较空白对照组显著升高(P<0.01),AT1受体拮抗剂氯沙坦钾处理组较模型组ICAM-1含量显著降低(P<0.01),Ang1-7特异性拮抗剂A779处理组则较空白对照组ICAM-1含量显著升高(P<0.05)。

|
| 1:空白对照组;2:模型组;3:氯沙坦组;4:A779组 a:P<0.05,b:P<0.01,与空白对照组比较;c:P<0.05,d:P<0.01,与模型组比较 图 5 ELISA检测各组HUVECs细胞中ICAM-1的含量 (n=3) |
近年来研究认为AS是心脑血管疾病发生的病理基础,是造成心脑血管疾病和死亡的主要因素[5]。VEC损伤及功能障碍则被认为是AS形成的开始。在高脂血症、高血压、吸烟、LPS、炎症介质、自由基等刺激下引起VEC损伤,随后活化的内皮细胞黏附分子表达急剧增加,使其介导单核细胞与内皮细胞黏附增加,继而在趋化因子的作用下,单核细胞迁移至内皮下形成炎症浸润[1]。LPS是革兰阴性细菌崩解后细胞壁释放的内毒素,是VEC损伤的强烈激活剂,可通过直接或间接的方式激活并损伤内皮细胞,引起VEC形态与功能的改变[6]。因此,本实验采用不同浓度LPS处理HUVEC细胞,诱导其损伤,结果如图 1、2所示,单核细胞黏附实验中采集的图像和 THP-1细胞黏附数量呈LPS浓度时间依赖性增加,在1 000 ng/mL时达最大效应,表明内皮细胞损伤模型构建成功。研究发现在HUVECs与THP-1黏附的过程中,黏附分子的表达起着决定性作用,在静息的VEC中,黏附分子呈低水平表达,经LPS处理后其表达急剧增加,在6~8 h时达到最大值并持续至24 h[7]。本实验结果也显示在LPS处理6 h时,单核细胞黏附数已较空白对照组显著增加,由此选择1 000 ng/mL LPS处理6 h作为建立内皮细胞损伤模型的最佳条件。
研究发现ACE2在AS形成和发展的病理过程中起着重要的作用[8]。Thomas等[9]报道载脂蛋白(apolipoprotein E,ApoE)缺乏的ACE2基因敲出小鼠较仅ApoE基因敲出的小鼠AS斑块面积显著增加,炎症反应显著增强。Thatcher等[10]进一步证实了与高脂饲养的低密度脂蛋白受体(low density lipoprotein receptor,LDLR)基因敲出小鼠腹膜巨噬细胞相比,LDLR及ACE2基因均敲出小鼠腹膜巨噬细胞炎症释放增加,对内皮细胞黏附增加。为进一步探讨ACE2在AS发展中对VEC的影响,本实验对HUVEC中ACE2蛋白及基因表达进行了检测,结果显示,与空白对照组比较,损伤模型组ACE2蛋白表达水平显著降低了(37.33±3.50)%,ACE2 mRNA表达水平显著降低了(26.31±2.19)%,该结果表明内皮损伤可能与ACE2表达降低相关,提示ACE2对血管内皮具有一定抗黏附作用。
近年来研究发现,羧肽酶ACE2的主要生理功能是将AngⅠ水解生成无活性的Ang1-9,以及将AngⅡ水解生成与之功能相拮抗的Ang1-7,其对后者的催化效率为前者的400倍[8]。同时,内皮细胞损伤的一个重要因素为局部组织ACE-AngⅡ-AT1轴激活,其核心成员AngⅡ不仅可以通过调节血流、升高血压介导AS的发生[2],还能通过致炎症作用、氧化应激增加、诱导内皮细胞凋亡等作用机制对血管内皮造成直接或间接的损伤[11]。而ACE2的催化产物Ang1-7通过与其自身特异性受体Mas相互作用,对抗AngⅡ产生的心血管系统中的氧化应激损伤,保护血管内皮。Yang等[12]报道Ang1-7处理ApoE敲出小鼠能减轻AS早期病变并增加血管斑块的稳定性。本实验结果显示,与空白对照组相比,ACE2 表达显著降低的损伤模型组细胞上清中AngⅡ含量显著升高,而Ang1-7含量则显著降低,进一步证实了ACE2对VEC的保护作用是通过水解损伤内皮的AngⅡ和催化生成对内皮具有保护作用的Ang1-7而间接实现的。
参与AS早期病理过程的黏附分子主要有选择素家族、免疫球蛋白超家族及整合素家组三大类,分别分布在不同细胞及细胞外基质中,互为受体和配体。其中免疫球蛋白超家族成员ICAM-1在介导单核细胞向内皮黏附、迁移的过程中起到了极其重要的作用 [13]。为了进一步探讨AngⅡ与Ang1-7是否参与HUVEC与THP-1细胞黏附的病理过程,本实验检测了各组黏附分子ICAM-1的含量。结果显示血管内皮被损伤激活后,ICAM-1及AngⅡ含量均显著升高。氯沙坦钾可以特异性阻断AngⅡ与AT1受体结合,阻止其下游通路的激活。实验结果显示经氯沙坦钾预处理后,ICAM-1含量较模型组显著降低。证实了AngⅡ亢进是VEC损伤模型中ICAM-1上调的机制之一,即AngⅡ可以增加ICAM-1的含量,从而发挥促黏附作用,与Liu等[14]研究证实AngⅡ通过激活重要的促炎NF-κB信号通路,上调ICAM-1在人脑微血管内皮细胞中表达的报道相一致。He等[15]研究表明Ang1-7含量升高的慢病毒转染ACE2过表达间充质细胞中ICAM-1的含量明显降低。为了进一步验证Ang1-7的抗黏附作用,本实验用Ang1-7特异性阻断剂A779预处理Ang1-7含量高且单核细胞黏附少的空白对照组,结果显示,A779组ICAM-1含量较空白对照组显著升高,提示Ang1-7可以降低ICAM-1的含量,进而发挥其抗黏附作用。关于AngⅡ与Ang1-7参与ICAM-1表达调控的具体信号通路,目前尚不十分明确,还需进一步探索。
综上所述,ACE2具有一定的抗黏附作用,其作用机制可能与降低AngⅡ含量,升高Ang1-7含量,从而间接地下调ICAM-1水平相关。
| [1] | Libby P, Ridker P M, Hansson G K. Progress and challenges in translating the biology of atherosclerosis[J]. Nature, 2011, 473(7347): 317-325. |
| [2] | Hillaert M A, Lentjes E G, Beygui F, et al. Measuring and targeting aldosterone and renin in atherosclerosis-a review of clinical data[J]. Am Heart J, 2011, 162(4): 585-596. |
| [3] | Donoghue M, Hsieh F, Baronas E, et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9[J]. Circ Res, 2000, 87(5): E1-E9. |
| [4] | Iwai M, Horiuchi M. Role of the ACE2/angiotensin1-7/Mas axis in the cardiovascular system[J]. Hypertens Res, 2010, 33(11): 1108-1109. |
| [5] | Peters S A, den-Ruijter H M, Bots M L, et al. Improvements in risk stratification for the occurrence of cardiovascular disease by imaging subclinical atherosclerosis: a systematic review[J]. Heart, 2012, 98(3): 177-184. |
| [6] | Arshinov A B, Maslova I G. Role of the infection and inflammation in atherosclerosis development (literature review)][J]. Angiol Sosud Khir, 2010, 17(1): 35-41. |
| [7] | Holthe M R, Andersson Y, Lyberg T. Lack of proinflammatory effects of free fatty acids on human umbilical cord vein endothelial cells and leukocytes[J]. Acta Obstet Gynecol Scand, 2005, 84(7): 672-678. |
| [8] | Ferreira A J, Bader M, Santos R A. Therapeutic targeting of the angiotensin-converting enzyme 2/Angiotensin-(1-7)/Mas cascade in the renin-angiotensin system: a patent review[J]. Expert Opin Ther Pat, 2012, 22(5): 567-574. |
| [9] | Thomas M C, Pickering R J, Tsorotes D, et al. Genetic Ace2 deficiency accentuates vascular inflammation and atherosclerosis in the ApoE knockout mouse[J]. Circ Res, 2010, 107(7): 888- 897. |
| [10] | Thatcher S E, Zhang X, Howatt D A, et al. Angiotensin-converting enzyme 2 deficiency in whole body or bone marrow-derived cells increases atherosclerosis in low-density lipoprotein receptor-/- mice[J]. Arterioscler Thromb Vasc Biol, 2011, 31(4): 758-765. |
| [11] | Rabelo L A, Alenina N, Bader M. ACE2-angiotensin-(1-7)-Mas axis and oxidative stress in cardiovascular disease[J]. Hypertens Res, 2011, 34(2): 154-160. |
| [12] | Yang J M, Dong M, Meng X, et al. Angiotensin-(1-7) dose-dependently inhibits atherosclerotic lesion formation and enhances plaque stability by targeting vascular cells[J]. Arterioscler Thromb Vasc Biol, 2013, 33(8): 1978-1985. |
| [13] | Breen L T, McHugh P E, Murphy B P. HUVEC ICAM-1 and VCAM-1 synthesis in response to potentially athero-prone and athero-protective mechanical and nicotine chemical stimuli[J]. Ann Biomed Eng, 2010, 38(5): 1880-1892. |
| [14] | Liu H Q, Wei X B, Sun R, et al. Angiotensin Ⅱ stimulates intercellular adhesion molecule-1 via an AT1 receptor/nuclear factor-kappaB pathway in brain microvascular endothelial cells[J]. Life Sci, 2006, 78(12): 1293-1298. |
| [15] | He H L, Liu L, Chen Q H, et al. MSCs modified with ACE2 restore endothelial function following LPS challenge by inhibiting the activation of RAS[J]. J Cell Physiol, 2015, 230(3): 691-701. |



