2 生物医学工程学院,省部共建超声医学工程国家重点实验室
2 State Key Laboratory of Ultrasound Engineering in Medicine Co-founded by Chongqing and Ministry of Science and Technology,College of Biomedical Engineering,Chongqing Medical University,Chongqing,400016,China
高强度聚焦超声(high intensity focused ultrasound,HIFU)是局部非入侵性治疗中晚期癌症的方法[1]。HIFU将超声波汇聚于靶区组织,引起靶区瞬态温升(>65 ℃)和空化效应,使靶区蛋白质变性,组织凝固性坏死,而对周围正常组织无损伤,具有微创、靶向特点[2,3]。目前国内外关于HIFU的研究集中于生物学焦域、影像学变化,而关于HIFU治疗后引起的 炎症反应和血清中炎症因子变化情况研究较少。IL-6和IL-10 主要由2型辅助性T淋巴细胞(Th2)产生,IL-6能够促进肺癌、结肠癌、肝癌等的生长与转移[4,5];IL-10是一个著名的免疫调节和抗炎细胞因子,抑制肿瘤的进展,而缺乏IL-10可以抑制抗肿瘤免疫力,有利于肿瘤生长[6]。本研究采用HIFU治疗小鼠结直肠癌皮下瘤,观察肿瘤组织病理学变化,检测肿瘤组织和血清中促炎因子IL-6、抑炎因子IL-10的表达变化,为HIFU临床应用提供更多实验依据。
1 材料与方法 1.1 主要仪器及试剂RPMI1640完全培养基(HyClone公司)、10%特级胎牛血清(hyClone公司)、1%青链霉素(HyClone公司)、TRIzol(Invitrogen公司,美国)、RT-PCR反应试剂(TaKaRa公司)、PCR显影仪(Bio-Rad,美国)、鼠源ELISA试剂盒IL-6、IL-10(北京四正柏生物技术公司)、 无毒环保苏木精-伊红(H-E)染液(南京建成生物工程研究所)、普通正置光学显微镜(尼康)、组织切片机(德国徕卡RM2235)、病理组织漂烘处理仪(PHY-Ⅲ 型,国产)、海扶JC200型聚焦超声肿瘤治疗系统(图 1)由重庆医科大学超声工程研究所自行设计研制,重庆海扶公司生产,该系统由5部分组成:海扶超声聚焦刀,由主机、运动系统、控制台统、功率源及水处理系统几部分组成,治疗头1.0 MHz。
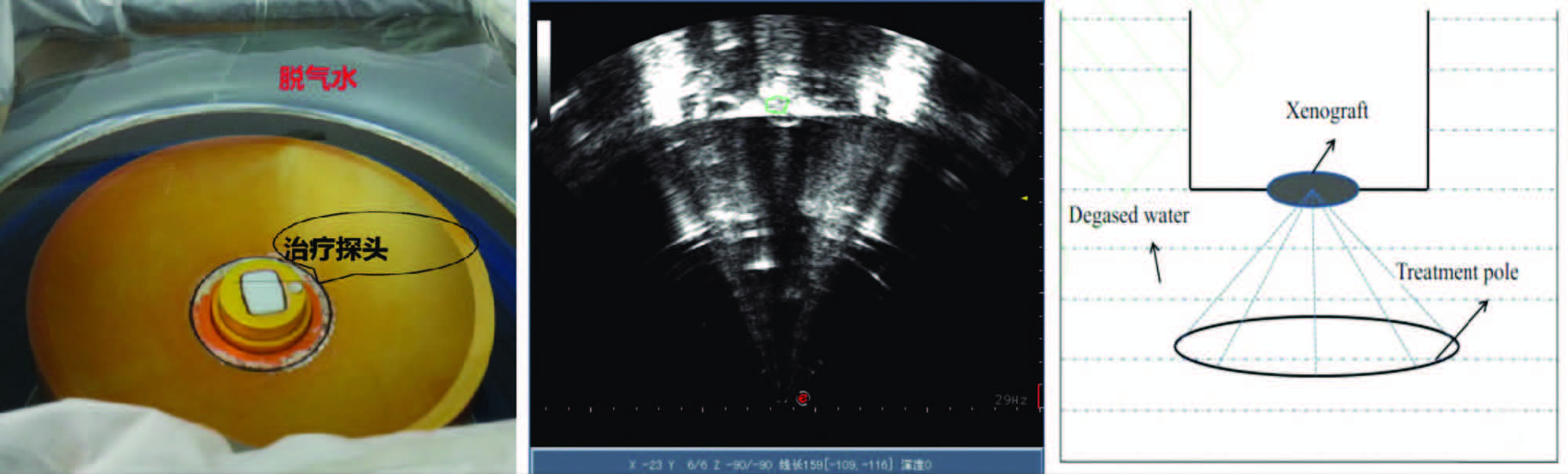
|
| A:治疗探头;B:B超监测治疗;C:治疗示意图 图 1 高强度聚焦超声(HIFU)治疗系统 |
BABL/c雌性小鼠60只,6~8周龄,质量16.5~18 g,购自重庆医科大学实验动物中心[实验动物等级:SPF级,合格证号SCXK(渝)],标准饲料喂养,自由饮水。CT-26肿瘤细胞株(BABL/c小鼠来源的结直肠癌细胞,由本实验室保存)。
1.3 方法 1.3.1 细胞培养小鼠CT-26结直肠癌细胞在含10%胎牛血清1640培养基,置于37 ℃、5% CO2 孵箱中培养。
1.3.2 BABL/c小鼠结直肠癌移植瘤模型的建立、分组及治疗方式用0.25%胰蛋白酶消化呈单个的CT-26 细胞,调整细胞数至 1×107/mL,在60只小鼠右侧后部皮下接种细胞悬液 0.1 mL。待小鼠皮下瘤直径为0.8~1.2 cm时,使用JC-200肿瘤治疗系统,输入治疗参数(治疗频率1.0 MHz,功率为80 W,总计时间6 s)。对照组不给予任何处理。对照组、HIFU治疗后1、3、5、7、14 d各取10 只小鼠,眼球取血后,断颈法处死小鼠,剥离肿瘤组织,PBS冲洗,置于4%多聚甲醛溶液固定。
1.3.3 HE染色观察各组肿瘤组织的病理变化标本置于4%多聚甲醛溶液固定48 h后,给予常规脱水,透明浸蜡和包埋。石蜡切片,厚约 5 μm。每组标本取5片HE染色,光镜下观察。
1.3.4 RT-PCR检测肿瘤组织IL-6、IL-10 mRNA的表达取新鲜的残余肿瘤组织约50 mg,PBS冲洗,置于液氮中,然后碾磨成粉末,加入800 μL TRIzol试剂裂解细胞,按常规方法提取组织中的RNA。逆转录参照大连宝生物公司提供的25 μL反转录体系。聚合酶链反应体系10 μL,PCR反应条件94 ℃预变性2 min,扩增94 ℃ 1 min、退火56 ℃ 15 s、72度延伸60 s、总计33循环、72 ℃延伸5 min;扩增产物于TBE缓冲液电 泳120 V,15 min,PCR成像仪显影。引物序列鼠源IL-6: 上游5′-TGCTGGTGACAACCACGGC-3′,下游5′-GTAC-TCCAGAAGACCAGAGG-3′;产物长度308 bp。鼠源IL-10:上游5′-CCCTTTGCTATGGTGTCCTT-3′,下游5′-TGGTTTCTCTTCCCAAGACC-3′;产物长度97 bp。鼠源GAPDH:上游5′-GGCTGCCCAGAACATCT-3′,下游5′-CGGACACATTGGGGGTAG-3′,产物长度122 bp。
1.3.5 细胞因子检测采用ELISA试剂盒检测血清中IL-6、IL-10水平,具体步骤按照北京四正柏生物技术公司说明书操作。
1.4 统计学分析采用SPSS 18.0统计软件进行分析,计量资料均用x±s表示,采用单因素方差分析,组间有差异进一步比较采用SNK-q检验。
2 结果 2.1 移植瘤治疗后的肉眼改变HIFU照射1 d治疗区为灰白色无光泽凝固性坏死区,呈椭圆形,周围有明显出血带,边界清楚;5 d后呈境界清晰的红黑色凝固性坏死灶,周围肿瘤组织水肿出血减少;14 d坏死灶周围形成纤维索,病变开始缩小(图 2)。

|
| A:HIFU治疗1 d 箭头示灰白色是凝固性死,出现出血和水肿;B:HIFU治疗5 d 消融区由红黑色坏死,周围区出血水肿逐渐消退;C:HIFU治疗后14 d 箭头示消融区的变化 图 2 肉眼观察HIFU治疗后肿瘤的变化 |
显微镜下观察显示,对照组各细胞体积形态均一,胞浆无明显空泡(图 3A);HIFU治疗1 d后,治疗中央区瘤细胞发生凝固性坏死,坏死区内肿瘤细胞体积变小,肿瘤细胞外形结构尚存,见少量空泡样结构零星散布于胞浆内,消融区可见散在的炎性细胞(图 3B);3 d靶区肿瘤组织内形成境界明显的坏死区,细胞间隙增大,其内仍可见大量核固缩的肿瘤细胞并见明显的细胞碎片,可见大量红细胞,并且出现炎性细胞的浸润(图 3C);5 d核碎裂明显增多,坏死靶区内可见核碎片被组织溶解吸收(图 3D);7 d细胞核碎屑也被组织溶解吸收溶解而消失(图 3E);14 d有纤维包裹及炎症细胞浸润(图 3F)。

|
| A:对照组;B~F:分别为HIFU治疗后1、3、5、7、14 d 图 3 HIFU治疗后不同时间点肿瘤组织病理组织学变化(HE ×400) |
与对照组相比,HIFU治疗组IL-6、IL-10的表达分别于3 d、5 d达到最高(P<0.05,图 4),之后逐渐下降,随时间变化表现为先上升后下降的趋势。HIFU治疗后14 d后与对照组相比,IL-6的表达有明显的下降,而IL-10 的基本没有变化。

|
| 1:对照组;2:治疗后1 d;3:治疗后3 d;4:治疗后5 d;5:治疗后7 d;6:治疗后14 d 图 4 RT-PCR检测治疗前后不同组残余组织IL-6和 IL-10的变化 |
如图 5所示,血清中细胞因子IL-6和IL-10均表现为先增高,后降低的趋势。与对照组相比,HIFU治疗后检测1、3、5、7 d IL-6的表达均明显升高(P<0.05);而在HIFU治疗后14 d检测,IL-6的表达水平较对照组明显下降 (P<0.05)。HIFU治疗后1、3 d IL-10的浓度较对照组显著升高(P<0.05),而在5、7、14 d IL-10的浓度与对照组相比差异无统计学意义(P>0.05)。
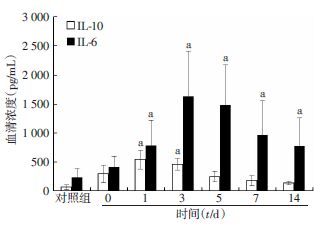
|
| a:P<0.05,与对照组(0 d)比较 图 5 HIFU治疗前后各组血清中IL-6和IL-10浓度变化 |
本研究所使用的HIFU治疗系统由超声实施全程监控,确保治疗区域覆盖瘤体(图 1)。本研究证实,HIFU消融后靶区组织随时间的变化表现出水肿、出血、坏死的过程(图 2)。HIFU 治疗后于第3、5、7、14天取材发现,HE染色观察发现,靶区组织有不同程度炎症细胞的浸润,成纤维细胞的增生(图 3)。证实了HIFU不仅能有效的摧毁靶区的肿瘤细胞,还出现了以炎症细胞浸润为主的炎症反应。
研究证实,热消融治疗肿瘤能够在体内摧毁肿瘤细胞同时诱导机体产生炎症反应,而炎症却在肿瘤发展的各个阶段,包括启动、进展和转移起了很重要作用[7, 8, 9, 10]。IL-6和IL-10主要由Th2型淋巴细胞产生。本研究证实HIFU治疗3后,血清I-L6和IL-10水平达到升高峰,光镜下显示肿瘤组织区有不同程度的炎症细胞浸润,这提示早期浸润的炎症细胞主要是Th2型淋巴细胞。
HIFU治疗可以诱导系统性IL-6水平升高,通过体循环IL-6可以刺激存在于消融区域边缘或者离消融区域较远的区域有活性的肿瘤细胞进行增殖。那么在HIFU治疗后,可通过辅助疗法来降低IL-6的水平,提高IL-10的表达水平,同时影响这些基因的下游靶基因的水平(如STAT3),从而有效减少局部复发及远处转移率[11, 12, 13, 14, 15]。IL-6和IL-10是开发辅助疗法的两个较为有潜力的靶点,而这种辅助疗法可以加强HIFU治疗肿瘤疗效。此外,由于热消融引起血液和消融区域的淋巴细胞数目增加,那么免疫治疗策略就是针对Th2淋巴细胞(产生IL-6)向Th1淋巴细胞(促进细胞诱导的肿瘤杀伤作用)转变,这对以后进一步研究较为有用[16, 17, 18]。我们发现HIFU治疗后,IL-6和IL-10的表达水平有不同程度的升高,
综上所述,HIFU能有效地摧毁小鼠结直肠癌的皮下瘤。HIFU 治疗后早期残余肿瘤组织及外周血中IL-6 和IL-10表达先明显上升,而早期IL-6和IL-10表达量的变化影响到HIFU治疗后残余肿瘤组织的生长速度。因此,IL-6和IL-10既可以作为HIFU治疗后早期辅助疗法的靶点,也可作为监测HIFU治疗效果观察的指标。
| [1] | Zhou Y F. High intensity focused ultrasound in clinical tumor ablation[J]. World J Clin Oncol, 2011, 2(1): 8-27. |
| [2] | 刘贤伟, 张建华, 杨阳, 等.高强度聚焦超声在结直肠癌肝转移治疗中的研究现状[J]. 肝胆外科杂志, 2014, 22(1): 42-45. |
| [3] | Yu W, Tang L, Lin F, et al. High-intensity focused ultrasound: Noninvasive treatment for local unresectable recurrence of osteosarcoma[J]. Surg Oncol, 2014, 24(1): 9-15. |
| [4] | Yao Z, Fenoglio S, Gao D C, et al. TGF-beta IL-6 axis mediates selective and adaptive mechanisms of resistance to molecular targeted therapy in lung cancer[J]. Proc Natl Acad Sci USA, 2010, 107(35): 15535-15540. |
| [5] | 彭晔, 张旭刚, 郑运田, 等. 白细胞介素6与恶性肿瘤关 系的临床研究进展[J]. 临床荟萃, 2012, 27(14): 1281- 1284. |
| [6] | Acuner-Ozbabacan E S, Engin B H, Guven-Maiorov E, et al. The structural network of Interleukin-10 and its implications in inflammation and cancer[J]. BMC Genomics, 2014, 15(Suppl 4): S2. |
| [7] | Wah T M, Arellano R S, Gervais D A, et al. Image-guided percutaneous radiofrequency ablation and incidence of post-radiofrequency ablation syndrome: prospective survey[J]. Radiology, 2005, 237(3): 1097-1102. |
| [8] | Broughton G 2nd, Janis J E, Attinger C E. Wound healing: an overview[J]. Plast Reconstr Surg, 2006, 117(7 Suppl): 1e-S-32e-S. |
| [9] | Ahmad F, Gravante G, Bhardwaj N, et al. Changes in interleukin-1beta and 6 after hepatic microwave tissue ablation compared with radiofrequency, cryotherapy and surgical resections[J]. Am J Surg, 2010, 200(4): 500-506. |
| [10] | Muangchant C, Pope J E. The significance of interleukin-6 and C-reactive protein in systemic sclerosis: a systematic literature review[J]. Clin Exp Rheumatol, 2013, 31(2 Suppl 76): 122-134. |
| [11] | Gabrysova L, Howes A, Saraiva M, et al. The regulation of IL-10 expression[J]. Curr Top Microbiol Immunol, 2014, 380: 157-190. |
| [12] | Grivennikov S, Karin E, Terzic J, et al. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer[J]. Cancer Cell, 2009, 15(2): 103-113. |
| [13] | Hsia C Y, Huo T I, Chiang S Y, et al. Evaluation of interleukin-6, interleukin-10 and human hepatocyte growth factor as tumor markers for hepatocellular carcinoma[J]. Eur J Surg Oncol, 2007, 33(2): 208-212. |
| [14] | Draskovic-Pavlovic B, Vucevic D, Bozic B, et al. Functional properties of granulocytes after thermal injury[J]. Immunol Res, 2012, 52(1/2): 133-138. |
| [15] | Shao D D, Suresh R, Vakil V, et al. Pivotal Advance: Th-1 cytokines inhibit, and Th-2 cytokines promote fibrocyte differentiation[J]. J Leukoc Biol, 2008, 83(6): 1323-1333. |
| [16] | Hofmann U, Beyersdorf N, Weirather J, et al. Activation of CD4+ T lymphocytes improves wound healing and survival after experimental myocardial infarction in mice[J]. Circulation, 2012, 125(13): 1652-1663. |
| [17] | Wan S, Zhao E, Kryczek I, et al. Tumor-associated macrophages produce interleukin 6 and signal via STAT3 to promote expansion of human hepatocellular carcinoma stem cells[J]. Gastroenterology, 2014, 147(6): 1393-1404. |
| [18] | Waitz R, Solomon S B, Petre E N, et al. Potent induction of tumor immunity by combining tumor cryoablation with anti-CTLA-4 therapy[J]. Cancer Res, 2012, 72(2): 430- 439. |



