2.233030 安徽蚌埠,蚌埠医学院烧伤整形科
2.Department of Burn and Plastic Surgery, Affiliated Hospital of Bengbu Medical College, Bengbu, Anhui Province, 233030, China
皮肤的损伤修复需要表皮细胞不断增殖迁移以维持皮肤表面完整性。而间充质干细胞(mesenchymal stem cells,MSCs)具有高度自我更新能力和多向分化潜能,能向多种细胞及组织分化以修复缺损,尤其向表皮细胞的转化已被应用于创面组织的修复[1, 2, 3, 4]。研究证实,小鼠或人类等不同物种的MSCs均可在一定条件下分化为表皮细胞[5, 6, 7, 8]。我们既往研究发现创面组织内MSCs与创面局部骨桥蛋白(Osteopontin,OPN)的高表达密切相关,两者在体内体外的定位存在关联性[1]。骨桥蛋白又称为分泌磷酸蛋白l(secreted phos.phoprotein 1,SPP1)、骨唾液酸蛋白I(bonesialoprotein I)和尿石蛋白(urinary stone protein),属于细胞外基质(extracelluar matrix,ECM)蛋白,在血液、心肌组织、肾脏、骨骼、脑组织等不同的组织细胞中均有所发现。研究证明OPN对炎性细胞、成纤维细胞、表皮细胞、内皮细胞等促进愈合细胞的调控发挥重要作用[2]。OPN调控创面愈合的多个关键环节,但对MSCs向表皮细胞转化的研究很少,在创面愈合中的作用尚不明确。
本研究从野生型(WT)和OPN-/-(KO)小鼠的骨髓分离并培养MSCs,应用已建立的MSCs表皮诱导分化体系,诱导其分化为表皮细胞;以免疫荧光、流式细胞术以及Western blot等方法检测OPN的表达与MSCs分化为表皮细胞的效率之间的关系,并通过动物实验研究OPN在MSCs向表皮细胞转化、促进创面愈合过程中的作用,为临床损伤修复提供新的理论依据与治疗手段。
1 材料与方法 1.1 动物及试剂雄性骨桥蛋白基因敲除(KO)小鼠(美国Jackson公司)和野生型(WT)C57/BL6小鼠(大坪医院野战外科研究所实验动物中心),各16只,体质量20~25 g,WT-GFP-C57BL/6新生鼠用于分离培养GFP-MSCs,由大坪医院野战外科研究所实验动物中心提供。饲养条件:20~25 ℃,充足的水和食物。实验过程中对动物的处理符合医学伦理学标准。实验试剂:MSCs培养基(赛业广州公司);重组HGF、IGF-I、FGF (美国Peprotech公司),CD34-FITC、CD105-PE(美国Ebioscience公司);兔抗小鼠单克隆CK14抗体(美国Abcam公司)等。
1.2 方法 1.2.1 MSCs原代提取培养取KO及WT新生小鼠(鼠龄1 d),75%乙醇浸泡5 min,冷无菌PBS冲洗,剪下四肢,剔出长骨,完全剪碎骨组织,加入BMSCs完全培养液,重悬、混匀后转移至无菌塑料培养瓶,于37 ℃,5%CO2的恒温培养箱培养,24 h后换液去除组织块,每3~4天传代一次。
1.2.2 MSCs纯度流式检测及OPN鉴定收集WT及KO两组P3细胞,计数分装于EP管内,5×105/管,300×g离心5 min后100 μL PBS重悬。设置分组:空白对照、CD105-PE单染、CD34-FITC单染、CD105-PE及CD34-FITC双染(n=3),按分组分别加入2 μL抗体,4℃孵育1 h,加入900 μL PBS,300×g室温离心5 min,弃上清加入PBS 300 μL,吹打混匀后转移至流式管内,流式细胞术检测CD105及CD34的表达情况。全蛋白提取试剂盒提取WT组和KO组MSCs的蛋白,经Western blot鉴定其OPN的表达。
1.2.3 MSCs体外表皮细胞诱导分化取第3代WT和KO MSCs,终止消化,离心,重悬,调整细胞至1×106/mL,取1 mL加入表皮转化培养体系(F12-DMEM+2%FBS +10 ng/mL IGF-I+20 ng/mL HGF+10 ng/mL b-FGF +100 U/mL青霉素+100 U/mL 链霉素),接种于培养瓶,放入37 ℃、5% CO2培养箱,每3 d 换液1次,每日镜下观察细胞形态变化至第17天。
1.2.4 MSCs体外诱导分化后流式细胞术检测收集诱导分化第12、17天的两组细胞,5×105cell/管,4%多聚甲醛100 μL室温20 min,0.05%Triton 100 μL室温10 min,滴加一抗CK14(1 ∶100)40~50 μL,37 ℃ 60 min,滴加40~50 μL荧光二抗(山羊抗鼠IgG),37 ℃ 30 min,每两步间均PBS清洗,300×g室温离心5 min。最后弃上清加入PBS 300 μL,吹打混匀后流式细胞术检测。
1.2.5 MSCs体外诱导分化后CK14免疫荧光染色取第3代WT和KO MSCs,终止消化、离心、重悬、稀释形成密度为1×106/mL 的液体,取100 μL置于放有细胞爬片的12孔板内,加入诱导培养体系,17 d后取出爬片,温热PBS清洗、多聚甲醛固定,3%BSA室温封闭1 h,滴加一抗CK14(1 ∶500)4 ℃过夜,滴加荧光二抗(山羊抗鼠IgG)37 ℃孵育1 h,DAPI染核,封片,立即在共聚焦显微镜下观察。
1.2.6 MSCs体外诱导分化后Western blot检测CK14表达情况诱导分化的第17天,提取WT组和KO组的细胞总蛋白,BCA法测浓度后,8%的聚丙烯酰胺 凝胶按每孔等量30 μg上样,积层胶80 V,分离胶120 V 电泳,100V转膜90 min,转好的PVDF膜5%BSA封闭1 h,CK14(1 ∶300)、β-actin(1 ∶1 000)一抗孵育,4 ℃振荡过夜。TBST洗涤后滴加二抗(1 ∶1 000),37 ℃孵育1 h,显影成像。Imagej分析软件扫描特异性条带净灰度值后β-actin作为内参,计算两者比值分析蛋白相对表达量。
1.2.7 创面模型建立及GFP-MSCs创周注射创面模型建立:将4组小鼠以1%戊巴比妥150 μL腹腔注射麻醉,脱毛膏脱去背部毛发,勿伤及皮肤,碘伏消毒2次后,打孔器在小鼠背部形成直径0.5 cm深达筋膜层的创面[9]。GFP-MSCs创周注射:取新生1 d的WT-GFP小鼠,培养的第3代GFP-MSCs以PBS重悬形成5×105/50 μL的细胞悬液,在距离创缘0.5 cm处分别均匀注射于WT/MSCs组和KO/MSCs组小鼠,同时以等量的PBS注射于WT/PBS组和KO/PBS组小鼠作为对照。实验后1、3、5、7 d创面拍照,计算创面愈合百分率[创面愈合百分率=(初始创面面积-观察日创面面积)÷初始创面面积×100%],并切取创面组织做组织切片免疫荧光染色检测MSCs向表皮细胞分化情况。
1.3 统计学分析实验重复3次以上,数据以x ±s表示,使用SPSS 13.0统计分析软件分析,两组间比较用t检验。
2 结果 2.1 原代培养的MSCs形态学特征、流式细胞术鉴定及OPN表达检测原代培养的细胞镜下见胞体呈多边形,较小,呈放射状集落生长;随着细胞生长,贴壁细胞逐渐增大,呈成纤维细胞样。MSCs的特征为CD105阳性,而CD34阴性。本实验MSCs的CD105阳性而CD34阴性表达率为:WT组94.04%、KO组91.57% ,鉴定结果提示培养的细胞为高纯度MSCs。Western blot结果示野生型小鼠MSCs表达OPN,而OPN-/-小鼠MSCs不表达OPN蛋白(图 1)。
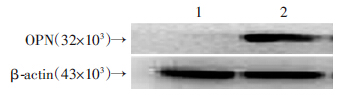 |
| 1:KO组;2:WT组 图 1 Western blot检测两组MSCs OPN蛋白的表达 |
MSCs细胞贴壁生长。培养第12天部分长梭形细胞形态由梭形逐渐变扁变宽,第17天时细胞呈现出典型的铺路石样改变(图 2),符合表皮分化的特点。
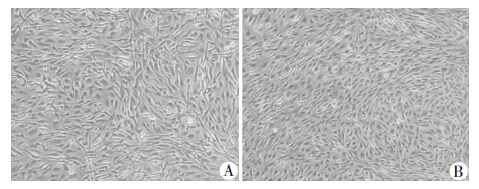 |
| A:KO组;B:WT组 图 2 两组MSCs诱导分化第17天的形态学观察(倒置显微镜 ×100) |
WT组和KO组的细胞均有表皮细胞标记CK14 表达,表明MSCs向表皮诱导分化成功。第12天时两组表皮分化率分别为: KO组31.67%、WT组37.88%;第17天时分别为:KO组63.84%、WT组90.40%。
2.4 免疫荧光检测两组MSCs诱导分化后CK14表达第17天免疫荧光检测发现,WT组和KO组的细胞均表达CK14,表明MSCs向表皮诱导分化,WT组CK14的表达阳性比率(0.936 3±0.009 5),明显高于KO组[(0.647 5±0.023 1),(P<0.01,图 3)]。
 |
| 图 3 两组MSCs诱导分化第17天CK14免疫荧光染色(激光共聚焦显微镜 ×400) |
WT组CK14蛋白的表达为(0.614 6±0.015 3),KO组(0.389 4±0.016 8),WT组明显高于KO组(P<0.01,图 4)。
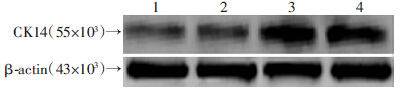 |
| 1、2:KO组;3、4:WT组 图 4 Western blot检测两组MSCs诱导分化第17天CK14的表达 |
伤后1、3、5、7天创面拍照计算创面愈合百分率,以注射PBS的野生型小鼠为对照,注射PBS的敲基因小鼠创面愈合率较前者低(P<0.05),OPN在创面愈合过程具有重要作用;同样以注射PBS的野生型小鼠为对照,注射MSCs的野生型小鼠创面愈合率较注射PBS的高(P<0.05),注射的MSCs能够加速创面的愈合(图 5,表 1)。第3、5、7天免疫荧光染色,注射入创面内的MSCs表达表皮标志物CK14,KO/MSCs组表达弱于WT/MSCs组(P<0.05),MSCs在创面内分化成为了表皮细胞参与创面修复(图 6,表 2)。
 |
| 1、2:KO组;3、4:WT组 图 5 4组小鼠创面不同时间愈合的大体观察 |
 |
| 1、2:KO组;3、4:WT组 图 6 两组小鼠创面第7天CK14表达情况(共聚焦显微镜 ×200) |
| 组别 | 1 d | 3 d | 5 d | 7 d |
| WT/PBS组 | 21.64±4.90 | 37.55±4.97 | 58.53±1.59 | 65.02±3.11 |
| KO/PBS组 | 14.17±2.45a | 26.85±3.40a | 43.66±3.67a | 58.02±2.56a |
| KO/MSCs组 | 20.79±3.60 | 44.10±6.35 | 58.52±6.33 | 69.07±3.06 |
| WT/MSCs组 | 39.47±3.87a | 60.17±2.53a | 71.11±1.87a | 80.53±3.13a |
| a:P<0.05,与WT/PBS组比较 | ||||
| 组别 | 3 d | 5 d | 7 d | |
| KO/MSCs组 | 1.032 5±0.124 5a | 1.025 0±0.091 5a | 1.032 5±0.053 2a | |
| WT/MSCs组 | 1.227 5±0.140 0 | 1.387 5±0.136 5 | 1.877 5±0.257 3 | |
| a:P<0.05,与WT/MSCs比较 | ||||
大面积深度皮肤创伤、自体皮皮源十分缺乏的患者,上皮化不足是创面难以愈合的关键。研究认为,以MSCs为种子细胞,应用组织工程皮肤修复创面可以较好地解决皮源供给以及皮肤结构、功能重建等问题。MSCs经过体外扩增、纯化后仍然保持细胞的生物学特性,并能分化为多种类型的细胞[12, 13, 14]。EGF 可诱导MSCs向皮肤组织分化,将两者复合移植用于猪创面缺损模型,形成的表皮层厚、角化分层明显,MSCs细胞可使经久不愈的创面表皮化,达到愈合重建[15]。大量资料说明,MSCs能分化为表皮细胞。
OPN是在多种细胞中广泛表达的一种分泌型糖蛋白,参与细胞的多种生理病理过程。OPN高表达于创面内,趋化MSCs向创面迁移。在创面愈合的关键环节中具有多功能调控的功能,对炎性细胞、成纤维细胞、表皮细胞、内皮细胞等促进愈合的功能调控发挥重要作用[16]。细胞分泌OPN后,可动员骨髓MSCs增殖分化参与修复,比如分化为成纤维细胞。但是目前对此修复过程MSCs参与过程和机制的报道较少,难以 说明OPN调控MSCs的重要[15]。本研究主要目的在于探究创面修复过程中OPN与MSCs上皮化之间的关系。
本研究发现,用MSCs的专用培养基,新生1 d的小鼠采用骨组织贴壁法培养的MSCs细胞活性好、纯度高,能够稳定传代。通过体外对野生型(WT)和OPN-/-(KO)小鼠的MSCs进行表皮诱导,经多种方法对比分析,WT组和KO组的细胞均表达CK14,表明MSCs向表皮诱导分化,WT组表皮标志物CK14的表达阳性比率明显高于KO组,两组存在明显差异,证明了OPN基因表达降低后MSCs的表皮分化能力下降。动物实验表明敲除OPN基因后创面愈合的速度与正常小鼠相比明显减慢了。
总之,本研究发现MSCs在体内、体外可诱导分化为表皮细胞,进而促进创面愈合,OPN可能在其中发挥了重要作用,但是OPN诱导MSCs向表皮细胞分化的作用机制尚不清楚,可能为创面愈合过程中各种因素共同作用的结果。继续研究OPN诱导MSCs促进创面愈合的信号传导通路,可完善其具体机制。
| [1] | Li M, Yu J, Li Y, et al. CXCR4+ progenitors derived from bone mesenchymal stem cells differentiate into endothelial cells capable of vascular repair after arterial injury[J]. Cell Reprogram, 2010, 12(4): 405-415. |
| [2] | Hisada K, Hata K, Ichida F, et al. Retinoic acid regulates commitment of undifferentiated mesenchymal stem cells into osteoblasts and adipocytes[J]. J Bone Miner Metab, 2013, 31(1): 53-63. |
| [3] | Barba M, Cicione C, Bernardini C, et al. Adipose-derived mesenchymal cells for bone regereneration: state of the art[J]. Biomed Res Int, 2013, 2013: 416391. |
| [4] | Huang K, Kang X, Wang X, et al. Conversion of bone marrow mesenchymal stem cells into type Ⅱ alveolar epithelial cells reduces pulmonary fibrosis by decreasing oxidative stress in rats[J]. Mol Med Rep, 2015, 11(3): 1685- 1692. |
| [5] | Knoll A, Brockmeyer T, Chevalier R, et al. Adult rat bone marrow-derived stem cells promote late fetal type Ⅱ cell differentiation in a co-culture model[J]. Open Respir Med J, 2013, 7: 46-53. |
| [6] | Rohaina C M, Then K Y, Ng A M, et al. Reconstruction of limbal stem cell deficient corneal surface with induced human bone marrow mesenchymal stem cells on amniotic membrane[J]. Transl Res, 2014, 163(3): 200-210. |
| [7] | Jiang T S, Cai L, Ji W Y, et al. Reconstruction of the corneal epithelium with induced marrow mesenchymal stem cells in rats[J]. Mol Vis, 2010, 16: 1304-1316. |
| [8] | Li W, Ye B, Cai X Y, et al. Differentiation of human umbilical cord mesenchymal stem cells into prostate-like epithelial cells in vivo[J]. PLoS One, 2014, 9(7): e102657. |
| [9] | Meng H, Wang Z, Wang W, et al. Effect of osteopontin in regulating bone marrow mesenchymal stem cell treatment of skin wounds in diabetic mice[J]. Diabetes Metab Res Rev, 2014, 30(6): 457-466. |
| [10] | Pacini S, Petrini I. Are MSCs angiogenic cells? New insights on human nestin-positive bone marrow-derived multipotent cells[J]. Front Cell Dev Biol, 2014, 2: 20. |
| [11] | Liu X, Wang J A, Ji X Y, et al. Preconditioning of bone marrow mesenchymal stem cells by prolyl hydroxylase inhibition enhances cell survival and angiogenesis in vitro and after transplantation into the ischemic heart of rats[J]. Stem Cell Res Ther, 2014, 5(5): 111. |
| [12] | Gomathysankar S, Halim A S, Yaacob N S. Proliferation of keratinocytes induced by adipose-derived stem cells on a chitosan scaffold and its role in wound healing, a review[J]. Arch Plast Surg, 2014, 41(5): 452-457. |
| [13] | Hassan W U, Greiser U, Wang W. Role of adipose-derived stem cells in wound healing[J]. Wound Repair Regen, 2014, 22(3): 313-325. |
| [14] | Kim W S, Park B S, Sung J H, et al. Wound healing effect of adipose-derived stem cells: a critical role of secretory factors on human dermal fibroblasts[J]. J Dermatol Sci, 2007, 48(1): 15-24. |
| [15] | Badiavas E V, Falanga V. Treatment of chronic wounds with bone marrow-derived cells[J]. Arch Dermatol, 2003, 139(4): 510-516. |
| [16] | Dabiri G, Heiner D, Falanga V. The emerging use of bone marrow-derived mesenchymal stem cells in the treatment of human chronic wounds[J]. Expert Opin Emerg Drugs, 2013, 18(4): 405-419. |



