乳腺癌是危及女性身心健康的恶性肿瘤之一,发病率占各种恶性肿瘤的7%~10%。调查数据显示,全球每年有120万女性罹患乳腺癌,且有50万人死于此病[1]。乳腺癌发生远端转移是乳腺癌患者主要的致死原因,但乳腺癌转移的具体机制目前尚未明确。
miRNA是一类长度为18~24个核苷酸的内源性非编码单链小分子RNA,它们参与了人类基因组中约1/3 左右基因的表达调控。在细胞增殖、分化、凋亡,应激反应,新陈代谢等多种生命过程中发挥着重要作用[2]。近50%已知的miRNAs位于与肿瘤相关的基因区域/脆性位点,提示 miRNA 可作为致癌或抑癌基因而发挥促癌或抑癌作用[3]。miRNA 在乳腺癌中参与肿瘤细胞的生长、凋亡、迁移、侵袭等肿瘤发生、发展过程,进而实现对乳腺癌转移的调控。最近研究发现microRNA-335(miR-335)在结肠癌、儿童急性粒细胞性白血病及星形细胞瘤中呈现高表达[4, 5, 6],而在乳腺癌、胃癌中miR-335是低表达的[7, 8]。这说明miR-335在不同的肿瘤中发挥着不同的作用。为了探讨miR-335在乳腺癌中的具体作用机制,本研究利用荧光实时定量PCR检测miR-335在乳腺癌细胞系和正常乳腺细胞系中的表达。进一步利用miR-335模拟物(mimics)转染 MDA-MB-231 细胞,观察其对该细胞增殖、凋亡及迁移能力的影响,并探讨miR-335可能的作用机制。
1 材料与方法 1.1 材料各乳腺癌细胞株与人乳腺正常上皮细胞MCF-10A均来源于ATCC并由本实验室保存。20例原发性及淋巴结转移的乳腺癌组织均来源于重庆市肿瘤医院。DMEM培养基、DMEM/F12培养基、OPTI-MEM培养基及胎牛血清(Gibco公司,美国),马血清(Invitrogen 公司,美国),氢化可的松、生长因子(EGF)及胰岛素(Invitrogen 公司,美国),霍乱毒素(Sigma 公司,美国),青链霉素(碧云天公司,上海)。RNA 抽提试剂(TRIzol,TaKaRa 公司,日本 )。miR-335 mimics和对照mimics control由上海吉玛公司合成。Lipofect-amine 2000(Invitrogen公司,美国)。Transwell小室(Costar公司,美国)。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐、二甲基亚砜(DMSO)、结晶紫(台盼蓝)染液(Sigma公司,美国),SYBRGreen PCR Master Mix(TOYOBO公司,日本)。蛋白提取试剂盒、SDS-PAGE凝胶配制试剂盒和ECL发光试剂盒购自上海碧云天生物技术有限公司;兔抗人MMP-2和MMP-9多克隆抗体购自Abcam公司;HRP标记的山羊抗兔IgG抗体、兔抗人β-actin多克隆抗体IgG购自北京中杉生物有限公司。
1.2 方法 1.2.1 细胞培养乳腺癌细胞MCF-7和MDA-MB-231采用含 10%FBS高糖DMEM培养基;SKBR-3、T47D和BT-474采用含10%FBS 的RPMI1640培养 基;MCF-10A采用DMEM/F12含5 %马血清、10 μg/mL 胰岛素、20 ng/mL EGF、100 ng/mL霍乱毒素、0.5 μg/mL 氢化可的松培养基,37 ℃、5%CO 2及相对湿度条件下培养。
1.2.2 细胞RNA提取收集5×10 6 细胞,加入1 mL TRIzol重悬并反复吹打使细胞充分裂解 ,以备抽提RNA使用 。 每1毫升 TRIzol 加入200 μL氯仿,剧烈震荡混匀 30 s,室温静置 15 min,4 ℃下12 000×g 离心15 min。小心转移上层水相于另一RNase free EP中,加入500 μL 异丙醇轻柔地颠倒混匀,室温静置10 min。4 ℃下12 000×g离心20 min,弃上清液 ,加入1 mL 80%乙醇洗涤,4 ℃下12 000×g离心 20 min弃上清。 超净台下风干。加入适量 DEPC 水溶解,分光光度计测定浓度,1%琼脂糖电泳检测RNA完整性后于-80 ℃保存备用。
1.2.3 组织RNA提取临床收集液氮冻存的20例原发性及淋巴结转移的乳腺癌组织,放入研钵中,加入液氮研磨,每50 mg组织加入1 mL TRIzol,转入RNase free EP管。12 000×g离心5 min,弃沉淀。 每1 mL TRIzol 加入200 μL氯仿,剧烈震荡混匀 30s,室温静置 15 min,4 ℃下12 000×g 离心15 min。小心转移上层水相于另一RNase free EP中,加入500 μL 异丙醇轻柔地颠倒混匀,室温静置10 min。4 ℃下12 000×g离心20 min,弃上清液 ,加入1 mL 80%乙醇洗涤,4 ℃下12 000×g离心20 min弃上清。 超净台下风干。加入适量 DEPC 水溶解,分光光度计测定浓度,1%琼脂糖电泳检测RNA完整性后,于-80 ℃保存备用。
1.2.4 反转录-实时荧光定量PCRmiRNA的反转录-实时定量多聚酶链反应(qRT-PCR)采用茎环法。miR-335 的反转录引物为 5′-GTCGTATCCAGTGCA-GGGTCCGAGGTGCACTGGATACGACTCAACATC-3′,荧光定量 PCR miR-335 的上游引物为 5′-TAGCTTATCAGACTG-A-3′,下游引物为 5′-CCAGTGCAGGGTCCGAGGT-3′。 将抽提的RNA进行反转录,实时定量PCR采用SYBR Green PCR Master Mix(Toybo公司,日本)和96孔荧光定量PCR仪 (Bio-Rad 公司,美国)。采用U6 RNA作为内参。每个样本重复3次实验后得到的数据,通过比较 CT值法(2-△△Ct)进行相对定量分析。
1.2.5 细胞转染对数生长期MDA-MB-231 细胞于转染前24 h接种于6孔板中(3×105/孔),培养至细胞达 60%融合度时进行细胞转染。按照 Invitrogen 公司的操作说明将 100 pmol miR-335-mimics 转染到MDA-MB-231细胞中,转染mimics control组为阴性对照。37 ℃、5%CO 2 培养箱中继续培养进行相关检测。
1.2.6 MTT 实验转染后24 h,将细胞以每孔 1×104的密度接种于96孔板中,每组4个复孔,于不
同时间点即1、 2、 3、 4、 5、6、7 d,每孔加MTT 20 μL(5 mg/mL),置37 ℃、5% CO2孵箱继续培养4 h。取出培养板,轻轻吸去上清液,每孔加100 μL DMSO终止反应并溶解甲赞蓝紫色颗粒,震荡混匀,分光光度计测各孔D(490)值,计算平均值。实验重复 3次。
MDA-MB-231细胞转染48 h 后收集,用PBS悬浮细胞,1 000 r/min离心5 min;重复3次,弃上清培养基; 最后加入1 mL PBS混匀并转移至1.5 mL EP管中,加入5 μL Annexin-FITC,轻轻振荡混匀后于4 ℃下孵育15 min,之后加入5 μL碘化丙啶(PI),4 ℃下孵育5 min,流式细胞仪上进行检测并分析细胞凋亡情况。
1.2.8 Transwell 迁移实验每个处理组细胞浓度为 1×104/mL,每个Transwell小室加入200 μL细胞悬液,下室加入600 μL 条件培养基(含有10%FBS),置于 37℃、5%CO2培养箱培养。 每个处理组设3个复孔。培养24 h后取出 Transwell小室,吸弃小室内的液体,用棉签擦除里面的细胞,并用PBS轻轻洗掉里面剩余细胞。用4%多聚甲醛固定Transwell小室反面的细胞30 min。放入结晶紫染液中,染色15 min。200倍镜下观察并拍照,随机选取3个视野计数,取均数作为透膜细胞数。
1.2.9 Western blot检测MMP-2和MMP-9蛋白的表达MDA-MB-231细胞经转染处理48 h后,收集各组细胞,提取蛋白,BCA法定量。取40 μg蛋白样 品,经SDS-PAGE分离后,电转移至PVDF 膜上,经 5% 脱脂奶粉室温封闭2 h;加入兔抗人MMP-2 (1 ∶1 000 稀释) 抗体,相对分子质量74×103,MMP-9 (1 ∶1 000稀释)抗体,相对分子质量92×103,兔抗人 β-actin 多克隆抗体 ( 1 ∶1 000),相对分子质量43×103。4 ℃过夜,TBST洗膜3次,再分别与HRP标记的山羊抗兔二抗( 1 ∶3 000)室温孵育2 h,ECL化学发光。
1.3 统计学分析采用SPSS 17.0统计软件,计量资料用x±s表示,多组均数比较采用单因素方差分析,2组均数比较采用配对t检验。
2 结果 2.1 miR-335 在乳腺癌细胞系和正常乳腺细胞系中的表达乳腺癌细胞系BT474、T47D、 MCF-7、SK-BR-3、 MDA-MB-231中miR-335表达水平低于乳腺正常上皮细胞系MCF-10A,在MDA-MB-231细胞中表达最低(P<0.01,图 1)。
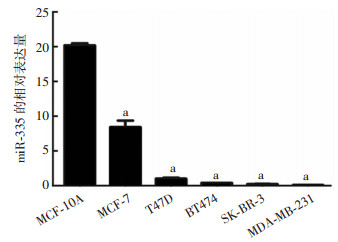 |
| a:P<0.01,与正常乳腺上皮细胞MCF-10A比较 图 1 qRT-PCR检测miR-335 在乳腺癌细胞和正常乳腺上皮细胞中的表达 |
对提取的10对原发性及淋巴结转移的乳腺癌组织RNA随机配对进行荧光实时定量PCR,检测结果显示淋巴结转移性乳腺癌组织中miR-335表达水平(1.139±0.052)低于原发性乳腺癌组织(3.318±0.088,P<0.05)。
2.3 实时定量PCR验证转染效果为确定miR-335-mimics 是否成功转染MDA-MB-231细胞,在转染24 h 后,用荧光实时定量PCR 相对定量的方法检测 miR-335 的表达,结果发现miR-335-mimics 转染组miR-335的表达较 2个对照组明显升高 [(124.710±6.493) vs (1.039±0.189)、(1.163±0.115),P<0.01],该结果表明瞬时转染成功,后继实验可以采用miR-335-mimics 转染24 h的细胞进行分析。
2.4 miR-335 对 MDA-MB-231 细胞增殖能力的影响与空白对照组和阴性对照组相比,miR-335组的 MDA-MB-231细胞增殖能力没有发生明显变化(P>0.05,图 2)。
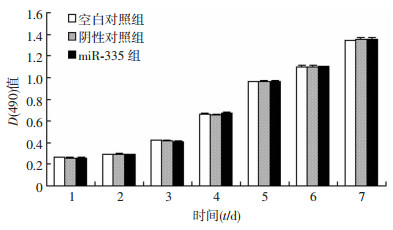 |
| 图 2 MTT检测过表达miR-335对MDA-MB-231细胞增殖功能的影响 |
流式细胞仪检测结果显示:与空白对照组和阴性对照组比较,miR-335组的 MDA-MB-231细胞凋亡率没有发生明显变化(P>0.05,图 3)。
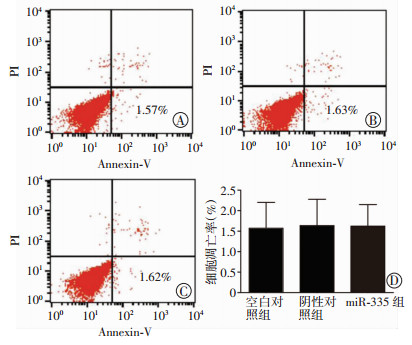 |
| A:空白对照组;B:阴性对照组;C:miR-335组;D:细胞凋亡率分析 图 3 流式细胞仪检测过表达miR-335对MDA-MB-231细胞凋亡的影响 |
MDA-MB-231细胞转染miR-335 mimics后24 h,细胞穿过小室聚碳酸酯膜的数目(34.7±3.5)明显低于阴性对照组(84.3±2.5)和空白对照组(78.3±3.1,P<0.05,图 4)。
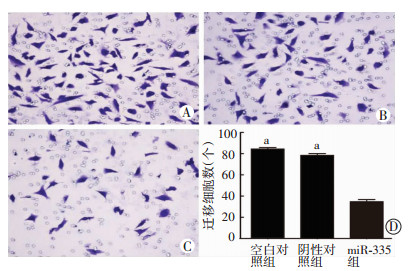 |
| A:空白对照组;B:阴性对照组;C: miR-335组;D:穿膜数分析 a:P<0.05,与miR-335组比较 图 4 Transwell迁移实验观察miR-335 对 MDA-MB-231细胞迁移能力的影响 |
Western blot检测结果显示:miR-335组MMP-2和MMP-9的蛋白表达明显低于阴性对照组和空白对照组(图 5)。
 |
| 1:空白对照组;2:阴性对照组;3:miR-335组 图 5 Western blot检测各组细胞 MMP-2(A)、MMP-9(B)表达 |
miRNA是目前哺乳动物细胞研究最成熟的非编码RNA,是近几年来分子生物学领域的又一个研究热点。miRNA对靶基因的调控主要通过与其mRNA 3′UTRs (untranslated regions) 区近乎完全互补结合后在转录后水平使其降解,或者与之不完全互补结合在翻译水平抑制蛋白合成,在细胞增殖、分化、凋亡、应激反应、新陈代谢等许多生命过程中发挥着重要作用。这些进程的失调通常发生在肿瘤中,与致癌关系密切。 第一个被发现miRNAs与肿瘤相关的是在B细胞慢性淋巴白血病中染色体13q14.3的异位诱导缺失[9]。miR-15a 和 miR-16-1在此位点的丢失导致了抗凋亡基因Bcl-2的高表达。大量的研究证明异常的miRNA存在人类肿瘤中,包括乳腺癌。如miR-196 和 miR-10a位于同源异形框与乳腺癌的发展和致癌有关[10]。miR-125b在乳腺癌中低表达,位于染色体11q23-24,其中一个区域在乳腺癌、卵巢癌、肺癌中经常发生丢失[11]。
乳腺癌转移相关miRNA的发现,为我们研究乳腺癌转移提供了新的思路。Ma 等[12]最早发现 miR-10b 在乳腺癌中具有侵袭和转移的作用,miR-10b可通过抑制转录因子 homeoboxD10 (HOXD10) 的翻译,引发转移基因 ras homologue gene family member C(RHOC) 的表达,其能够促进肿瘤细胞的侵袭和迁移。Wu等[13]发现 miR-340 在侵袭转移能力强的乳腺癌细胞系中表达下调,诱导miR-340 的表达能够抑制肿瘤细胞的侵袭和转移。近年来研究发现 miR-335 在不同的肿瘤中发挥着不同的作用,miR-335在乳腺癌、胃癌中低表达[7, 8] ,而在星形细胞瘤、非小细胞肺癌中miR-335 高表达,并能促进肿瘤细胞增殖、侵袭和迁移能力[4, 6, 14]。本研究在乳腺癌细胞水平对miR-335进行荧光实时定量PCR检测,结果发现miR-335在所选的乳腺癌细胞株中均呈低表达,尤其是高转移性乳腺癌细胞MDA-MB-231中表达更低,与文献[7]报道一致。为了进一步验证miR-335在乳腺癌中的表达情况,本研究收集了20例原发性乳腺癌和淋巴结转移性乳腺癌临床组织标本,采用荧光实时定量PCR检测miR-335的表达,结果发现20例随机配对标本中有7例淋巴结转移性乳腺癌中miR-335的表达低于原发性乳腺癌。因此推测miR-335可能在乳腺癌中发挥类似抑癌基因的作用,尤其与乳腺癌的转移有关。进一步在低表达miR-335的乳腺癌细胞系MDA-MB-231过表达miR-335,通过细胞增殖、细胞凋亡和迁移实验探讨miR-335对乳腺癌细胞的生物学行为的影响。结果显示:过表达miR-335对MDA-MB-231细胞的增殖能力与对照组相比无明显变化,对细胞凋亡也没有明显的影响,但对MDA-MB-231细胞的迁移能力却起到了明显抑制作用。有研究已证实Sp1、Bcl-w是胃癌中miR-335发挥作用的靶基因。高表达的Bcl-w与胃癌的浸润显著相关[15],Bcl-w可以通过激活PI3K/Akt传导通路来促进胃癌细胞浸润。而miR-335不仅可以直接抑制Sp1的表达,而且还可以通过抑制Bcl-w的表达来抑制其介导的PI3K-Akt-Sp1通路抑制Sp1的表达,进而达到抑制胃癌细胞侵袭转移的目的。2008年Tavazoie等[7]在对乳腺癌细胞株MDA-MB-231研究中发现miR-335通过作用于转录因子SOX4和细胞外基质成分tenascin C(TNC)来抑制肿瘤的迁徙和转移。转录因子SOX4则是通过与Wnt信号通路、TGF-β、Notch、Hedgehog、P53及自身的转录因子作用等途径综合调控特定靶基因的表达,在细胞的发育和迁移等方面发挥重要的作用[16]。基质金属蛋白酶(MMPs)家族是一种与肿瘤侵袭和转移密切相关的蛋白酶,尤其是胶原酶(MMP-2)和明胶酶(MMP-9)与之关系最为密切[17]。被激活后一方面降解、破坏靠近肿瘤表面的细胞外基质和基底膜,使瘤细胞沿着缺失的基底膜向周围组织浸润,促进肿瘤侵袭和转移;另一方面则通过毛细血管内生、新生血管生成等促进肿瘤侵袭和转移[18, 19]。研究表明,MMP-2和MMP-9在星形细胞瘤、肺癌、肾细胞癌及乳腺癌等多种肿瘤中高表达,在恶性肿瘤的浸润和转移中起到重要作用。本研究发现过表达miR-335后MMP-2和MMP-9的表达在蛋白水平均下降,我们推测miR-335抑制MDA-MB-231细胞的迁移能力与下调MMP-2和MMP-9的表达有关,但miR-335直接靶定MMP-2和MMP-9还是通过靶定其他基因后引起MMP-2和MMP-9的表达下调还需进一步探索。
本研究初步探明了miR-335对乳腺癌生物学行为的影响,为临床治疗乳腺癌开辟了新的方案并奠定了理论基础。深入透彻地研究miR-335在乳腺癌中作用机制,将使miR-335有望成为诊断乳腺癌发生转移的新的生物学指标和治疗靶点。有关miR-335对乳腺癌迁移的具体作用机制,本课题组仍在进一步研究。
| [1] | Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008[J]. CA Cancer J Clin, 2008, 58(2): 71-96. |
| [2] | Lee J W, Choi C H, Choi J J, et al. Altered MicroRNA expression in cervical carcinomas[J]. Clin Cancer Res, 2008, 14 (9): 2535-2542. |
| [3] | Bosco N, Pelliccia F, Rocchi A. Characterization of FRA7B, a human common fragile site mapped at the 7p chromosome terminal region[J]. Cancer Genet Cytogenet, 2010, 202(1): 47-52. |
| [4] | Vickers M M, Bar J, Gorn-Hondermann I, et al. Stage-dependent differential expression of microRNAs in colorectal cancer: potential role as markers of metastatic disease[J]. Clin Exp Metastasis, 2012, 29(2): 123-132. |
| [5] | 罗学群, 徐令, 柯志勇, 等. 儿童急性粒细胞白血病及其亚型的微小RNA表达[J].中华肿瘤杂志, 2011, 33(11): 831-835. |
| [6] | Shu M, Zheng X, Wu S, et al. Targeting oncogenic miR-335 inhibits growth and invasion of malignant astrocytoma cells[J]. Mol Cancer, 2011, 10: 59. |
| [7] | Tavazoie S F, Alarcon C, Oskarsson T, et al. Endogenous human microRNAs that suppress breast cancer metastasis[J]. Natuer, 2008, 451(7175): 147-152. |
| [8] | Xu Y, Zhao F, Wang Z, et al. MicroRNA-335 acts as a metastasis suppressor in gastric cancer by targeting Bcl-w and specificity protein 1[J]. Oncogene, 2012, 31(11): 1398-1407. |
| [9] | Calin G A, Dumitru C D, Shimizu M, et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia[J]. Proc Natl Acad Sci USA, 2002, 99(24): 15524-15529. |
| [10] | Makiyama K, Hamada J, Takada M, et al. Aberrant expression of HOX genes in human invasive breast carcinoma[J]. Oncol Rep, 2005, 13(4): 673-679. |
| [11] | Negrini M, Rasio D, Hampton G M, et al. Definition and refinement of chromosome 11 regions of loss of heterozygosity in breast cancer : identification of a new region at 11q23.3[J]. Cancer Res, 1995, 55(14): 3003-3007. |
| [12] | Ma L, Teruya-Feldstein J, Weinberg R A. Tumour invasion and metastasis initiated by microRNA-10b in breast cancer[J]. Nature, 2007, 449 (7163) : 682-688. |
| [13] | Wu Z S, Wu Q, Wang C Q, et al. miR-340 inhibition of breast cancer cell migration and invasion through targeting of oncoprotein c-Met[J]. Cancer, 2011, 117(13): 2842-2852. |
| [14] | 王鹤, 刘志利, 德伟, 等. microRNA-335对人非小细胞肺癌细胞迁移、侵袭及增殖能力的影响[J]. 南京医科大学学报: 自然科学版, 2012, 32(6): 795-799. |
| [15] | Lee H W, Lee S S, Lee S J, et al. Bcl-w is expressed in a majority of infiltrative gastric adenocarcinomas and suppresses the cancer cell death by blocking stress-activated protein kinase/c-Jun NH2-terminal kinase activation[J]. Cancer Res, 2003, 63(5): 1093-1100. |
| [16] | Scharer C D, McCabe C D, Ali-Seyed M, et al. Genome-wide promoter analysis of the SOX4 transcriptional network in prostate cancer cells[J]. Cancer Res, 2009, 69(2): 709-717. |
| [17] | Arvelo F, Cotte C. Metalloproteinases in tumor progression. Review[J]. Invest Clin, 2006, 47(2): 185-205. |
| [18] | Decock J, Hendrickx W, Drijkoningen M, et al. Matrix metalloproteinase expression patterns in luminal A type breast carcinomas[J]. Dis Markers, 2007, 23(3): 189-196. |
| [19] | Kim H J, Park C I, Park BW, et al. Expression of MT-1 MMP, MMP2, MMP9 and TIMP2 mRNAs in ductal carcinoma in situ and invasive ductal carcinoma of the breast[J]. Yonsei Med J, 2006, 47(3): 333-342. |



