阴沟肠杆菌是导致医院感染的常见致病菌,随着碳青霉烯类抗生素使用的逐渐增多,包括阴沟肠杆菌在内的碳青霉烯类耐药肠杆菌科细菌在世界范围内广泛报道,中国也有报道[1, 2]。多种耐药机制导致碳青霉烯类耐药,尤其是产碳青霉烯酶或者产超广谱内酰胺酶(extended spectrum beta-lactamase,ESBLs)合并膜孔蛋白下调或缺失。编码碳青霉烯酶和ESBLs的基因通常位于携带喹诺酮和氨基糖苷类耐药基因的大质粒上[3],质粒携带的耐药基因可以在同一菌种和不同菌种之间传播,导致碳青霉烯类非敏感菌株对喹诺酮和氨基糖苷类抗生素耐药。碳青霉烯类抗生素是治疗多重耐药肠杆菌感染的最后一道防线,碳青霉烯耐药细菌的出现引起全世界的广泛关注,所以,碳青霉烯耐药及其耐药基因流行情况的监测十分紧急和重要。
本研究选用我院2012年分离到的50株碳青霉烯类非敏感阴沟肠杆菌进行药敏实验,对碳青霉烯酶、ESBLs、喹诺酮、氨基糖苷4类耐药基因及Ⅰ类整合子 (Intl 1)进行检测,分析喹诺酮和氨基糖苷类基因在碳青霉烯类非敏感阴沟肠杆菌中的流行特点,同时采用脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE) 进行分子流行病学研究,为进一步对碳青霉烯非敏感阴沟肠杆菌的耐药机制研究提供实验数据支持。
1 材料与方法 1.1 菌株收集我院2012年经VITEK2 Compact全自动细菌鉴定和药敏检测系统分离鉴定出的阴沟肠杆菌268株。根据临床实验室标准化协会(clinical and laboratory standards institute,CLSI)2012年标准[4, 5],采用微量肉汤稀释法筛选出厄他培南(ETP)最小抑菌 浓度(MIC)≥1 μg/mL和(或)亚 胺培南(IPM)MIC值≥ 2 μg/mL的碳青霉烯类非敏感菌株。
1.2 药敏实验使用VITEK2检测碳青霉烯类非敏感阴沟肠杆菌对头孢曲松(CRO)、头孢他定(CAZ)、头孢吡肟(FEP)、亚胺培南(IPM)、厄他培南(ETP)、环丙沙星(CIP)、左氧氟沙星(LEV)、庆大霉素(GM)、妥布霉素(TOB)的MIC值。采用K-B纸片法对所有菌株进行 ETP和IPM的敏感性验证,根据CLSI 2012年标准对结果进行判定[4],大肠杆菌ATCC25922作为质控菌株。
1.3 耐药基因检测煮沸法提取碳青霉烯类非敏感阴沟肠杆菌的细菌组DNA,采用聚合酶链反应(PCR)扩增碳青酶烯酶基因(blaKPC、blaSME、blaVIM、blaIMP和blaNDM),ESBLs基因(blaTEM、blaSHV、blaCTX-M-3’和blaCTX-M-14’),质粒编码的喹诺酮类基因[qnrA、qnrB、qnrS和aac(6’)-Ib-cr],氨基糖苷类基因[aac(6’)-Ib、armA和rmtB]及Ⅰ类整合子(Intl 1),耐药基因引物序列参考文献 [6, 7]。扩增产物送上海英捷维基公司测序后在NCBI上使用BLAST程序比对。
1.4 PFGE分析冻存菌株复苏后接种于血平板上37 ℃过夜培养,用CSB缓冲液[1 mol/L Tris-HCl,0.5 mol/L EDTA (pH=8)]调制成4.0麦氏浓度的菌悬液;将等体积1%低熔点胶混合制成菌栅胶,菌栅胶在含有蛋白酶K的CLB[1 mol/L Tris-HCl,0.5 mol/L EDTA,Sodium N-lauroylsarcosine (pH=8)]溶液中55 ℃消化3 h;无菌超纯水洗胶2次,TE缓冲液[10 mmol/L Tris-HCl,1 mmol/L EDTA (pH=8)]洗胶4次;然后使用限制性内切酶XbaⅠ(TaKaRa公司,日本)37 ℃作用3 h;在0.5×TBE缓冲液中进行脉冲场凝胶电泳(CHEF MAPPER,Bio-Rad Laboratories,美国);EB染色3 h后凝胶成像仪成像。采用Tenover等[8]提出的标准来解释电泳分离出的DNA条带。
2 结果 2.1 临床特征2012年共分离到50株碳青霉烯类非敏感阴沟肠杆菌,其临床特征见表 1。2012年每月均分离到碳青霉烯类非敏感阴沟肠杆菌,12月分离到13株菌,3月和9月各分离到7株菌,这3个月分离到的非敏感菌占全年分离到的非敏感菌株的54%。在这50株非敏感菌中,25株分离自尿液,11株菌分离自痰,6株菌分离自分泌物,4株菌分离自血液,3株菌分离自胆汁,1株菌分离自引流液。其中15株菌分离自泌尿外科,19株菌分离自ICU(重症医学科ICU、外科ICU、神经内科ICU和呼吸ICU),4株菌分离自老年病科,分别从神经外科、肝胆外科和烧伤整形科分离到2株菌。
| 编号 | 分离日期 | 标本 种类 | 病房 | MIC(μg/mL) | 耐药谱 | 耐药基因 | PFGE 型别 | |||||||
| ETP | IPM | 头孢菌素类 | 喹诺酮类 | 氨基糖苷类 | 碳青霉 烯类 | ESBLs | 喹诺酮类 | 氨基糖苷类 | 整合子 | |||||
| 1 | 20120131 | 尿 | 泌尿外科1 | 8 | 4 | CIP,LEV | GM,TOB | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 1 | ||||
| 2 | 20120216 | 痰 | 内分泌内科 | 8 | 16 | CRO,CAZ,FEP | CIP,LEV | GM | 3 | |||||
| 3 | 20120309 | 尿 | 泌尿外科1 | 8 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2a | ||
| 4 | 20120312 | 尿 | 泌尿外科2 | 8 | 8 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2a | ||
| 5 | 20120312 | 血 | 老年病科1 | 4 | 1 | CRO,CAZ,FEP | GM,TOB | aac(6’)-Ib | Intl1 | 3 | ||||
| 6 | 20120320 | 尿 | 泌尿外科1 | 8 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2a | ||
| 7 | 20120322 | 尿 | 泌尿外科2 | 8 | 4 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2a | ||
| 8 | 20120323 | 伤口分 泌物 | 呼吸ICU | 8 | 8 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaSHV | qnrB,qnrS, aac(6’)-Ib-cr | Intl1 | 4 | ||
| 9 | 20120428 | 痰 | 老年病科2 | 4 | 8 | CRO,CAZ,FEP | GM,TOB | blaIMP-8 | blaTEM,blaSHV, blaCTX-M-14' | qnrB | aac(6’)-Ib, rmtB | Intl1 | 5 | |
| 10 | 20120525 | 尿 | 泌尿外科1 | 8 | 8 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2b | ||
| 11 | 20120605 | 尿 | 泌尿外科1 | 8 | 4 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2a | ||
| 12 | 20120619 | 尿 | 泌尿外科2 | 8 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 6 | ||
| 13 | 20120721 | 尿 | 泌尿外科1 | 2 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM,blaSHV, blaCTX-M-3', blaCTX-M-14' | qnrA | aac(6’)-Ib, armA,rmtB | Intl1 | 7 | |
| 14 | 20120720 | 尿 | 妇产1 | 2 | 1 | CRO,CAZ | 5 | |||||||
| 15 | 20120727 | 尿 | 老年病科2 | 8 | 1 | CRO,CAZ | CIP,LEV | TOB | blaSHV | Intl1 | 8 | |||
| 16 | 20120803 | 痰 | 神经内科ICU | 8 | 8 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaIMP-8 | blaTEM,blaSHV, blaCTX-M-14' | qnrB | rmtB | Intl1 | 9 |
| 17 | 20120808 | 血 | 泌尿外科2 | 8 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2a | ||
| 18 | 20120808 | 尿 | 泌尿外科2 | 8 | 4 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2a | ||
| 19 | 20120817 | 血 | 泌尿外科2 | 8 | 4 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 2a | ||
| 20 | 20120820 | 分泌物 | 烧伤整形外科 | 1 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM,blaSHV, blaCTX-M-3' | qnrB | aac(6’)-Ib, armA | Intl1 | 12 | |
| 21 | 20120903 | 胆汁 | 外科ICU | 8 | 4 | CRO,CAZ | qnrB,qnrS, aac(6’)-Ib-cr | 4 | ||||||
| 22 | 20120917 | 尿 | 重症医学科(ICU) | 4 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrS,aac(6’)-Ib-cr | aac(6’)-Ib, armA | 10 | ||
| 23 | 20120924 | 尿 | 重症医学科(ICU) | 4 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 10 | ||
| 24 | 20120926 | 伤口分 泌物 | 重症医学科(ICU) | 4 | 1 | CRO,CAZ,FEP | CIP,LEV | blaTEM, blaCTX-M-14' | qnrB | aac(6’)-Ib | Intl1 | 11 | ||
| 25 | 20120927 | 尿 | 重症医学科(ICU) | 4 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 10 | ||
| 26 | 20120927 | 血 | 重症医学科(ICU) | 4 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 10 | ||
| 27 | 20120928 | 分泌物 | 急诊科 | 4 | 1 | CRO,CAZ,FEP | CIP,LEV | blaTEM, blaCTX-M-14' | qnrB | aac(6’)-Ib | Intl1 | 11 | ||
| 28 | 20121009 | 分泌物 | 烧伤整形外科 | 4 | 1 | CRO,CAZ,FEP | CIP,LEV | blaTEM, blaCTX-M-14' | qnrB | aac(6’)-Ib | Intl1 | 11 | ||
| 29 | 20121011 | 尿 | 泌尿外科1 | 8 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib, armA | 12 | ||
| 30 | 20121023 | 痰 | 神经内科ICU | 2 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB | aac(6’)-Ib, armA | 13 | ||
| 31 | 20121103 | 胆汁 | 肝胆外科 | 4 | 1 | CRO,CAZ | 14 | |||||||
| 32 | 20121120 | 痰 | 重症医学科(ICU) | 4 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM,blaSHV, blaCTX-M-3' | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib | Intl1 | 15a | |
| 33 | 20121121 | 分泌物 | 重症医学科(ICU) | 4 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM,blaSHV, blaCTX-M-3' | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib | Intl1 | 15b | |
| 34 | 20121123 | 尿 | 胃肠外科 | 2 | 2 | CIP | GM | blaTEM | qnrB,qnrS, aac(6’)-Ib-cr | Intl1 | 16 | |||
| 35 | 20121124 | 尿 | 泌尿外科2 | 2 | 1 | CRO | blaCTX-M-14' | Intl1 | 17 | |||||
| 36 | 20121124 | 尿 | 泌尿外科2 | 2 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM,blaSHV, blaCTX-M-3',blaCTX-M-14' | qnrA,qnrB | aac(6’)-Ib | Intl1 | 18 | |
| 37 | 20121126 | 痰 | 神经内科ICU | 2 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB | aac(6’)-Ib, armA | 13 | ||
| 38 | 20121204 | 痰 | 神经内科ICU | 1 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | aac(6’)-Ib, armA | 13 | |||
| 39 | 20121205 | 痰 | 呼吸内科1 | 4 | 2 | CRO,CAZ,FEP | CIP | TOB | blaTEM, blaCTX-M-3' | qnrB,qnrS, aac(6’)-Ib-cr | aac(6’)-Ib | Intl1 | 19 | |
| 40 | 20121212 | 尿 | 神经外科2 | 8 | 4 | CRO,CAZ,FEP | CIP | GM | qnrB | aac(6’)-Ib | 14 | |||
| 41 | 20121212 | 尿 | 神经外科2 | 8 | 4 | CRO,CAZ,FEP | CIP | GM | qnrB | aac(6’)-Ib | 18 | |||
| 42 | 20121211 | 尿 | 神经内科ICU | 2 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB | aac(6’)-Ib,armA | 13 | ||
| 43 | 20121213 | 尿 | 神经内科ICU | 2 | 2 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | qnrB | aac(6’)-Ib,armA | 13 | ||
| 44 | 20121215 | 痰 | 呼吸ICU | 4 | 1 | CRO,CAZ,FEP | CIP | TOB | blaTEM,blaCTX-M-3', blaCTX-M-14' | qnrA,qnrB | Intl1 | 20 | ||
| 45 | 20121216 | 痰 | 呼吸ICU | 4 | 1 | CRO,CAZ,FEP | TOB | blaTEM,blaCTX-M-3', blaCTX-M-14' | qnrA,qnrB | Intl1 | 20 | |||
| 46 | 20121221 | 尿 | 神经内科ICU | 2 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM, blaCTX-M-14' | qnrB | aac(6’)-Ib, armA | 13 | ||
| 47 | 20121227 | 胰腺引 流液 | 消化内科 | 4 | 1 | CRO,CAZ,FEP | CIP,LEV | blaCTX-M-3' | qnrA | Intl1 | 21 | |||
| 48 | 20121231 | 尿 | 老年病科2 | 8 | 2 | CRO,CAZ | CIP,LEV | GM,TOB | blaSHV | qnrB | Intl1 | 8 | ||
| 49 | 20121218 | 痰 | 神经内科ICU | 1 | 1 | CRO,CAZ,FEP | CIP,LEV | GM,TOB | blaTEM | aac(6’)-Ib, armA | 13 | |||
| 50 | 20121227 | 胆汁 | 肝胆外科 | 2 | 2 | CRO,CAZ | 16 | |||||||
| ETP:厄他培南;IPM:亚胺培南;CRO:头孢曲松;CAZ:头孢他定;FEP:头孢吡肟;CIP:环丙沙星;LEV:左氧氟沙星;GM:庆大霉素;TOB:妥布霉素 | ||||||||||||||
根据CLSI推荐的肠杆菌科细菌MIC折点,2012年收集到的碳青霉烯类非敏感阴沟肠杆菌占阴沟肠杆菌的18.66%(50/268)。在50株菌中,48(96%)株ETP耐药,2(4%)株ETP中介;19(38%)株IPM耐药,13(26%)株IPM中介,18(36%)株IPM敏感。所有菌均为ETP非敏感,然而有接近一半(36%)的菌株对IPM表现为敏感。头孢菌素类抗生素药敏结果显示,41(82%)株菌对3代头孢菌素(CRO和CAZ)及4代头孢菌素FEP均耐药,6(12%)株菌对CRO和CAZ耐药但对FEP表现为敏感,2(4%)株菌对3种头孢菌素均敏感。喹诺酮类抗生素药敏结果提示,37(74%)株菌对CIP和LEV均耐药,8(16%)株菌对CIP和LEV均敏感,余下5(10%)株仅对CIP耐药。氨基糖苷类抗生素药敏结果显示,33(66%)株菌对GM和TOB均耐药,9(18%)株菌对2种抗生素均敏感(表 1)。
2.3 碳青霉烯酶基因与ESBLs流行情况的关系50株碳青霉烯类非敏感阴沟肠杆菌中,仅2(4%) 株菌中检测到碳青霉烯酶基因blaIMP-8(表 1);41(82%)株菌ESBLs基因表现为阳性,包括blaTEM(36/50,72%)、blaSHV(10/50,20%)、blaCTX-M-3’(9/50,18%)、blaCTX-M-14’(11/50,22%);接近一半(20/50,40%)的菌株携带Intl 1。值得一提的是,2株blaIMP-8阳性的菌株均携带blaTEM、blaSHV、blaCTX-M-14’和Intl 1。在这50株菌中,有10(20%)株菌不携带任何碳青霉烯酶和ESBLs基因,但其中5株菌对CRO、CAZ和FEP均耐药,4株对CRO和CAZ耐药。
2.4 喹诺酮类基因与碳青霉烯酶和ESBLs流行情况的关系如表 1所示,50株菌中有41(82%)株菌携带至少一种喹诺酮类基因。我们在29(58%)株菌中检测到qnrB基因,在5(10%)株菌中检测到qnrA基因,分别在22(44%)株菌中检测到qnrS和aac(6’)-Ib-cr基因。其中,11(22%)株菌共同携带qnrB、qnrS和aac(6’)-Ib-cr基因,且qnrS阳性的菌株均携带有aac(6’)-Ib-cr基因。在这41株喹诺酮类基因阳性的菌株中,有3株菌对我们检测的喹诺酮类抗生素均敏感。另一方面,有5株菌对至少一种喹诺酮类抗生素表现为耐药,但未检测到任何喹诺酮类基因。
在41株ESBLs阳性的菌株中,有40(97.6%)株
菌检测到喹诺酮类基因:qnrA (5/41,12.2%),qnrB(26/41,63.4%),qnrS(20/41,48.8%),aac(6’)-Ib-cr(20/41,48.8%)。在29株携带qnrB基因的菌株中,有25(86.2%)株菌blaTEM阳性;5株qnrA基因阳性的菌株共同表达blaCTX-M-14’基因。blaIMP-8阳性的菌株不携带除qnrB以外的任何喹诺酮类基因。9株不携带任何碳青霉烯酶和ESBLs基因的菌株中有4株(44.4%)菌检测到喹诺酮类基因。
氨基糖苷类基因的阳性情况如表 1所示,分别有36 (72%)株、25(50%)株和3(6%)株菌表现为aac(6’)-Ib、armA和rmtB基因阳性,总共在37株(74%)菌中检测到氨基糖苷类基因。aac(6’)-Ib 和armA基因在24(48%)株菌中共表达,仅有1(2%)株菌共同携带3种氨基糖苷类基因。在37株氨基糖苷类基因阳性的菌株中,3株检测到aac(6’)-Ib基因的阴沟肠杆菌对两种氨基糖苷类抗生素均敏感,而7(14%)株未检测到任何氨基糖苷类耐药基因的菌株对至少1种氨基糖苷类抗生素耐药。
携带ESBLs基因的41株菌中,33(80.5%)株菌氨基糖苷类基因阳性: aac(6’)-Ib(32/41,78.1% )、armA(24/41,58.5% )、rmtB(3/41,7.3%)。在碳青霉烯酶和ESBLs基因阳性的菌株中,氨基糖苷类基因的阳性率为44.4%(4/9)。blaTEM阳性的菌株中,88.9% (32/36)的菌株携带aac(6’)-Ib基因,66.7%(24/36)的菌株共同表达aac(6’)-Ib和armA基因。rmtB基因阳性的3株菌中均检测到blaTEM、blaSHV和blaCTX-M-14’基因,其中1株还携带blaCTX-M-3’基因。在blaIMP-8阳性的两株菌中,1株菌仅检测到rmtB基因,另1株菌则共同携带aac(6’)-Ib和rmtB基因。
2.6 分子流行病学分析对50株菌进行PFGE实验,其中29株菌的结果如图 1所示。50株菌分为21个型别,命名为1~21型。有9株菌(3、4、6、7、10、11、17、18、19)属于2型,且分属于2个亚型2a和2b。属于2型的菌株具有相同的抗菌谱(IPM、ETP、CAZ、CRO、FEP、CIP、LEV、GM和TOB耐药),且携带相同的耐药基因[blaTEM、qnrB、qnrS、aac(6’)-Ib-cr、aac(6’)-Ib和armA],这些菌株于3-8月分离自泌尿外科。 13型包含7株菌(30、37、38、42、43、46、49),分离自神经内科ICU。2 d内从中心ICU分离到的32、33号菌同属于15型且具有相同的耐药谱。2株blaIMP-8阳性的菌株分离自不同科室,并且属于不同型别(5型和9型)。
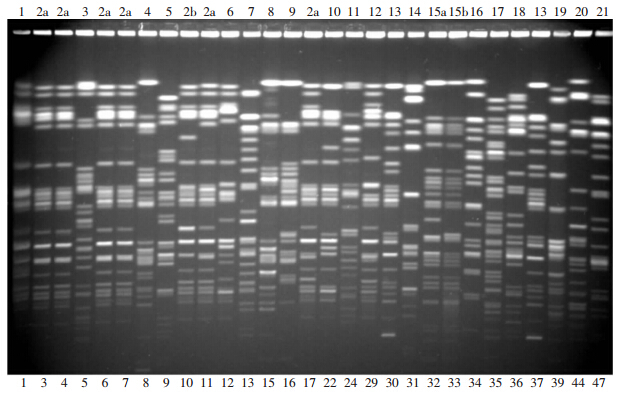 |
| 图 1 PFGE分析29株碳青霉烯类非敏感阴沟肠杆菌分子流行病学情况 |
本研究对我院2012年碳青霉烯类非敏感阴沟肠杆菌中碳青霉烯酶、ESBLs、质粒介导的喹诺酮基因和氨基糖苷类基因以及Ⅰ类整合子的流行特点及菌株的分子流行病学情况进行了分析。从菌株临床特点看,分别有19株菌分离自外科病房(其中15株分离自泌尿外科)和ICU病房,7株分别分离自泌尿外科和神经内科ICU的菌株各自属于同一个克隆型,提示碳青霉烯类非敏感阴沟肠杆菌在我院有明显的病房分布特点,这可能和侵入性操作有关。下尿路感染和留置导尿管被证实是导致多重耐药菌感染的独立危险因素[9],这可能是一半的菌株分离自尿液标本的原因。PFGE结果显示了菌株的克隆多样性,提示碳青霉烯类非敏感阴沟肠杆菌的流行并非未源于同一克隆群。
金属β-内酰胺酶(MBLs)是一类具有高度分子多样性的酶,可以水解除氨曲南以外的所有β-内酰胺类抗生素,给临床感染治疗带来很大的威胁。MBLs在铜绿假单胞菌和不动杆菌属等菌中广泛流行,VIM-1、IMP-8和NDM-1在阴沟肠杆菌中曾被报道[10, 11]。在本研究中,我们检测到2株菌携带blaIMP-8基因,并且这2株菌都共同表达Ⅰ类整合子。Ⅰ类整合子可以整合一些不相关的基因,这些基因在整合后获得转移和插入的能力,这可能是这2株blaIMP-8阳性菌同时携带blaTEM、 blaSHV、blaCTX-M-14’、qnrB、aac(6’)-Ib和rmtB多种耐药基因的原因。
亚胺培南和美罗培南耐药通常因为菌株产碳青霉烯酶,而厄他培南耐药多由膜孔蛋白的缺失导致[4, 12, 13]。在本研究中,50株菌均为厄他培南非敏感,但22(44%)株菌对亚胺培南敏感。亚胺培南及美罗培南对一些低水平厄他培南耐药的菌株保持稳定的抗菌活性,可以用来治疗厄他培南耐药的肠杆菌科细菌感染。本研究中,82%的菌株携带ESBLs基因,仅2株菌表达碳青霉烯酶基因(blaIMP-8),提示导致我院阴沟肠杆菌碳青霉烯耐药的主要耐药机制是ESBLs基因的过表达。
喹诺酮基因的流行和多样性导致肠杆菌科细菌喹诺酮耐药程度的增加。质粒编码的喹诺酮类基因在喹诺酮基因中占很大比例,包括qnr基因qnrA、qnrB、qnrC、qnrD和qnrS及编码环丙沙星修饰酶的基因aac (6’)-Ib-cr[14, 15]。我们检测了qnrA、qnrB、qnrS和aac(6’)-Ib-cr基因,其中qnrB基因检出率最高,qnrA检出率最低。qnrA基因在一些国家被报道是流行率最高的基因,qnr基因这种地域分布的不同可能是各地不同抗生素压力选择导致的。在我们的研究中,大多数对环丙沙星和(或)左氧氟沙星耐药的菌株携带至少一种喹诺酮类基因;然而,几株喹诺酮类基因阳性的菌株对环丙沙星和左氧氟沙星敏感,2株对环丙沙星和左氧氟沙星耐药的菌株不携带任何喹诺酮基因。单独存在的qnr基因可能不会导致喹诺酮类耐药,但它可降低菌株对喹诺酮类抗生素的敏感性[16],并且除质粒介导的喹诺酮类耐药基因以外的其他耐药机制也可能导致喹诺酮类抗生素耐药。
氨基糖苷耐药通常是由质粒介导的氨基糖苷耐药基因导致的,这些基因导致药物水解酶高表达,如临床广泛传播的氨基糖苷乙酰转移酶AAC(6’)-Ib和16S rRNA甲基化酶ArmA、RmtB[17, 18]。aac(6’)-Ib基因编码的氨基糖苷修饰酶能导致妥布霉素和庆大霉素等重要的临床常用氨基糖苷类抗生素失效。在我们的研究中,82%(41/50)的碳青霉烯类非敏感阴沟肠杆菌对妥布霉素和(或)庆大霉素耐药,与此相符的是,aac(6’)-Ib基因在50株非敏菌中呈高表达(74%,37/50)。armA的检出率(50%)显著高于rmtB(6%),与中国上海的1例研究报道结果[19]截然相反,这可能和耐药菌株流行的地域差别有关。质粒编码的16S RNA甲基化酶基因armA和rmtB能导致高水平的氨基糖胺类抗生素耐药。1株高水平氨基糖苷耐药的肺炎克雷伯菌共同携带armA和rmtB在中国温州也曾有类似报道[20]。本研究发现armA和rmtB在同一株阴沟肠杆菌中共同表达,且同时携带blaTEM、blaSHV、blaCTX-M-3'和blaCTX-M-14',这株菌几乎对临床现有的抗生素均表现为耐药,但对亚胺培南敏感。
有趣的是,4株不携带任何耐药基因的菌株对碳青霉烯类抗生素表现为耐药,其中3株菌对厄他培南耐药而对亚胺培南敏感,另一株菌则对厄他培南和亚胺培南均表现为高水平耐药,这可能和其他的耐药机制有关。因此,对单个病例的碳青霉烯耐药机制进行更深入的研究十分必要。
总之,我院碳青霉烯类非敏感阴沟肠杆菌中ESBLs、喹诺酮类和氨基糖苷类基因高度流行,多种耐药基因在同一菌株中共同表达。在2株blaIMP-8阳性的菌株中均检测到ESBLs、喹诺酮类和氨基糖苷类基因。最重要的是,我们报道了armA、rmtB、blaTEM、blaSHV、blaCTX-M-3'和blaCTX-M-14'在同一株碳青霉烯类非敏感菌株中共同表达。目前,用于治疗多重耐药菌感染的新型抗生素极其有限,耐药监测和医院感染控制对于预防多重耐药肠杆菌科细菌感染与传播显得十分重要。
| [1] | Yang F C,Yan J J,Hung K H,et al.Characterization of ertapenem-resistant Enterobacter cloacae in a Taiwanese university hospital[J].J Clin Microbiol,2012,50(2):223-226. |
| [2] | Doumith M,Ellington M J,Livermore D M,et al.Molecular mechanisms disrupting porin expression in ertapenem-resistant Klebsiella and Enterobacter spp.clinical isolates from the UK[J].J Antimicrob Chemother,2009,63(4):659-667. |
| [3] | McGann P,Hang J,Clifford R J,et al.Complete sequence of a novel 178-kilobase plasmid carrying bla (NDM-1) in a Providencia stuartii strain isolated in Afghanistan[J].Antimicrob Agents Chemother,2012,56(4):1673-1679. |
| [4] | Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:twenty-second informational supplement M100-S22[M].CLSI,Wayne,PA,USA,2012. |
| [5] | Clinical and Laboratory Standards Institute.Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically-eighth edition:approved standard M07-A8[M].CLSI,Wayne,PA,USA,2009. |
| [6] | Nordmann P,Naas T,Poirel L.Global spread of carbapenemase-producing Enterobacteriaceae[J].Emerg Infect Dis,2011,17(10):1791-1798. |
| [7] | Huang S,Dai W,Sun S,et al.Prevalence of plasmid-mediated quinolone resistance and aminoglycoside resistance determinants among carbapeneme non-susceptible Enterobacter cloacae[J].PLoS One,2012,7(10):e47636. |
| [8] | Tenover F C,Arbeit R D,Goering R V,et al.Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis:criteria for bacterial strain typing[J].J Clin Microbiol,1995,33(9):2233-2239. |
| [9] | Teo J,Cai Y,Tang S,et al.Risk factors,molecular epidemiology and outcomes of ertapenem-resistant,carbapenem-susceptible Enterobacteriaceae:a case-case-control study[J].PLoS One,2012,7(3):e34254. |
| [10] | Castanheira M,Deshpande L M,Mathai D,et al.Early dissemination of NDM-1-and OXA-181-producing Enterobacteriaceae in Indian hospitals:report from the SENTRY Antimicrobial Surveillance Program,2006-2007[J].Antimicrob Agents Chemother,2011,55(3):1274-1278. |
| [11] | Oteo J,Hernandez-Almaraz J L,Gil-Anton J,et al.Outbreak of vim-1-carbapenemase-producing Enterobacter cloacae in a pediatric intensive care unit[J].Pediatr Infect Dis J,2010,29(12):1144-1146. |
| [12] | Wu J J,Wang L R,Liu Y F,et al.Prevalence and characteristics of ertapenem-resistant Klebsiella pneumoniae isolates in a Taiwanese university hospital[J].Microb Drug Resist,2011,17(2):259-266. |
| [13] | Garcia-Fernandez A,Miriagou V,Papagiannitsis C C,et al.An ertapenem-resistant extended-spectrum-beta-lactamase-producing Klebsiella pneumoniae clone carries a novel OmpK36 porin variant[J].Antimicrob Agents Chemother,2010,54(10):4178-4184. |
| [14] | Strahilevitz J,Jacoby G A,Hooper D C,et al.Plasmid-mediated quinolone resistance:a multifaceted threat[J].Clin Microbiol Rev,2009,22(4):664-689. |
| [15] | Robicsek A,Strahilevitz J,Jacoby G A,et al.Fluoroquinolone-modifying enzyme:a new adaptation of a common aminoglycoside acetyltransferase[J].Nat Med,2006,12(1):83-88. |
| [16] | Yang T,Zeng Z,Rao L,et al.The association between occurrence of plasmid-mediated quinolone resistance and ciprofloxacin resistance in Escherichia coli isolates of different origins[J].Vet Microbiol,2014,170(1/2):89-96. |
| [17] | O'Neill A J.New antibacterial agents for treating infections caused by multi-drug resistant Gram-negative bacteria[J].Expert Opin Investig Drugs,2008,17(3):297-302. |
| [18] | Folster J P,Rickert R,Barzilay E J,et al.Identification of the aminoglycoside resistance determinants armA and rmtC among non-Typhi Salmonella isolates from humans in the United States[J].Antimicrob Agents Chemother,2009,53(10):4563-4564. |
| [19] | Wu Q,Zhang Y,Han L,et al.Plasmid-mediated 16S rRNA methylases in aminoglycoside-resistant Enterobacteriaceae isolates in Shanghai,China[J].Antimicrob Agents Chemother,2009,53(1):271-272. |
| [20] | Yu F,Wang L,Pan J,et al.Prevalence of 16S rRNA methylase genes in Klebsiella pneumoniae isolates from a Chinese teaching hospital:coexistence of rmtB and armA genes in the same isolate[J].Diagn Microbiol Infect Dis,2009,64(1):57-63. |



