跟腱断裂缝合或者其他修复术后的疼痛,其临床表现类似于慢性跟腱腱病。主要症状是踝部运动引起的疼痛,而局部异响或者肿胀可能不明显。专科查体可以使局部疼痛被诱发重现,并且也可以确定疼痛累及的范围。采用内镜手术处理跟腱断裂修复术后的疼痛,在国际上属于探索性手术,由于手术创伤小,术后康复快,越来越多的足踝医师或者运动医学专业的医师开始尝试该技术。术前判断疼痛的原因和定位病变的部位是内镜下粘连松解术的关键。 1 跟腱的功能解剖学进展
跟腱是人体内最厚最强韧的肌腱,由腓肠肌、比目鱼肌形成的小腿三头肌,产生踝关节跖曲功能[1]。跟腱由从小腿三头肌的三束纤维组成,纤维在延伸中是扭曲的,腓肠肌内侧头的纤维置于后方,其外侧头的纤维置于前方。因此,比目鱼肌的纤维置于跟腱的中间和内侧部[2]。这种转动的范围由两种肌肉纤维融合的位置决定,越远的融合会产生更远的转动。当在跟腱松弛的时候,扭曲会导致较少的纤维波状变形,在牵拉时,个别的纤维束形成较少变形。这样的话,纤维和纤维间的摩擦可能会减少,从而导致强度增加[3]。肌腱被嵌入在跟骨的后表面。这种嵌入使得屈肌支持带与腓侧支持带在跟腱周围形成“篮子”状结构[4]。跟腱跟骨之间的接触区域有一个支点,通过增加其杠杆臂为跟腱带来力学优势[3]。肌腱前面是kager脂肪垫。脂肪垫根据其具体的功能可分为3个区域:(1)包绕 长屈肌部分,有助于在跖屈运动中移动软组织间隙;(2)包绕跟腱部分,封闭在跟腱周围达到保护跟腱血供;(3)包绕跟骨周围滑囊部分,最大限度地减少在滑囊里压力的变化。这3个区域对共同减少跟腱扭转均产生影响,任何一个部位出现病变均可以出现后跟痛。在踝关节跖屈的时候,跟腱和跟骨所产生的夹角会增加,脂肪垫会移动到跟后滑囊里。已有报道提出3个关于软组织间隙的运动机制:(1)这个移动是跟骨被动地向上移动的结果;(2)脂肪垫被“吸”入囊以减少压力的变化;(3)脂肪由
长屈肌部分,有助于在跖屈运动中移动软组织间隙;(2)包绕跟腱部分,封闭在跟腱周围达到保护跟腱血供;(3)包绕跟骨周围滑囊部分,最大限度地减少在滑囊里压力的变化。这3个区域对共同减少跟腱扭转均产生影响,任何一个部位出现病变均可以出现后跟痛。在踝关节跖屈的时候,跟腱和跟骨所产生的夹角会增加,脂肪垫会移动到跟后滑囊里。已有报道提出3个关于软组织间隙的运动机制:(1)这个移动是跟骨被动地向上移动的结果;(2)脂肪垫被“吸”入囊以减少压力的变化;(3)脂肪由 长屈肌收缩推入囊。软组织间隙的移动可以增加跟腱的杠杆臂,也可以减少在跟后滑囊里压力的变化,不然可能会影响囊的润滑功能[5]。对于Haglund畸形患者,跟骨上部的结节切除术是否改变kager脂肪垫,目前尚不清楚。然而,这强调了选择最适合跟骨切除角度的重要性[5]。
长屈肌收缩推入囊。软组织间隙的移动可以增加跟腱的杠杆臂,也可以减少在跟后滑囊里压力的变化,不然可能会影响囊的润滑功能[5]。对于Haglund畸形患者,跟骨上部的结节切除术是否改变kager脂肪垫,目前尚不清楚。然而,这强调了选择最适合跟骨切除角度的重要性[5]。
跟腱没有真正的滑液鞘,腱旁(内部和壁层)是一超薄的、有滑动的膜,与近侧肌肉的筋膜连续,并与远端跟骨的骨膜融合。神经和血管穿过腱旁组织,并为跟腱的中间部分提供主要供血来源。一个胫后动脉的分支供应给肌腱的近端,而远端部分是由动脉网形成血管,这来自于腓骨和胫后动脉的血供。除了这些血管,血液供给到肌腱还有其他2个来源:由肌肉肌腱和骨组织来源的血供渗入。因此,3个血管分布区被确定,由腓动脉供给中间段,胫后动脉供给近端和远端部分。在血管分布的下面相对的2~6 cm近端到跟骨插入的相对区域,证实是跟腱最容易破裂和手术并发症常发生的地方[3, 6]。跟腱的手术通路应该考虑由腓动脉给肌腱供血的这路线为敏感部分[6]。
像其他的肌腱一样,跟腱代谢率非常低。这个特性也是重要的,因为跟腱在不断的张力下工作,加上低氧气摄入量,使其更容易局部缺血和坏死。然而,这种低代谢率也减慢了它活动恢复和伤后愈合速度的比率[7]。
跟腱由腓肠神经中的一小部分神经支配,这来源于胫神经[3]。3种解剖的不同都被报道过,神经从跟腱外侧的边缘通过,或高或低,这些大量的分支并没有集中在一起[8]。相对于女性,男性的腓肠神经在更外侧与跟腱插入的地方。在老年人,神经走向明显更贴近跟腱的各个层面[8]。
从生物力学上看,跟腱是牵引肌腱的腱,其原理等同于腱与肌肉的(牵引)关系。然而,肌腱中扭曲的纤维产生的压力集中在腱束汇合的区域。这提供了在血供最差的跟腱中部形成纤维软骨的条件。对于可以滑动的腱,其生物力学特性及相应共存的致密结缔组织和纤维软骨是典型的,而不是一个典型的牵引肌腱。皮下形成血管的区域与机械功能相适应,而不是退化迹象。随着肌腱变化会产生新的血管,可以同时在彩色超声多普勒检查中显现,而这已经被证实可能与慢性跟腱炎的疼痛相关,因为神经结构与血管壁也关系密切。此外,大多数病例,根据跟腱自发性断裂的病理检查,都显示出退行性改变。在已退化的跟腱中血管的侵入,可能会削弱正常腱的结构,导致其力学应变能力的降低而随后产生自发性断裂[9]。
跖肌是一个小而薄、退化的肌肉,它从股骨腘窝侧开始。跖肌腱止于跟骨的内侧面,位于跟腱的前部。8%的人没有这块肌肉[1]。跟腱涉及跖曲,而跖肌腱也有助于踝关节的反转。在每一步,这种相反的力量导致跟腱和跖肌腱的位置有间歇性的小的变化。在聚集的腱组织周围,跖肌腱和跟腱一起运动。跟腱病变和跟腱周围病变的情况,跟腱和跖肌腱会附着似瘢痕和腱鞘周围收缩的组织。两筋之间的相对运动会导致腱周围那些紧密的组织的牵拉,这些组织和腱之间,以及跟腱病变的程度相关。近年已有报道,在腱周围的组织富含新生神经,其产生的神经支配是可能引起疼痛的原因[10]。 2 急性跟腱断裂的处理原则
处理跟腱断裂的目标是尽量减少其再次损伤(断裂)的发病率,促进全部功能的恢复,防止并发症的发生。对于急性跟腱断裂的最佳治疗方案仍然没有一种共识。目前有4种不同的干预,包括2种手术修复:开放手术、微创手术,以及简单的固定及使用功能性支架,最后两种为非手术的保守治疗[11, 12, 13, 14, 15]。相比保守治疗,开放手术治疗可以减少再次断裂的风险。然而,开放性手术也随之带来手术并发症的风险,包括伤口裂开及感染、腓肠神经损伤、瘢痕和粘连。目前的证据表明,开放手术与经皮微创手术相比,具有较低的再断裂的几率,恢复到受伤前活动水平的可能性较高,但存在较高的并发症发生率,即感染,也让费用加倍[16]。另一方面,微创手术可减少手术并发症的风险,如感染、伤口延 迟愈合、坏死和粘连,以及更短时间的康复训练[12, 17, 18, 19, 20, 21, 22, 23]。
众所周知,骨骼肌系统在术后制动时存在不利影响。早期和密集的功能康复可以改善胶原纤维方向和腓肠肌的力量,因为肌腱在恢复过程中有足够的张力[23, 24]。
无论选择哪种治疗方式,都有可能发生并发症,包括伤口愈合、手术部位感染、瘢痕粘连,以及手术过程中对腓肠神经的刺激。在保守治疗中,再次断裂的几率较高,同时还有肌腱形态的改变、肌腱延长、复杂区域疼痛综合征、骨筋膜室综合征、深静脉血栓形成、肌肉萎缩、失去工作能力和其他功能的可能[25]。断裂的肌腱在持续性地恢复中导致腱的延长,推力减少,肌肉无力,步态异常和需要重复手术及跟腱缩短[26, 27]。
对于日常低耗能活动中持续跟腱断裂的患者,术后感染率会更高。无论是有或没有症状的,(跟腱)断裂是腱病的次级病变,伴随着患者其他整体因素,如吸烟/糖尿病和皮质类固醇的使用[27, 28]。 3 急性跟腱断裂修复后的跟腱疼痛
跟腱修复处的疼痛发生率因人而异,可以高达67%,与修复的方式存在关联。跟腱疼痛可影响患者的运动或导致其他活动受限[29]。
急性跟腱断裂修复后跟腱疼痛的病因仍不清楚。推测可能的病因是不可吸收的缝线引起肉芽肿形成,或者是新的瘢痕组织刺激跟腱内部,出现疼痛阈值改变而引起疼痛,或者是2次刺激使得跟腱变大,腱周围膨胀而引起疼痛[29]。在原跟腱断裂行手术修复区域,3年后局部仍感疼痛,而这些区域的微循环血流模式已经改变,表明局部的血供已经增强[30]。患者感到疼痛的部位,通常和血供增加的区域存在明显的关联性。这可能和新生血管容易导致肌腱病有关[30]。众所周知,修复术后新生血管形成跟并发在内部生长的神经末梢相关,这也被认为是导致术后跟腱疼痛的原因[30, 31, 32]。
断裂的跟腱在修复后,腱的周围会出现纤维化,在腱周围粘附的覆盖率为1%~18.6%,这也会出现功能下降的结果[33, 34]。严重挤压伤的屈 长肌和覆盖在肌肉破裂的筋膜,复合肌腱断裂,长期暴露在空气中,病灶纤维化的大量缝合线和术后长期的固定导致了症状性腱旁周围的粘附[35]。虽然
长肌和覆盖在肌肉破裂的筋膜,复合肌腱断裂,长期暴露在空气中,病灶纤维化的大量缝合线和术后长期的固定导致了症状性腱旁周围的粘附[35]。虽然 长屈肌转位被提出刺激退化跟腱的再生,肌肉附着在肌腱上也可能是跟腱疼痛的部分原因,因为在严重挤压伤后,肌肉变得纤维化,没有弹性[35]。我们认为,这种情况可模拟发生于慢性跟腱周围的病变中。在跟腱周围的病变中,尤其是肌成纤维细胞会出现在瘢痕形成的部位。这些细胞可能在临床表现上具有重要作用,因为它们能在腱的周围粘连,诱导和保持长期收缩的状态。这种粘连会导致增加腱内部的紧张和压力,并阻止其正常滑动,增加肌腱、腱旁、小腿筋膜和上覆皮肤之间的摩擦。跟腱周围的增生性结缔组织也可能导致血管腔的收缩,损坏其循环,进一步促使跟腱周围有病变的患者发病[36]。事实上,相对于肌腱周围的病变,在跟腱修复后的患者中围绕肌腱的腱纤维化更广泛。修复部位的腱旁组织血管可能会被损坏或不能充分地渗入肥大肌腱的中心,以促进肌腱中心的恢复[37]。在跟腱断裂中,潜在的肌腱病变,其发病率和严重性预计比慢性肌腱周围病变更高[38]。
长屈肌转位被提出刺激退化跟腱的再生,肌肉附着在肌腱上也可能是跟腱疼痛的部分原因,因为在严重挤压伤后,肌肉变得纤维化,没有弹性[35]。我们认为,这种情况可模拟发生于慢性跟腱周围的病变中。在跟腱周围的病变中,尤其是肌成纤维细胞会出现在瘢痕形成的部位。这些细胞可能在临床表现上具有重要作用,因为它们能在腱的周围粘连,诱导和保持长期收缩的状态。这种粘连会导致增加腱内部的紧张和压力,并阻止其正常滑动,增加肌腱、腱旁、小腿筋膜和上覆皮肤之间的摩擦。跟腱周围的增生性结缔组织也可能导致血管腔的收缩,损坏其循环,进一步促使跟腱周围有病变的患者发病[36]。事实上,相对于肌腱周围的病变,在跟腱修复后的患者中围绕肌腱的腱纤维化更广泛。修复部位的腱旁组织血管可能会被损坏或不能充分地渗入肥大肌腱的中心,以促进肌腱中心的恢复[37]。在跟腱断裂中,潜在的肌腱病变,其发病率和严重性预计比慢性肌腱周围病变更高[38]。
腱内或者腱周围的钙化在急性跟腱损伤的病例中的发生率大概为28%[39]。钙化的发展与慢性肿胀、踝关节活动范围的减少、疼痛的增加相关,尤其是钙化大于10 mm的情况。钙化的发展和手术技术、缝合材料、从损伤到手术的时间,或术后管理之间没有相关性,并且没有危险因素被证实[39]。
肥厚的肌腱对于后上跟骨结节的碰撞可能是跟腱急性断裂修复后造成跟骨疼痛的一个原因。不像Haglund 综合征,跟骨的后上边界的异常隆凸不是机械性刺激形成滑囊的表现。跟腱断裂越接近跟骨附着点和缝线材料的使用,越容易出现胶原增生产生肌腱肥大而导致局部疼痛。局部疼痛症状通常在伤后3~4个月开始,跟腱的变大也可能会有时间延迟[40]。 4 跟腱术后疼痛的临床表现
跟腱的感染应该从临床表现、理化检查、放射影像学等方面被排除。需要对患者的治疗结果进行评估,其中次要检查是测试患者站立位时的抬升后跟试验。抬升后跟的测试在跟腱恢复的过程中是早期的结果,反映大致的恢复水平,同时也影响患者角度反馈的结果和最后的体力活动恢复。治疗后运动功能和体育活动水平是进一步的结果评估[23]。
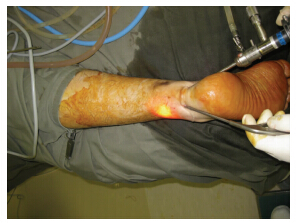
跟腱修复后的疼痛的临床表现跟慢性跟腱周围的病变类似。运动诱发的疼痛是主要症状,而劈啪声和肿胀可能会减少[1]。在前冲的步态和静态后的运动障碍期间,患者会经历严重的跟腱疼痛。用“波浪”测试(图 1)伴随向相反方向按压肌腱可以使症状重现。踝关节的运动通常不受限制,尽管患者会在踝关节弯曲的时候,跟腱紧密不适的地方会变得舒适。跟腱修复后有疼痛的患者跟那些没有疼痛的患者相比,小腿三头肌力量没有显著差异,跟腱通常会变得肥大。然而,跟腱断裂修复后肌腱的增厚是常见的,跟开放的修复和保守治疗没有任何区别。增厚和临床效果没有相关性[27]。位置和涉及的范围可以通过“按捏”试验(图 2)和“侧拉”测试(图 3)确定。这也决定了通路和内镜下的肌腱松解的范围。为了确定纤维附着物的范围,在完全松解的时候能涉及所有的肌腱,检查后间室的其他肌腱也很重要,同时也是手术成功的关键[35]。它的位置和涉及的范围建议作为跟腱修复后疼痛的分类(表 1)。
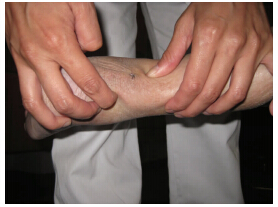 |
| 图 1 从相反方向按压跟腱可以使症状重现 |
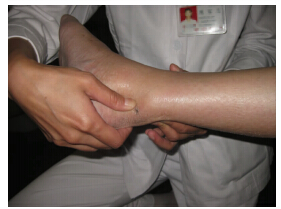 |
| 图 2 捏压跟腱及其前面部分,使得疼痛重现,呈现出疼痛的部分跟有症状的粘连物区域是相应的 |
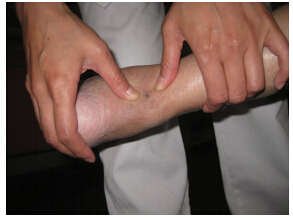 |
| 图 3 推压跟腱的侧面使得这部分的疼痛重现,它所产生的疼痛跟跟腱附作物是相应的 |
| 疼痛分级 | 位置和涉及的范围 |
| A | 跟腱中部,修复处 |
| B | 近跟骨入口处 |
| Ⅰ | 上方跟骨结节对增厚了的跟腱的碰撞(摩擦) |
| Ⅱ | 近跟骨入口一旦跟腱断裂,在后上方的跟骨结节上的纤维附着物 |
| C | 后间室内在临近的腱上并发的纤维附着物 |
因为靠近X线光可透性的Kager脂肪垫使得跟腱可以通过X线片很好的记录下来。但是对于其内部结构几乎没有信息可以提供,只有肌腱的轮廓看得出来[41]。骨质的异常,可能刺激肌腱病变(例如骨肿瘤、应力性骨折等),或者是肌腱的刺激源(如骨突、骨软骨瘤、骨赘)可以被检测到。腱内软组织钙化或骨化,这可能不显眼,且容易被曲解,或被核磁共振成像或超声成像完全漏掉[41]。
核磁共振影像可以评估肌腱的退行性改变。其探 查跟腱断裂修复后足跟部的炎症,敏感性不如Haglund’s 病症高。
超声作为一种互动的测试有其特殊的优势,操作者能够用传感器探测到受影响的区域,也可以直接通过影像表现相关疼痛的部位。当有其他无症状的病理存在的时候,这种方式对于达到相关的临床诊断是极为有价值的[41]。对于肌腱新生血管的检查和临床相关诊断,彩色多普勒超声检查是一种成熟的技术。在跟腱疼痛修复后也是有用的探测,因为潜在的肌腱病变也可能是疼痛的原因。但新血管形成的作用是有争议的。一些学者认为,新生血管和疼痛之间是相关的,而其他作者认为,新血管跟它没有关系,只是对诊断和预后提供了额外的价值[1]。合理的临床检查仍然是诊断和处理方式选择的主要依据[42]。 5 治疗原则
目前还没有很好的确定跟腱修复后疼痛的非手术治疗方案。因为腱病的变化与跟腱修复后的疼痛有一定关系,无创经皮措施处理跟腱病变,比如离心型运动,体外冲击波疗法,局部的三硝酸甘油酯和腱内注射皮质类固醇、抑肽酶、聚乙醇单十二醚、富含血小板的血浆、自体的血液或高剂量的盐水都可以尝试。离心的腓肠肌训练、局部注射聚乙醇单十二醚、硬化剂以及血管内皮细胞(VEGF)抑制可以减少腱的新血管停止或使新生血管区域血液在管内的流动[9, 31]。局部三硝酸甘油酯的治疗已被证实可以促进毛细血管静脉流出在断裂的跟腱之前,在插入口上的中部4 cm处[30]。
如果非手术治疗无效,肌腱粘连松解术和清创术可以考虑,用以缓解肌腱粘连的症状。典型的开放性手术使用多个纵向切口,探测和去除腱内的粘附物,并恢复血管和可能刺激潜在的活细胞以引发细胞基质响应和恢复,其目的是切除纤维附着物和移除没有恢复的区域[43]。这需要大量的暴露。其表示另一种手术侵入以前的创伤和手术的区域,并且可以增大腱上复发附着物、伤口破裂和感染的可能性[35]。另一方面,内镜的粘连松解术、去神经和斑块切除旨在中断异常的新生的神经支配,从而中断修复肌腱疼痛冲动传递。这被认为是与更少对深部结构的显露、较少的伤口并发症、更少的瘢痕形成,以及更好的外观效果相关联。患者增厚的跖肌腱位于靠近内侧缘修复的跟腱在慢性、疼痛、中间肌腱病变的患者普遍存在,也可能导致腿的僵硬[44]。这些症状可能需要跖肌肌腱的内镜切除处理[45]。 6 内镜松解术的方法
用内镜技术可以有效地松解跟腱,去除粘连带。那些跟腱修复后疼痛的患者,腿部有明显紧张感和在走路或锻炼时局部存在不适,而踝关节背伸不受限,可能最适合内镜的肌腱松解术[32]。
患者在俯卧位同时施加止血带到同侧的大腿,从后内侧和外侧通路沿跟腱边缘近侧插入口到跟骨(图 4)。用关节镜剃刀切除跟腱前方表面厚的瘢痕组织(图 5)。确定沿肌腱内侧面的跖肌腱,然后切除。将跟腱边缘的瘢痕组织用刨刀清除,使得跟腱从瘢痕中游离出来。清创应延伸到 长屈肌腱以确保完全切除深部瘢痕组织。肌腱松解术可以延伸到跟腱背侧以完全清除瘢痕组织[32]。对于有大量纤维化,没有瘢痕在跟腱远端的病例,可以内镜探查跟腱和追踪到跟腱近端的瘢痕部分以确认。这可以确保适当的病变平面、避免对跟腱医源性的损害。完整的松解周围、整个有瘢痕的跟腱是手术成功的关键。为了达到整个被附着的跟腱部分,也需要近端的通路[35]。在后间室任何和其他肌腱共存的纤维也应该被松解[35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46]。术后1 d患者可以完全负重行走,可进行跟腱的伸展运动。
长屈肌腱以确保完全切除深部瘢痕组织。肌腱松解术可以延伸到跟腱背侧以完全清除瘢痕组织[32]。对于有大量纤维化,没有瘢痕在跟腱远端的病例,可以内镜探查跟腱和追踪到跟腱近端的瘢痕部分以确认。这可以确保适当的病变平面、避免对跟腱医源性的损害。完整的松解周围、整个有瘢痕的跟腱是手术成功的关键。为了达到整个被附着的跟腱部分,也需要近端的通路[35]。在后间室任何和其他肌腱共存的纤维也应该被松解[35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46]。术后1 d患者可以完全负重行走,可进行跟腱的伸展运动。
 |
| 图 4 从后中路和后外侧通路内镜下的跟腱手术是沿着跟腱边缘,从它的切口附件进入跟骨 |
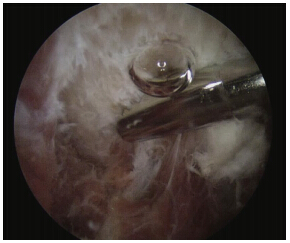 |
图 5 关节镜下从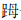 长屈肌观察到跟腱松解后的纤维附着物 长屈肌观察到跟腱松解后的纤维附着物 |
腓肠神经在跟腱松解的过程中存在风险,因为神经可能被嵌入瘢痕组织里,再依附在跟腱上[35]。老年患者较年轻患者有更高的医源性神经损伤的风险,因为其神经走向跟靠近于跟腱。术中超声检查可能是一种有用的方式,以防止在跟腱手术中对腓肠神经的损伤[8]。但是在术后,它可能是不实用的,因为纤维化使得使腓肠神经很难被识别。
急性跟腱断裂修复后的足跟部疼痛是由增厚的肌腱对后上跟骨结节的碰撞而产生。这可以通过内镜辅助下的手术得到有效的治疗。实施内镜辅助下跟骨突起部分成行手术,取代跟腱松解术,从而避免实施跟腱松解术导致跟腱强度下降或者从跟骨附着处撕脱的潜在风险。 7 展望
目前,国际上未见对于采用内镜技术处理跟腱修复后的疼痛治疗的临床随机对照研究,一些散在的个案报道[32, 35, 40]提示:内镜处理的临床效果是基本良好的。结合我们的临床手术治疗,我们认为:内镜下肌腱松解术治疗急性跟腱断裂修复后的跟腱疼痛,创伤小,具有较好的临床近期疗效,具有可行性;但是其安全性和有效性还需要大样本量的研究证实。
| [1] | Del-Buono A, Chan O, Maffulli N. Achilles tendon: functional anatomy and novel emerging models of imaging classification[J]. Int Orthop, 2013, 37(4): 715-721. |
| [2] | Szaro P, Witkowski G, Smigielski R, et al. Fascicles of the adult human Achilles tendon—an anatomical study[J]. Ann Anat, 2009, 191(6): 586-593. |
| [3] | Doral M N, Alam M, Bozkurt M, et al. Functional anatomy of the Achilles tendon[J]. Knee Surg Sports Traumatol Arthrosc, 2010, 18(5): 638-643. |
| [4] | Gheno R, Nico M A, Buck F M, et al. Edematous processes within Kager fat pad: magnetic resonance imaging, gross anatomical, and histological studies in cadavers with clinical correlation[J]. J Comput Assist Tomogr, 2010, 34(4): 621-625. |
| [5] | Theobald P, Bydder G, Dent C, et al. The functional anatomy of Kager’s fat pad in relation to retrocalcaneal problems and other hindfoot disorders[J]. J Anat, 2006, 208(1): 91-97. |
| [6] | Chen T M, Rozen W M, Pan W R, et al. The arterial anatomy of the Achilles tendon: anatomical study and clinical implications[J]. Clin Anat, 2009, 22(3): 377-385. |
| [7] | Cohen J C. Anatomy and biomechanical aspects of the gastrocsoleus complex[J]. Foot Ankle Clin, 2009, 14(4): 617-626. |
| [8] | Kammar H, Carmont M R, Kots E, et al. Anatomy of the sural nerve and its relation to the achilles tendon by ultrasound examination[J]. Orthopedics, 2014, 37(3): e298-e301. |
| [9] | Pufe T, Petersen W J, Mentlein R, et al. The role of vasculature and angiogenesis for the pathogenesis of degenerative tendons disease[J]. Scand J Med Sci Sports, 2005, 15(4): 211-222. |
| [10] | van-Sterkenburg M N, Kerkhoffs G M, Kleipool R P, et al. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study[J]. J Anat, 2011, 218(3): 336-341. |
| [11] | Khan R J, Carey-Smith R L. Surgical interventions for treating acute Achilles tendon ruptures[J]. Cochrane Database Syst Rev, 2010(9): CD003674. |
| [12] | McMahon S E, Smith T O, Hing C B. A meta-analysis of randomised controlled trials comparing conventional to minimally invasive approaches for repair of an Achilles tendon rupture[J]. Foot Ankle Surg, 2011, 17(4): 211-217. |
| [13] | Jiang N, Wang B, Chen A, et al. Operative versus nonoperative treatment for acute Achilles tendon rupture: a meta-analysis based on current evidence[J]. Int Orthop, 2012, 36(4): 765-773. |
| [14] | Wilkins R, Bisson L J. Operative versus nonoperative management of acute Achilles tendon ruptures: a quantitative systematic review of randomized controlled trials[J]. Am J Sports Med, 2012, 40(9): 2154-2160. |
| [15] | Phisitkul P. Endoscopic surgery of the Achilles tendon[J]. Curr Rev Musculoskelet Med, 2012, 5(2): 156-163. |
| [16] | Karabinas P K, Benetos I S, Lampropoulou-Adamidou K, et al. Percutaneous versus open repair of acute Achilles tendon ruptures[J]. Eur J Orthop Surg Traumatol, 2014, 24(4): 607-613. |
| [17] | Gigante A, Moschini A, Verdenelli A, et al. Open versus percutaneous repair in the treatment of acute Achilles tendon rupture: a randomized prospective study[J]. Knee Surg Sports Traumatol Arthrosc, 2008, 16(2): 204-209. |
| [18] | Mafulli N. Rupture of the Achilles tendon[J]. J Bone Joint Surg Am, 1999, 81(7): 1019-1036. |
| [19] | Fortis A P, Dimas A, Lamprakis A A. Repair of Achilles tendon rupture under endoscopic control[J]. Arthroscopy, 2008, 24(6): 683-688. |
| [20] | Lui T H. Endoscopic-assisted Achilles tendon repair with plantaris tendon augmentation[J]. Arthroscopy, 2007, 23(5): 556.e1-556.e5. |
| [21] | Tang K L, Thermann H, Dai G, et al. Arthroscopically assisted percutaneous repair of fresh closed achilles tendon rupture by Kessler’s suture[J]. Am J Sports Med, 2007, 35(4): 589-596. |
| [22] | Khan R J, Fick D, Keogh A, et al. Treatment of acute achilles tendon ruptures. A meta-analysis of randomized, controlled trials[J]. J Bone Joint Surg Am, 2005, 87(10): 2202-2210. |
| [23] | Kolodziej L, Bohatyrewicz A, Kromuszczynska J, et al. Efficacy and complications of open and minimally invasive surgery in acute Achilles tendon rupture: a prospective randomised clinical study—preliminary report[J]. Int Orthop, 2013, 37(4): 625-629. |
| [24] | Doral M N. What is the effect of the early weight-bearing mobilisation without using any support after endoscopy-assisted Achilles tendon repair?[J]. Knee Surg Sports Traumatol Arthrosc, 2013, 21(6): 1378-1384. |
| [25] | Rosso C, Vavken P, Polzer C, et al. Long-term outcomes of muscle volume and Achilles tendon length after Achilles tendon ruptures[J]. Knee Surg Sports Traumatol Arthrosc, 2013, 21(6): 1369-1377. |
| [26] | Maffulli N, Spiezia F, Longo U G, et al. Z-shortening of healed, elongated Achilles tendon rupture[J]. Int Orthop, 2012, 36(10): 2087-2093. |
| [27] | Molloy A, Wood E V. Complications of the treatment of Achilles tendon ruptures[J]. Foot Ankle Clin, 2009, 14(4): 745-759. |
| [28] | Pajala A, Kangas J, Ohtonen P, et al. Rerupture and deep infection following treatment of total Achilles tendon rupture[J]. J Bone Joint Surg Am, 2002, 84-A(11): 2016-2021. |
| [29] | Rebeccato A, Santini S, Salmaso G, et al. Repair of the achilles tendon rupture: a functional comparison of three surgical techniques[J]. J Foot Ankle Surg, 2001, 40(4): 188-194. |
| [30] | Osadnik R, Redeker J, Kraemer R, et al. Microcirculatory effects of topical glyceryl trinitrate on the Achilles tendon microcirculation in patients with previous Achilles tendon rupture[J]. Knee Surg Sports Traumatol Arthrosc, 2010, 18(7): 977-981. |
| [31] | Ohberg L, Alfredson H. Effects on neovascularisation behind the good results with eccentric training in chronic mid-portion Achilles tendinosis? [J]. Knee Surg Sports Traumatol Arthrosc, 2004, 12(5): 465-470. |
| [32] | Lui T H. Endoscopic Achilles tenolysis for management of heel cord pain after repair of acute rupture of Achilles tendon[J]. J Foot Ankle Surg, 2013, 52(1): 125-127. |
| [33] | Ahn J H, Choy W S. Tendon adhesion after percutaneous repair of the Achilles tendon: a case report[J]. J Foot Ankle Surg, 2011, 50(1): 93-95. |
| [34] | Mukundan C, El-Husseiny M, Rayan F, et al. “Mini-open” repair of acute tendo Achilles ruptures—the solution?[J]. Foot Ankle Surg, 2010, 16(3): 122-125. |
| [35] | Lui T H. Endoscopic adhesiolysis for extensive tibialis posterior tendon and Achilles tendon adhesions following compound tendon rupture[J]. BMJ Case Rep, 2013, 2013.pii: bcr2013200824. |
| [36] | Paavola M, Jarvinen T A. Paratendinopathy[J]. Foot Ankle Clin, 2005, 10(2): 279-292. |
| [37] | Gibbon W W, Cooper J R, Radcliffe G S. Sonographic incidence of tendon microtears in athletes with chronic Achilles tendinosis[J]. Br J Sports Med, 1999, 33(2): 129-130. |
| [38] | Tallon C, Maffulli N, Ewen S W. Ruptured Achilles tendons are significantly more degenerated than tendinopathic tendons[J]. Med Sci Sports Exerc, 2001, 33(12): 1983-1990. |
| [39] | Kraus R, Stahl J P, Meyer C, et al. Frequency and effects of intratendinous and peritendinous calcifications after open Achilles tendon repair[J]. Foot Ankle Int, 2004, 25(11): 827-832. |
| [40] | Lui T H. Retrocalcaneal pain after the repair of acute Achilles tendon rupture[J]. Foot Ankle Spec, 2013, 6(4): 323-327. |
| [41] | Peduto A J, Read J W. Imaging of ankle tendinopathy and tears[J]. Top Magn Reson Imaging, 2010, 21(1): 25-36. |
| [42] | Tol J L, Spiezia F, Maffulli N. Neovascularisation in Achilles tendinopathy: have we been chasing a red herring?[J]. Knee Surg Sports Traumatol Arthrosc, 2012, 20(10): 1891-1894. |
| [43] | Maffulli N, Longo U G, Loppini M, et al. New options in the management of tendinopathy[J]. Open Access J Sports Med, 2010, 1: 29-37. |
| [44] | Alfredson H. Midportion Achilles tendinosis and the plantaris tendon[J]. Br J Sports Med, 2011, 45(13): 1023-1025. |
| [45] | van-Sterkenburg M N, van-Dijk C N. Mid-portion Achilles tendinopathy: why painful? An evidence-based philosophy[J]. Knee Surg Sports Traumatol Arthrosc, 2011, 19(8): 1367-1375. |
| [46] | Lui T H. Endoscopic adhesiolysis of the flexor hallucis longus muscle[J]. Foot Ankle Spec, 2014, 7(6): 492-494. |



