2400016 重庆,重庆医科大学基础医学院:第一临床学院
2the First Clinical College of Chongqing Medical University,Chongqing,400016,China
核糖核酸酶抑制因子(ribonuclease inhibitor,RI)是胞浆内酸性蛋白的一种,包含有460个氨基酸残基,相对分子质量约为50×103,在核酸的代谢中起着重要的作用,RI与核糖核酸酶A(RNaseA)结合形成复合物,抑制90%以上的RNaseA活性,使RNA降解减慢或抑制,延长它的半衰期。RI中有7个串联的亮氨基酸残基的重复片段(leucin-rich repeat,LRR),同样存在LRR重复顺序的一百多种蛋白质显示了广泛的功能,包括细胞周期调节、DNA修复、细胞黏附、对细胞外基质相互作用、信号转导、RNA剪切以及抑制酶活性等许多重要的生物学过程[1, 2]。亮氨酸拉链结构与蛋白质相互作用有关;LRR结构也多见于真核生物转录因子DNA 结合蛋白的C 端,两条肽链呈钳状与 DNA相结合,与癌基因表达调控有关[3]。因此,根据蛋白质结构为目标的结构基因组学,RI可能具有除抑制RNaseA外还存在尚未知的生物学功能。整合素连接激酶(integrin-linked kinase,ILK)在调控细胞的生长、分化、黏附、迁移、侵袭、血管生成及EMT等基本过程中起了核心的作用[4]。我们前期工作发现下调RI能使膀胱癌细胞Akt和GSK-3β磷酸化水平增加,并且能显著促进了膀胱癌细胞的上皮间质转化(epithelial-mesenchymal transition,EMT)和侵袭、转移;RI过表达能够抑制B16细胞的侵袭和转移[5];RI与ILK在细胞质中存在表达共定位和负相关等[6, 7]。然而,这些研究还未能全面阐明RI的功能及其抑癌的分子机制。因此,推测RI抑制肿瘤细胞生长和增殖的机制可能是通过调节ILK信号通路。为了摸索RI的功能,本实验构建了RI的真核表达质粒,研究RI的过表达对B16细胞增殖、凋亡的影响以及作用的分子机制,为肿瘤的诊断和治疗提供新的思路和理论依据。
1 材料与方法 1.1 主要试剂与材料B16 黑色素瘤细胞来自中国科学院上海生命科学研究院生物化学与细胞生物学研究所;C57BL/6小鼠购自重庆医科大学实验动物中心。TRIzol试剂盒、2×TaqMix、SalⅠ、质粒抽提纯化试剂盒、逆转录试剂盒等购自大连宝生物公司;标准胎牛血清、RPMI1640培养基购自天津灏洋(TBD)公司;RI抗体(兔抗人)自己制备;Bax、Bcl-2、Casepase-3、β-actin购自美国Bioworld公司;Hoechst 33342试剂、TUNEL凋亡检测试剂盒购自Biyotime生物技术公司; Lipofectamine 2000购自Invitrogen公司。
1.2 方法 1.2.1 pIRES2-EGFP-RI 真核表达载体的构建与鉴定从GenBank中获得RI cDNA序列(NM_002939)后设计和合成引物。上游引物:5′-CG GAATTC CTTCACCTCCACCATGAGC-3′;下游引物:5′-GC GTCGAC -AGGAAGACCTCAGGAGAT-3′;分别在上游引物5′端加入EcoRⅠ酶切位点(下划线)和下游引物5′端加入SalⅠ酶切位点(下划线)。引物由生工生物工程(上海)有限公司合成。用TRIzol提取人7703细胞的mRNA,逆转录合成cDNA后PCR扩增RI基因,在1%琼脂糖进行凝胶电泳检测PCR产物,然后产物胶回收纯化,酶切、连接、转化,挑选单菌落扩增,提取重组质粒,经EcoRⅠ和SalⅠ双酶切双酶切鉴定并送华大基因公司测序,将阳性质粒命名为 pIRES2-EGFP-RI。
1.2.2 黑色素瘤B16细胞的培养及转染 1.2.2.1 细胞的培养黑色素瘤B16 细胞用含10% FBS的RPMI1640培养基(含青霉素和链霉素浓度均为1×105 U/L),于37 ℃和5% CO2的培养箱中培养。
1.2.2.2 细胞的转染和分组取对数生长期的细胞接种于6孔培养板中,约80%细胞融合度时,用脂质体 Lipofectamine 2000分别转染不同的质粒到细胞中,根据未转染或转染质粒不同分别命名为B16组、B16 vector vector 组、B16-RI组。每组设3个复孔,按照试剂说明书进行操作。
1.2.3 建立稳定转染人RI的小鼠黑色素瘤B16细胞系将pIRES2-EGFP-RI质粒和空质粒pIRES2-EGFP 分别转染B16细胞,转染24 h后,按1 ∶3进行传代培养,转染48 h后,改用含1 000 g/mL G418 10% 血清的培养基培养,筛选10~14 d后,采取有限稀释法,挑取单个有荧光细胞于96孔板中培养10~15 d后,将孔中生长的单克隆细胞团块消化下来后逐级扩大培养,得到单克隆细胞系。
1.2.4 各组细胞RI基因表达的检测 1.2.4.1 RI基因mRNA转录水平的检测用TRIzol 抽提各组细胞总RNA,RT-PCR 试剂盒(TaKaRa公司)测定RI mRNA的水平,RI基因上游引物:5′-TCAGCGACAACCTCTTGGG-3′,下游引物: 5′-CACAATGCCGCACAGGTC-3′,扩增产物约310 bp; GAPDH 基因上游引物:5′-GCTGTCCCTGTCGCCTCTG-3′,下游引物: 5′-TGCCGATGGTGATGACCTGG-3′,扩增产物约330 bp。PCR 产物经2%琼脂糖凝胶电泳检测后,由Bio-Rad凝胶成像仪摄取凝胶图像,用Quantity One进行RI与GAPDH相对强度的比率分析。
1.2.4.2 Western blot检测RI蛋白的表达用蛋白裂解液(106/100 μL) 抽提各组细胞的总蛋白,经10% SDS-PAGE 凝胶电泳,常规湿法转膜,5% 脱脂奶粉封闭2 h,一抗4 ℃ 孵育过夜(兔抗人RI 1 ∶500,兔抗人β-actin 1 ∶1 000),羊抗兔(1 ∶3 000) 二抗 37 ℃孵育 2 h,ECL 化学发光显色,Bio-Rad凝胶成像仪下观察照相并用 Quantity One 进行RI与β-actin 相对强度的比率分析。
1.2.5 细胞免疫荧光检测取细胞爬片,待细胞达80%~90%汇合度时,80%冰丙酮固定10 min,3% BSA的PBS在37 ℃孵育30 min,分别以RI抗体(1 ∶200 稀释)、p-Akt (S473)抗体和p-GSK3β (S9)抗体(1 ∶200稀释)4 ℃孵育过夜,PBS清洗3次,羊抗兔IgG-TRITC标记和的二抗(1 ∶100)在37 ℃ 避光孵育1 h,PBS清洗3次×5 min,50%甘油封片。使用Olympus 多功能显微镜观察并拍照。
1.2.6 MTT检测B16细胞的增殖将对数期各组细胞,以2×103/孔接种于96孔培养板进行常规培养,,同时每组设8个复孔,分别在24、48、72、96、120 h时加20 μL/孔 MTT溶液并再培养4 h,吸弃培养基,加150 μL DMSO/孔,490 nm波长下用酶联免疫检测仪检测各孔D(490)值。细胞增殖抑制率=[1-实验组D(490)均值/对照组D(490)均值]×100%。
1.2.7 流式细胞术分析细胞周期及凋亡分别取同条件下培养的同时间传代的各组细胞B16,胰酶消化后,PBS 洗涤1次,低速离心收集细胞,分两部分处理,一部分细胞用70%乙醇4 ℃固定4 h以上,另一部分无需固定,直接检测,固定细胞用来测周期,未固定组测凋亡,每个样本一式3份,并重复3次。
1.2.8 TUNEL检测细胞和肿瘤组织的凋亡肿瘤组织冰冻切片和盖玻片上的细胞用4%多聚甲醛里固定1 h;滴加预冷的0.1% Triton X-100,冰上放置2 min;PBS清洗3次,滴加50 μL TUNEL试剂于每个盖玻片上,孵育60 min在避光和37 ℃条件下,PBS洗3次,中性抗荧光淬灭剂封片后荧光显微镜下观察并拍照。
1.2.9 Hoechst 33342 检测细胞凋亡各组细胞接种于放有盖玻片的6孔板中,待细胞生长至汇合度70%左右,PBS洗3次,4%多聚甲醛固定1 h;PBS洗3次,按比例稀释Hoechst 33342 检测液后滴加到盖玻片上,常温避光孵育5~10 min,PBS洗3次,封片后,在荧光显微镜下观察并拍照。
1.2.10 Western blot检测凋亡相关蛋白及ILK信号通路蛋白的表达蛋白裂解液提取各组细胞总蛋白,12% SDS-PAGE 凝胶电泳、常规湿法转膜、5%脱脂 奶粉封闭2 h,一抗4 ℃孵育过夜,兔抗Bcl-2、Bax和Caspase-3(1 ∶150),p-AKT、p-GSK3β和β-catenin(1 ∶500),鼠抗ILK(1 ∶200)和兔抗β-actin(1 ∶1 000),羊抗鼠或羊抗兔二抗(1 ∶2 000)常温孵育2 h,ECL发光显色并进行与actin相对强度的比率分析,实验重复3次。
1.2.11 动物实验检测上调RI对B16细胞生长、凋亡的影响 1.2.11.1 动物移植瘤模型收集对数期细胞,用PBS制备2×106/mL的各组细胞悬液,分别将上述制备的各组细胞悬液接种0.1mL于C57BL/6小鼠左腋皮下,每组8只。记录各组肿瘤形成时间,21 d后处死老鼠,称取肿瘤的重量,计算每组平均值,并计算抑瘤率。抑瘤率=(1-实验组平均瘤质量/对照组平均瘤质量)×100%。
1.2.11.2 HE染色用10%甲醛溶液固定肿瘤组织,5 μm切片,二甲苯、梯度乙醇脱蜡后进行HE染色,中性树胶封片,显微镜下观察并拍照。
1.2.11.3 免疫组织及免疫荧光化学观察各组移植瘤中RI、CD31和ILK信号通路蛋白的表达免疫组织化学:已固定的肿瘤组织石蜡包埋后5 μm切片并脱蜡,按免疫组化试剂盒的步骤对过氧化物酶进行灭活和枸橼酸钠修复抗原,PBS洗3次,5%羊血清封闭,一抗β-catenin、RI、ILK(1 ∶100),4 ℃孵育过夜,PBS洗3次,滴加生物素化山羊抗兔,37 ℃,孵育30 min,PBS洗3次,滴加链霉素抗生素-过氧化物酶溶液37 ℃孵育20 min,PBS洗3次,DAB显色,复染,晾干,中性树脂封片,观察拍片。免疫荧光化学:肿瘤组织经冰冻切片后,4%多聚甲醛固定15 min,自然风干后-80 ℃保存备用。取出切片,PBS 漂洗3次;用0.1% Triton X-100 通透15 min;PBS冲洗3次。用3%双氧水灭活内源性过氧化物酶20 min,3% BSA溶液封闭30 min后,分别用PBS稀释的兔抗p-Akt(S473)、p-GSK 3β(S9)、CD31 (1 ∶100稀释)一抗于4 ℃ 孵育过夜;PBS洗3次。 用FITC标记的羊抗兔IgG(1 ∶100)二抗37 ℃ 避光孵育1 h;PBS洗3次;抗荧光淬灭剂封片,荧光显微镜观察并拍照。
1.3 统计学分析采用SPSS 11.5软件进行统计分析,实验数据以x±s 表示,实验组与两个对照组间比较采用单因素方差分析,以P<0.05为差异有统计意义。
2 结果 2.1 重组质粒pIRES2-EGFP-RI的鉴定双酶切后产生两条带,分别为1 400 bp和5 300 bp 左右,酶切结果与预期一致,证明目的载体中已成功插入人RI基因,在NCBI里比对质粒的测序结果,完全正确,表明成功构建载体(图 1)。
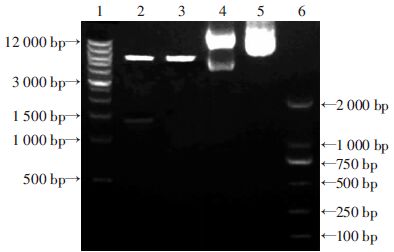
|
| 1: DNA 标准(DL 12 000); 2:pIRES2-EGFP-RI酶切; 3: pIRES2-EGFP 酶切; 4: pIRES2- EGFP 质粒; 5: pIRES2- EGFP-RI 质粒; 6: DNA 标准(DL 2000) 图 1 pIRES2-EGFP-RI重组质粒EcoRⅠ和 SalⅠ双酶切 |
半定量RT-PCR结果见图 2A,实验组与转空质粒组、未转染组2个对照组相比,B16-RI组细胞转录的RI mRNA分别升高了149%和91%,差异显著(P<0.01)。如图 2B所示,与对照组相比,B16-RI组细胞RI蛋白表达量分别升高了162%和97%(P<0.01)。与对照组相比,B16-RI组细胞,其胞浆荧光强度明显增强(图 2C),显示胞浆中的RI含量显著升高。这和Western blot 结果一致。

|
| A:RT-PCR检测各组细胞RI mRNA的表达;M:标准;1,4: B16组; 2,5: B16 vector 组; 3,6: B16-RI组;1~3: RI mRNA; 4~6: GAPDH mRNA;B:Western blot检测各组细胞RI蛋白的表达,1:B16-RI组;2:B16 vector组;3:B16组;C:免疫荧光检测各组细胞RI蛋白的表达(×200) 图 2 B16 细胞过表达RI的鉴定 |
B16-RI组细胞的D(490)值在接种后72 h后开始明显低于B16 vector和B16组(P<0.05)的细胞,接种120 h时,其细胞增殖的抑制率为43.29%,而2对照组间无明显差异,表明RI的过表达后可以明显降低细胞的增殖能力。流式检测细胞周期分布,结果显示:B16-RI组分别与B16 vector组和B16组相比,S期分别增加了(20.85±2.24)%和(23.88±4.37)%(P<0.05),代表着S期的细胞显著增多,而G1、G2期时细胞的数量明显减少,表明RI基因的上调表达,可以抑制B16黑色素瘤细胞增殖,将细胞在阻滞在S期(P<0.05,图 3)。
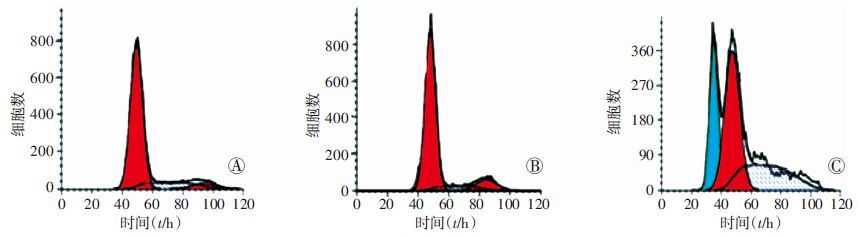
|
| A:B16组;B:B16 vector组;C:B16-RI组 图 3 流式细胞仪检测细胞增殖及周期分布 |
Hoechst33342检测结果显示B16-RI组的细胞呈现了明显的凋亡形态,如染色质发生凝集,大多细胞核发生皱缩,有高亮的凋亡小体及核碎块出现,而对照组细胞几乎未见,显示B16-RI组的细胞发生凋亡(图 4A)。TUNEL检测结果如图 4B和4C所示,B16-RI组在体内外出现大量带有高亮的荧光细胞(即凋亡细胞)。
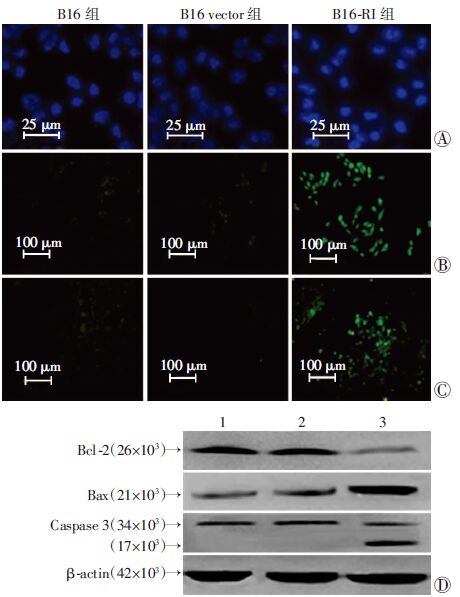
|
| A:Hochest33342染色;B:TUNEL 检测细胞凋亡;C:TUNEL 检测肿瘤组织细胞凋亡;D:Western blot 检测细胞中凋亡相关蛋白的表达,1:B16组,2:B16 vector组,3:B16-RI组 图 4 过表达RI诱导B16细胞的凋亡 |
而B16和B16 vector 组带有高亮的荧光细胞少,即细胞凋亡的少。流式检测细胞凋亡结果显示(图 4D),B16-RI组细胞大约有(57.90±5.20)% 的凋亡细胞,而 B16 vector组和B16组仅有(7.17±1.80)%和(2.86±0.50)% 的凋亡细胞。Western blot 检测细胞中凋亡相关蛋白的表达水平,Bcl-2的表达量在B16-RI组中下降,而Bax却上升,同时激活的Casepase-3表达也增加(P<0.01,图 4E)。以上实验表明RI的过表达诱导了B16细胞的凋亡。
2.5 过表达RI对细胞ILK/PI3K/AKT信号通路蛋白表达的影响为了研究RI上调表达促进凋亡和抑制细胞增殖的分子机制,我们检测了ILK/PI3K/AKT通路中重要的分子的表达量,如图 5A和5B,结果发现当上调RI时ILK、p-Akt、p-GSK3β和β-catenin的表达都明显降低,在B16-RI组中其表达的量相对于2个对照组平均水平分别下降了89.89%、71.46%、91.48%和65.4% (P<0.05,P<0.01),而Akt和GSK3β的蛋白表达水平没有明显改变。免疫细胞荧光进一步检测p-Akt和p-GSK3β的表达,从图 5C中我们可以看出,在B16-RI组细胞中其荧光强度显著减弱,说明p-Akt和p-GSK3β的蛋白表达水平下降,与Western blot 结果一致。
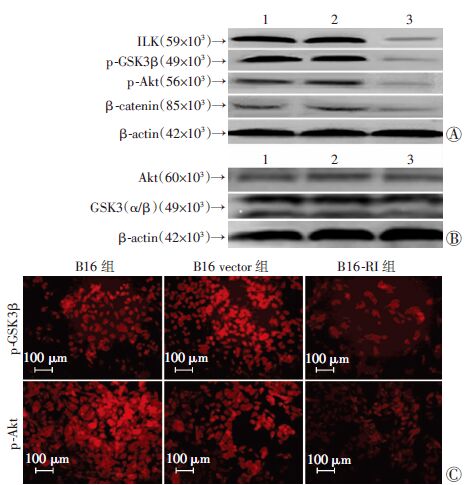
|
| A:Western blot检测ILK、p-Akt、p-GSK3β和β-catenin的表达;B:Western blot检测Akt和GSK3β的蛋白表达 1:B16组,2:B16 vector组,3:B16-RI组;C:免疫细胞荧光检测p-Akt和 p-GSK3β的表达 图 5 过表达RI对ILK/PI3K/AKT信号通路蛋白表达的影响 |
接种后9 d,发现B16和 B16 vector对照细胞组接种的C57BL/6小鼠有肿瘤的生长,B16-RI细胞组于接种后15 d开始出现肿瘤,喂养21 d处死小鼠,取出肿瘤并称重量,B16、B16 vector和B16-RI组肿瘤的平均质量分别为(5.235±1.687)、(5.400±0.968)、(0.273±0.115)g,B16-RI组与B16和B16 vector组相比,肿瘤的重量明显减小(P<0.01);抑瘤率分别为94.8%和94.95%。肿瘤组织冰冻切片的CD31免疫荧光和常规石蜡切片的HE染色结果显示:B16、B16 vector和B16-RI组肿瘤组织微血管密度分别为(17.5± 2.8)、(14.8±2.5)、(6.2±1.8)个,B16-RI组与B16和B16 vector组相比,B16-RI组的肿瘤组织微血管密度比照组明显减少(P<0.01),说明RI过表达能够显著抑制微血管的生成。
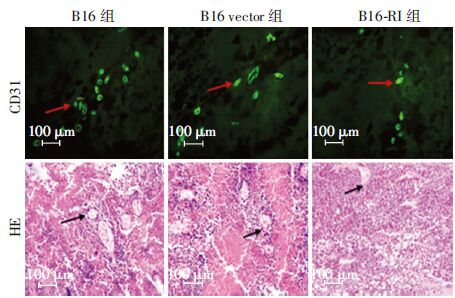
|
| 箭头所指为肿瘤微血管 图 6 过表达RI对黑色素瘤细胞血管生成的影响 |
免疫组化结果显示,当RI过表达时,在B16和B16 vector组肿瘤组织中ILK、β-catenin蛋白高表达,而在B16-RI组中其表达显著降低(图 7A)。组织免疫荧光结果可见,在B16和B16 vector组p-Akt和p-GSK3β的荧光信号强烈,而B16-RI组荧光信号很微弱(图 7B)。表明上调RI抑制了ILK、β-catenin、p-Akt和p-GSK3β蛋白在小鼠移植瘤组织中的表达。
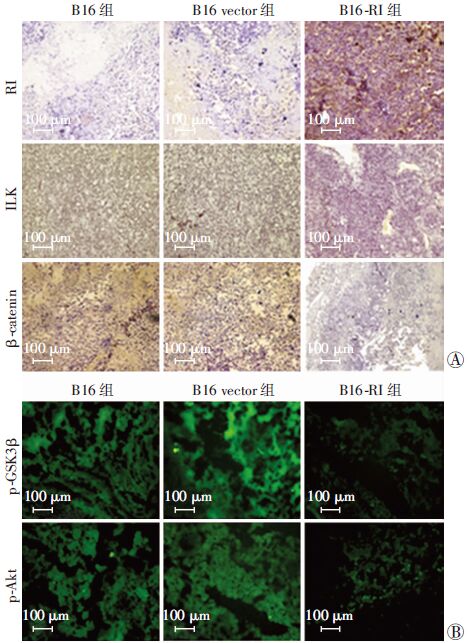
|
| A:免疫组化检测肿瘤组织中RI、ILK和β-catenin的表达;B:免疫荧光检测肿瘤组织中p-Akt和p-GSK3β的表达 图 7 过表达RI对体内肿瘤组织ILK/PI3K/AKT信号通路蛋白表达的影响 |
核糖核酸酶抑制因子(RI)被认为是一个重要蛋白质调节分子,有着多个功能:(1)RI参与了细胞内RNA水平的调节;(2)RI可以保护细胞,通过防止非细胞内的核糖核酸酶进入细胞;(3)调节或终止细胞内一些核糖核酸酶的功能;(4)监 控氧化态的细胞对氧化和老化应激等因素的反应;(5)其他一些未知的生物学功能[8, 9]。我们不但前期实验表明了上调RI抑制了黑色素瘤的生长和转移[5],而且最近我们还得出下调RI可以促进膀胱癌细胞的生长和转移,但其作用分子机制尚未弄清。为了进一步阐明其生物功能,我们构建了pIRES2-EGFP-RI真核表达质粒,并将其转染小鼠B16黑色素瘤细胞,筛选其稳定表达细胞系,从而探讨RI对细胞增殖及凋亡的影响以及其作用的分子机制。
本研究通过MTT、Hochest33342、TUNEL及流式细胞术、Western blot、免疫组化、免疫荧光等检测证实,上调RI可以抑制细胞增殖,调节细胞周期和诱导B16细胞出现明显的凋亡特征,以及显著改变了一些凋亡相关蛋白的表达,在B16-RI组中,Bax的表达量明显上升,而Bcl-2的表达明显减少。RI的过表达同时也激活了Caspase-3,并使激活后活化的Caspase-3表达增高;同时RI过表达能够在体内外抑制ILK/PI3K/AKT信号通路关键靶分子ILK、β-catenin、p-Akt和p-GSK3β蛋白的表达及磷酸化。ILK是一种丝/苏氨酸的蛋白激酶,实验证实ILK参与了调控细胞的生长、增殖、粘附、迁移、分化、侵袭和血管生成,涉及体内多种信号转导通路,在肿瘤侵袭、转移中高表达,被寄希望为肿瘤治疗中一个重要的干预靶点[10, 11]。活化后的ILK通过磷酸化Akt的Ser473位点,或直接磷酸化下游蛋白底物从而发挥抗凋亡和促进细胞存活的重要调节作用[13]。研究表明,Akt获得抗凋亡的能力,通过磷酸化细胞中某些具有凋亡效应的蛋白。活化的Akt可以使Bad的Ser136位点磷酸化,有效阻断Bad诱导的细胞凋亡。Akt还能磷酸化Bcl-2家族成员Bax的Ser184位点,负调控促凋亡功能。下调ILK的表达可以在体外癌细胞和体内移植瘤中降低 Akt的磷酸化。直接或间接抑制Akt的活性,能够消除Akt对促凋亡作用抑制,增加肿瘤细胞的凋亡[14]。这些研究与我们的实验结果一致。人的RI与ILK基因均定位于11号染色体的11p15,从果蝇(3号)、小鼠(7号)、大鼠(1号)到人,这两个基因都位于同一染色体的相邻位置上。那么根据蛋白质相互作用的染色体邻近推断法和我们的前期实验,它们很可能存在一定的相互作用或者功能相关,我们正在进行进一步的研究。
动物实验显示,B16-RI组移植瘤的生长显著减缓,肿瘤的体积明显减小,分别与对照组相比,肿瘤抑制率为94.8%、94.95%,同时肿瘤组织中的微血管密度也明显减小。肿瘤的生长和恶性转移跟血管密切相关,血管生成是肿瘤生长和转移所必需的,肿瘤中血管的生成为实体瘤的生长提供了新陈代谢所需要的氧气和丰富的营养物质,从而使实体瘤得以生长避免坏死。同时血管也是肿瘤细胞向远处的器官和组织转移移的先决条件[5]。
综上所述,这些结果表明,RI对小鼠黑色素瘤起了显著的抑制作用,这种作用可能部分通过ILK信号通路抑制细胞增殖,调节细胞周期,诱导细胞凋亡及抑制新生血管的生成。我们的研究结果提示RI可能作为治疗肿瘤(黑色素瘤)的生物标志物和一个有价值的靶点。
| [1] | Shapiro R. Cytoplasmic ribonuclease inhibitor[J]. Methods Enzymol, 2001, 341: 611-628. |
| [2] | Dickson K A, Kang D K, Kwon Y S, et al. Ribonuclease inhibitor regulates neovascularization by human angiogenin[J]. Biochemistry, 2009, 48(18): 3804-3806. |
| [3] | Nekrasov A N, Zinchenko A A. Structural features of the interfaces in enzyme-inhibitor complexes[J]. J Biomol Struct Dyn, 2010, 28(1): 85-96. |
| [4] | McDonald P C, Oloumi A, Mills J, et al. Rictor and integrin-linked kinase interact and regulate Akt phosphorylation and cancer cell survival[J]. Cancer Res, 2008, 68(6): 1618-1624. |
| [5] | 潘湘阳, 李红彦, 姚雪, 等. 核糖核酸酶抑制因子过表达抑制B16细胞的侵袭和转移[J]. 第三军医大学学报, 2012, 34(4): 284-289. |
| [6] | Xiong D, Liou Y, Shu J, et al. Down-regulating ribonuclease inhibitor enhances metastasis of bladder cancer cells through regulating epithelial-mesenchymal transition and ILK signaling pathway[J]. Exp Mol Pathol, 2014, 96(3): 411- 421. |
| [7] | Chen J, Ou-Yang X, Gao J, et al. Knockdown of ribonuclease inhibitor expression with siRNA in non-invasive bladder cancer cell line BIU-87 promotes growth and metastasis potentials[J]. Mol Cell Biochem, 2011, 349(1/2): 83-95. |
| [8] | Fu P, Chen J, Tian Y, et al. Anti-tumor effect of hematopoietic cells carrying the gene of ribonuclease inhibitor[J]. Cancer Gene Ther, 2005, 12(3): 268-275. |
| [9] | Kim Y J, Park S J, Choi E Y, et al. PTEN modulates miR-21 processing via RNA-regulatory protein RNH1[J]. PLoS One, 2011, 6(12): e28308. |
| [10] | Dobreva I, Fielding A, Foster L J, et al. Mapping the integrin-linked kinase interactome using SILAC[J]. J Proteome Res, 2008, 7(4): 1740-1749. |
| [11] | Zhu J, Pan X, Zhang Z, et al. Downregulation of integrin-linked kinase inhibits epithelial-to-mesenchymal transition and metastasis in bladder cancer cells[J]. Cell Signal, 2012, 24(6): 1323-1332. |
| [12] | Ibaragi S, Yoshioka N, Kishikawa H, et al. Angiogenin-stimulated rRNA transcription is essential for initiation and survival of AKT-induced prostate intraepithelial neoplasia[J]. Mol Cancer Res, 2009, 7(3): 415-424. |
| [13] | Troussard A A, McDonald P C, Wederell E D, et al. Preferential dependence of breast cancer cells versus normal cells on integrin-linked kinase for protein kinase B/Akt activation and cell survival[J]. Cancer Res, 2006, 66(1): 393-403. |
| [14] | Malla R, Gopinath S, Alapati K, et al. Downregulation of uPAR and cathepsin B induces apoptosis via regulation of Bcl-2 and Bax and inhibition of the PI3K/Akt pathway in gliomas[J]. PLoS One, 2010, 5(10): e13731. |



