随着肥胖及其相关代谢综合征全球化的流行趋势,非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)在欧美国家和我国已经成为引起慢性肝病的主要病因[1, 2]。棕榈酸作为一种常见的长链饱和脂肪酸,是血脂中脂肪酸的主要组成成分之一。既往研究表明:棕榈酸可以促进肝细胞脂肪变性,诱发细胞凋亡,在NAFLD的发生、发展中起着非常重要的作用[3, 4]。
脂肪酸转运酶(fatty acid translocase,FAT/CD36)是一种膜糖蛋白,属于B类清道夫受体家族,广泛分布于哺乳动物的多种组织细胞上,包括肝细胞、心肌和骨骼肌细胞、脂肪细胞等[5],在介导棕榈酸的跨膜转运中起着重要作用 [6, 7]。因此,本研究以HepG2细胞为模型,观察FAT/CD36在棕榈酸诱导的肝细胞内脂质积聚中的作用,并探讨其分子机制。
1 材料和方法 1.1 材料 1.1.1 化学试剂核酸分子量标准DL2000 Marker、λ-EcoT14 Ⅰ digest、DNA 连接酶、高保真DNA聚合酶、RNAiso Plus、PrimeScript® RT reagent Kit、SYBR® Premix Ex Taq Ⅱ购自大连宝生物工程有限公司(TaKaRa 公司);限制性内切酶购自NEB公司;核酸染料购自北京鼎国昌盛生物技术有限责任公司;琼脂糖购自Biowest公司;PCR Mix购自广州东盛生物科技有限公司。胎牛血清、DMEM高糖培养基购自HyClone公司;牛血清白蛋白(BSA)购自Equitech-Bio公司;软脂酸购自Sigma-Aldrich公司;质粒转染试剂盒、DNA提取试剂盒、胶回收试剂盒购于Qiagen公司;双荧光素酶报告基因检测试剂盒Dual-Luciferase® Reporter Assay System和质粒抽提试剂盒均购自Promega公司;蔗糖购自Genview公司;Tris碱购自上海生工生物工程股份有限公司;BCA蛋白浓度测定试剂盒购自北京鼎国昌盛生物技术有限公司;全蛋白提取试剂盒购自南京凯基生物科技发展有限公司;PVDF膜、化学发光试剂盒Immol/Lobilon Western Chemiluminescent HRP Substrate购自Millipore公司。酶联免疫吸附试剂盒购自Cusabio公司,荧光标记棕榈酸(FL-C16)购自Invitrogen公司。PCR引物采用ABI Primer Express软件设计,由北京华大基因公司合成。
1.1.2 细胞株HepG2 购自美国模式培养物集存库(American Type Culture Collection,ATCC)
1.1.3 载体pGL3-basic、pRL-TK购自Promega公司。
1.2 方法 1.2.1 细胞培养细胞用含有10%胎牛血清、100 U/mL 青霉素及100 μg/mL链霉素的DMEM高糖培养基,置于37 ℃ 5%CO2培养箱中培养,1~2 d换液,3~4 d传代。
1.2.2 实验分组普通HepG2细胞,分为对照组 和棕榈酸处理组,分别给予0、0.08、0.16、0.32 mmol/L 的棕榈酸处理;RNA干扰HepG2细胞,分为阴性对照组(NC)和CD36干扰组(CD36 RNAi)。
1.2.3 小干扰RNA(small interference RNA,siRNA)的合成及转染由上海吉玛公司设计和合成针对人CD36基因的siRNA(CD36-siRNA,正义链:5′-GGCUGUGUUUGGAGGUAUUCUTT-3′,反义链:5′-AGAAUA-CCUCCAAACACAGCCTT-3′)和阴性对照siRNA(NC-siRNA,正义链: 5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCGGAGAATT-3′)。当HepG2细胞融合度约80%时,瞬时转染CD36-siRNA或NC-siRNA到HepG2细胞,7~8 h在显微镜下观察转染效率。
1.2.4 Western blot检测CD36蛋白表达收集细胞,用全蛋白提取试剂盒提取细胞总蛋白,用BCA法 测定蛋白含量并进行标化,蛋白上样量为80~100 μg,β-actin作为内参照蛋白,样品加变性缓冲液在沸水中煮5 min,SDS PAGE凝胶电泳后转至PVDF膜,5%脱脂牛奶室温封闭2 h,一抗(抗CD36 1 ∶2 000,β-actin 1 ∶4 000) 4 ℃孵育过夜,TBST洗3次,每次10 min,二抗37 ℃孵育1 h,TBST漂洗3次,每次10 min,化学发光试剂盒进行显色,Image J定量。
1.2.5 人CD36基因启动子表达质粒的构建从Promoter Database中获得长度为1 000 bp的CD36启动子序列,设计引物(正义链:5′-TAAGCCTCGAGCTTAA GTACTAAAGATTATCCTCAA-3′,反义链:5′-TAAGC-AAGCTTGAAAATAATGCAAACCTGATTTTTAG-3′),并提取HepG细胞基因组DNA作为模板,PCR 扩增CD36启动子片段,胶回收后用Hind Ⅲ和XhoⅠ双酶切,并用T4连接酶连接到Hind Ⅲ和XhoⅠ双酶切后的pGL3-Basic载体上,再以低温CaCl2 法将连接产物转化大肠杆菌感受态筛选阳性克隆,提取质粒pGL3-CD36-P,酶切鉴定,并送公司测序。
1.2.6 双荧光素酶报告系统测定CD36启动子活性当HepG2细胞融合度约80%,按96孔板每孔0.2 μg DNA,1.5 μL转染试剂的比例,将重组质粒表达虫荧光素酶(pGL3-CD36-P)与表达海肾荧光素酶(pRL-TK)以20 ∶1的比例共同转入HepG2细胞,用双荧光素酶报告基因检测试剂盒测定荧光素酶的表达,以虫荧光素酶读数/海肾荧光素酶读数的相对荧光素强度来反映CD36启动子活性[8]。
1.2.7 实时定量RT-PCR检测CD36 mRNA的表达使用RNAiso Plus提取细胞总RNA,然后用PrimeScript® RT reagent Kit将总RNA反转录成cDNA;再以2 μLcDNA作为模板,β-actin作为内参,实时荧光定量PCR检测靶基因的 mRNA表达。
1.2.8 多聚核糖体分析方法检测CD36翻译效率用0.3 mL低盐缓冲液(LSB,pH=7.4的20 mmol/L盐酸,含10 mmol/L NaCl和3 mmol/L的MgCl2)处理细胞,然后用0.1 mL含有1.2%(体积分数)的Triton X-100和0.2 mol/L蔗糖的LSB匀浆破碎细胞。将裂解物用7%~47%的蔗糖梯度,在36 000×g ,4 ℃下超速离心2 h,然后测定254 nm的光密度值,并将密度梯度液平均分为8等分[9]。提取每等分的总RNA,并通过半定量PCR分析CD36、28S rRNA基因、18S rRNA基因和β-actin基因,所用引物序列如表 1所示。
1.2.9 油红O染色观察细胞内脂质积聚用4%多聚甲醛固定细胞爬片10 min,PBS清洗后,1,2-丙二醇孵育2 min,油红O染色30 min; 双蒸水清洗3次,苏木精复染2 min; 洗净后甘油明胶封片,显微镜下摄像。
| 基因 | 引物序列 |
| CD36 | 正义链:5′-GAGAGAACTGTTATGGGGCTAT-3′ 反义链:5′-TTCAACTGGAGAGGCAAAGG-3′ |
| 28S rRNA | 正义链:5′-TTGAAAATCCGGGGGAGAG-3′ 反义链:5′-ACATTGTTCCAACATGCCAG-3′ |
| 18S rRNA | 正义链:5′-CAGCCACCCGAGATTGAGCA-3′ 反义链:5′-TAGTAGCGACGGGCGGTGTG-3′ |
| β-actin | 正义链:5′-CCTGGCACCCAGCACAAT-3′ 反义链:5′-GCCGATCCACACGGAGTA-3′ |
PBS洗涤细胞两次后,收集细胞沉淀,按(56 ∶42 ∶2)比例加入氯仿、正庚烷、甲醇混合抽提剂,然后超声破碎细胞,离心后收集上清,真空干燥,ELISA试剂盒进行FFA定量。而离心后的蛋白沉淀用1 mol/L NaOH溶解,并用BCA蛋白定量试剂合进行蛋白定量,计算FFA与细胞总蛋白的比值。
1.2.11 显微镜下动态观察FFA摄取用PBS洗涤细胞,然后加入0.02 mmol/L的FL-C16并以固定间隔时间连续照相,并用Image J软件对各组细胞在不同时间的荧光强度做定量分析。
1.3 统计学分析所有数据以x±s表示,使用SPSS 17.0统计软件对数据进行处理,两样本比较用t检验,多样本采用单因素方差分析,并用Tukey检验进行两两比较。
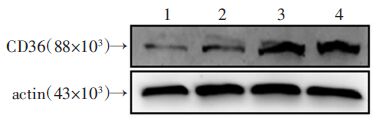
2 结果 2.1 棕榈酸对CD36蛋白表达的影响Western blot检测发现HepG2细胞中CD36蛋白的表达随着棕榈酸浓度的增加而增加。提示棕榈酸能剂量依赖性地上调CD36蛋白表达(图 1)。
|
| 1:对照组(棕榈酸浓度0 mmol/L);2:0.08 mmol/L;3:0.16 mmol/L;4:0.32 mmol/L 图 1 Western blot检测棕榈酸对HepG2细胞CD36蛋白表达的影响 |
与对照组(0 mmol/L)相比,0.08 mmol/L的棕榈酸对CD36启动子活性无显著影响,当棕榈酸浓度为0.16、0.32 mmol/L时,启动子活性分别为对照组的(3.47±1.38)倍(P<0.05)和(5.37±2.58)倍(P<0.05)。类似的,0.08 mmol/L的棕榈酸对CD36的 mRNA表达无明显影响,但棕榈酸浓度为0.16 mmol/L、0.32 mmol/L时,CD36 mRNA表达分别为对照组的(1.59±0.36)(P<0.05)和(1.81±0.41)(P<0.05)。
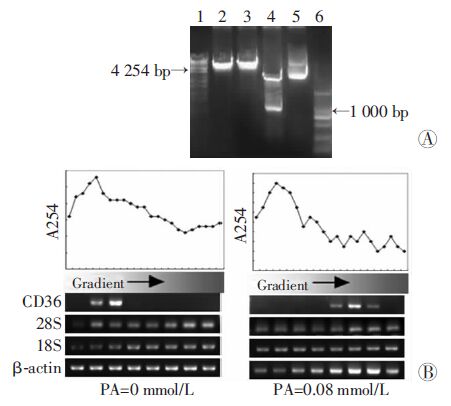
同时我们还观察了低浓度的棕榈酸(0.08 mmo/L) 对CD36翻译效率的影响,细胞用棕榈酸处理24 h后多聚核糖体分析发现:CD36条带右移,即由寡核糖体部分向多聚核糖体的部分发生偏移,表明与多聚核糖体结合的CD36mRNA增多,CD36的蛋白翻译效率增高(图 2D)。
|
| A:PGL3-CD36-P酶切鉴定图 1:DNA marker(λ-EcoT14 Ⅰ digest);2:PGL3-CD36-P HindⅢ单酶切;3:PGL3-CD36-P XhoⅠ单酶切;4:PGL3-CD36-P XhoⅠ、 HindⅢ双酶切;5:PGL3-CD36-P;6:DNA marker(DL2000);B: 多聚核糖体分析测定HepG2细胞CD36蛋白的翻译效率,曲线图是根据超速离心后254 nm处读取的光密度值绘制的曲线,表示密度梯度离心后核糖体分离成功;CD36、28S、18S、β-actin表示半定量PCR之后的条带;从左到右表示由低密度至高密度 图 2 CD36启动子载体的构建及棕榈酸对CD36翻译效率的影响 |
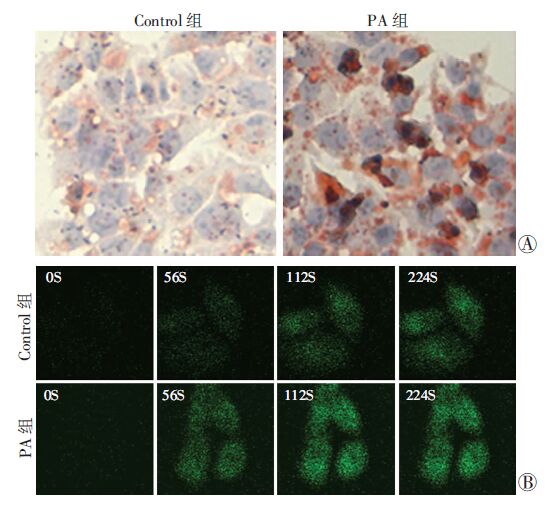
普通HepG2细胞用0、0.16 mmol/L棕榈酸处理24 h后,正置显微镜观察油红 O染色结果发现:与对照组(Control)相比,棕榈酸组(PA)的HepG2细胞内橘红色脂滴增加;同时用酶联免疫吸附实验检测HepG2细胞内FFA含量发现棕榈酸处理组(240.17±19.83) ng/mg较对照组(144.60±53.52) ng/mg明显升高(P<0.05,n=4),结果与油红O染色结果一致(图 3A)。在显微镜下动态观察发现棕榈酸处理组的细胞对FL-C16的摄取速率较对照组加快(图 3B)。
|
| A:HepG2细胞油红O染色及细胞内FFA定量(×400);B:HepG2细胞对荧光标记FFA的动态摄取摄像(×200) 图 3 棕榈酸对HepG2细胞内脂质积聚的影响 |
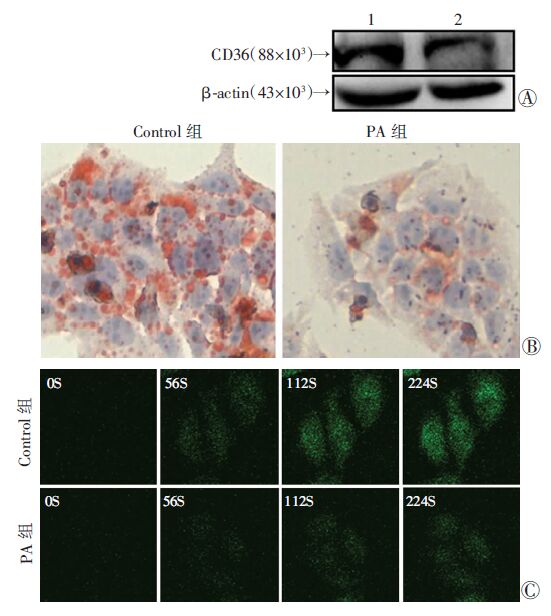
我们将CD36-siRNA和NC-siRNA瞬时转入HepG2细胞成功构建了低表达CD36的HepG2细胞(CD36-siRNA-HepG2,CD36 RNAi)和阴性对照HepG2(NC-siRNA-HepG2,NC)。CD36 RNAi的HepG2中CD36 mRNA与蛋白分别为NC组的(0.58±0.08)(P<0.05,n=6),(0.50±0.10)(P<0.05,n=3)。给予CD36 RNAi 和NC组细胞0.16 mmol/L棕榈酸处理24小时后,油红O染色(图 4A)发现CD36 RNAi组细胞内脂滴明显少于NC组,与细胞内FFA定量测定结果相符[NC组(240.17±21.12) ng/mg,CD36 RNAi组(98.38±14.18) ng/mg,P<0.05,n=4],显微镜下动态观察也证实CD36 RNAi组细胞对脂肪酸的摄入速度明显慢于NC组细胞(图 4B)。
|
| A:RNA干扰后HepG2细胞的CD36蛋白表达; B:RNA干扰后HepG2细胞的油红O染色(×400); C:RNA干扰后HepG2细胞对荧光标记FFA的动态摄取摄像(×200) 图 4 抑制CD36表达对HepG2细胞内脂质积聚的影响 |
NAFLD是一组无过量饮酒史,又除外其他肝病的以肝细胞内中性脂肪(主要是甘油三酯和脂肪酸)过度堆积为主要特征的临床病理综合征,包括单纯性脂肪肝、非酒精性脂肪性肝炎和肝硬化,后者可发展为肝癌[10, 11]。几乎所有NAFLD患者的血清游离脂肪酸含量较正常人群有不同程度的升高[12],而且NAFLD患者肝内的脂质约有60%都来源于外周,因此血循环中的脂肪酸异常转运至肝细胞内,是导致肝脏脂质异常积聚的重要原因[13]。
CD36是具有多种功能的膜蛋白,如介导长链脂肪酸和氧化低密度脂蛋白的跨膜转运,黏附多种生物大分子并通过胞内信号传导引发相应的炎症、噬菌、内吞功能等[14]。既往研究提示CD36与NAFLD的发生发展密切相关:NAFLD患者的肝脏CD36表达增加,且CD36的表达量与肝脏脂肪变性程度呈正相关[15];而改善小鼠的肝内脂质积聚后,其肝脏的CD36表达也相应地降低[16]。但是,CD36参与NAFLD发生的具体机制尚不清楚。
本研究表明棕榈酸可以明显上调HepG2细胞中CD36蛋白的表达。蛋白的表达受到多因素的复杂调控,其中,基因转录水平及蛋白翻译水平的调节至关重要。因此,我们首先构建了人CD36启动子的表达质粒,将其转染HepG2细胞,测定CD36启动子活性,同时应用荧光定量PCR测定细胞CD36的mRNA表达。结果表明:棕榈酸对CD36的转录有明显促进作用。进一步,我们应用多聚核糖体分析观察了棕榈酸对CD36蛋白翻译的影响。核糖体是生物体蛋白质合成的场所,mRNA与核糖体结合后启动蛋白翻译,与寡核糖体结合的mRNA翻译效率较低,而与多聚核糖体结合的mRNA翻译效率则较高[9]。基于这个原理,多聚核糖体分析通过蔗糖连续密度梯度超速离心将核糖体分离出来,然后提取各个梯度组分内的RNA,利用PCR检测各个组分内目标mRNA的表达,从而反映其蛋白的翻译效率的高低,是检测蛋白翻译效率的经典方法[9]。我们发现棕榈酸能明显促使CD36条带由寡核糖体部分向多聚核糖体的部分发生偏移,增加CD36蛋白的翻译效率。
我们还发现棕榈酸能显著增加细胞内脂质积聚,其机制可能与CD36介导的棕榈酸摄取增强有关。进一步通过转染siRNA的方法抑制了HepG2细胞内CD36蛋白的表达,发现棕榈酸负荷的CD36-siRNA-HepG2较NC-siRNA-HepG2对棕榈酸的摄取速度也相应地减慢,细胞内脂质含量显著降低。
综上所述,我们在HepG2细胞模型上证实了棕榈酸能在转录和翻译两个水平上调CD36的表达,从而增强细胞外脂肪酸转入细胞内,造成脂质的异常沉积;而通过抑制CD36的表达,可以减轻细胞内脂质积聚。因此本研究表明CD36在棕榈酸介导的肝脏脂质积聚中起到了关键作用,也可能为临床治疗非酒精性脂肪性肝病及新药开发提供了潜在的思路和线索。
| [1] | Dyson J K, Anstee Q M, McPherson S. Non-alcoholic fatty liver disease: a practical approach to treatment[J]. Frontline Gastroenterol, 2014, 5(4): 277-286. |
| [2] | 周婷婷, 秦波, 郑天鹏, 等. 非酒精性脂肪肝患者血浆FGF21水平及与肥胖、胰岛素抵抗关系研究[J]. 第三军医大学学报, 2010, 32(3): 265-268. |
| [3] | Ricchi M, Odoardi M R, Carulli L, et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes[J]. J Gastroenterol Hepatol, 2009, 24(5): 830-840. |
| [4] | Miura K, Yang L, van-Rooijen N, et al. Toll-like receptor 2 and palmitic acid cooperatively contribute to the development of nonalcoholic steatohepatitis through inflammasome activation in mice[J]. Hepatology, 2013, 57(2): 577-589. |
| [5] | Silverstein R L. Type 2 scavenger receptor CD36 in platelet activation: the role of hyperlipemia and oxidative stress[J]. Clin Lipidol, 2009, 4(6): 767. |
| [6] | Kennedy D J, Kuchibhotla S, Westfall K M, et al. A CD36-dependent pathway enhances macrophage and adipose tissue inflammation and impairs insulin signalling[J]. Cardiovasc Res, 2011, 89(3): 604-613. |
| [7] | 陈显, 柳青, 雷寒, 等. 炎症应激加重CD36基因敲除小鼠胰岛素抵抗[J]. 第三军医大学学报, 2010, 32(9): 883-886. |
| [8] | 仝莎, 陈曜, 赵蕾, 等. TNF-α对HepG2细胞LXRα介导的胆固醇外流的影响及其分子机制[J]. 中国病理生理杂志, 2013, 29(2): 193-199. |
| [9] | Sheets M D, Fritz B, Hartley R S, et al. Polyribosome analysis for investigating mRNA translation in Xenopus oocytes, eggs and embryos[J]. Methods, 2010, 51(1): 152-156. |
| [10] | 谭华炳, 朱德文, 谢杏榕, 等. 非酒精性脂肪性肝病兔脂肪肝程度与肝组织硫化氢浓度的关系[J]. 第三军医大学学报, 2010, 32(22): 2440-2443. |
| [11] | Celikbilek M, Baskol M, Taheri S, et al. Circulating microRNAs in patients with non-alcoholic fatty liver disease[J]. World J Hepatol, 2014, 6(8): 613-620. |
| [12] | 李红山, 朱德东, 李德周. 非酒精性脂肪性肝炎患者血清游离脂肪酸的检测及其临床意义[J]. 中国卫生检验杂志, 2013, 23(1): 142-144. |
| [13] | Kawano Y, Cohen D E. Mechanisms of hepatic triglyceride accumulation in non-alcoholic fatty liver disease[J]. J Gastroenterol, 2013, 48(4): 434-441. |
| [14] | Silverstein R L, Febbraio M. CD36, a scavenger receptor involved in immunity, metabolism, angiogenesis, and behavior[J]. Sci Signal, 2009, 2(72): re3. |
| [15] | Miquilena-Colina M E, Lima-Cabello E, Sanchez-Campos S, et al. Hepatic fatty acid translocase CD36 upregulation is associated with insulin resistance, hyperinsulinaemia and increased steatosis in non-alcoholic steatohepatitis and chronic hepatitis C[J]. Gut, 2011, 60(10): 1394-1402. |
| [16] | Lopez-Parra M, Titos E, Horrillo R, et al. Regulatory effects of arachidonate 5-lipoxygenase on hepatic microsomal TG transfer protein activity and VLDL-triglyceride and apoB secretion in obese mice[J]. J Lipid Res, 2008, 49(12): 2513-2523. |



