2 063000 河北 唐山,华北理工大学口腔医学院颌面外科
2 Department of Oral and Maxillofacial Surgery, College of Stomatology, North China University of Science and Technology, Tangshan, Hebei Province, 063000, China
涎腺多形性腺瘤(pleomorphic adenoma,PA)是最常见的一种涎腺肿瘤,占涎腺上皮肿瘤的50%以上,组织学具有多样性,以黏液和软骨样组织的出现为特征[1, 2]。PA作为一种临界瘤,具有一定的侵袭性,即便是临床手术治疗成功的病例,仍有2%~3%复发的可能性,且多次复发后易导致癌变[2]。PA的复发及恶变过程是多因素、多基因变异相互作用的过程,但其复发、恶变和转移机制尚不清楚[3]。骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)是天然骨形态发生蛋白提取物中的最主要的形式,具有抑制肿瘤细胞增殖、促进肿瘤细胞凋亡的作用[4]。但在涎腺多形性腺瘤中的研究鲜有报道。IAPs (inhibitor of apoptosis family of proteins)为近年来发现的新一类细胞内凋亡抑制蛋白,具有明显肿瘤特异性[5],在肝癌、宫颈癌等肿瘤已有深入的研究,但在涎腺多形性腺瘤中还未见报道。
本实验拟在分析涎腺多形性腺瘤复发、恶变与分型的关系的基础上,通过研究不同分型PA中BMP-2和XIAP的表达及细胞凋亡情况,探讨BMP-2、XIAP的表达水平,细胞凋亡指数与各型PA复发、恶变的相关性。
1 材料与方法 1.1 材料开滦总医院2004年1月至2013年1月PA患者标本和肿瘤周边的涎腺组织共计92例。患者术前未接受过任何放化疗及其他治疗,标本经10%福尔马林固定,常规石蜡包埋并且病历资料齐全。
1.2 主要试剂Rabbit Anti-BMP2 protein;Rabbit Anti-XIAP protein;抗体稀释液;Super PAP Pen;无生物素PV6000 Kit试剂盒;浓缩型DAB试剂盒;原位细胞凋亡检测试剂盒TUNEL(POD)。以上试剂由北京博奥森生物技术有限公司及北京中杉金桥生物技术有限公司提供。
1.3 方法常规制备石蜡切片,每个标本切取4片,1片做HE染色,2片做免疫组化染色,1片做原位细胞凋亡TUNEL检测。
1.3.1 HE染色切片自60 ℃烘箱取出后脱蜡至水;自来水冲洗,苏木精染色;入1%盐酸酒精水化数秒;自来水充分水洗返蓝;1%伊红染色1~2 min。最后梯度酒精脱水干燥;二甲苯透明。中性树胶封固。风干后,镜下观察。根据其组织成分所占比例分型分组:A组,细胞丰富型(基质成分比例≤50%);B组,基质丰富型(基质成分比例≥80%);C组,其他(基质成分比例>51%,并且<79%)。
1.3.2 免疫组化染色检测各组标本中BMP-2和XIAP 表达情况切片60 ℃烘箱取出后脱蜡至水。高压 加热抗原热修复2 min,室温冷却。PBS缓冲液(pH 7.4) 冲洗3次,每次3 min。入3%过氧化氢10 min,PBS冲洗3×3 min。除去PBS,去离子水中免疫组化笔圈定组织。切片甩干用移液器滴加50 μL一抗(BMP2或XIAP,以1 ∶200的比例用抗体稀释液配成工作液;阴性对照组以PBS缓冲液代替一抗)。放入湿盒,37 ℃恒温孵育箱中孵育60 min。PBS冲洗3×3 min,切片甩干,加50 μL酶二抗聚合物,放入湿盒,37 ℃恒温孵育40 min。PBS冲洗3×3 min。除去PBS,加50 μL DAB溶液(1 ∶100蒸馏水稀释,避光)显色。自来水冲洗约10 min,苏木精复染,0.1%盐酸水化,自来水冲洗返蓝。梯度酒精脱水干燥,二甲苯透明。中性树胶封片。
1.3.3 原位细胞凋亡TUNEL检测切片脱蜡至水。甩干,加50 μL复合消化液(蛋白酶K-胃蛋白酶),37 ℃恒温孵育箱中孵育30 min。PBS缓冲液(pH 7.4)冲洗3次,每次3 min。加3%过氧化氢甲醇溶液,室温孵育30 min。PBS冲洗3×3 min。除去PBS液,去离子水中用免疫组化笔圈定组织。甩干并滴加50 μL TUNEL反应混合溶液;阴性对照组滴加酶浓缩溶液。放入湿盒,37 ℃恒温孵育60 min。PBS冲 洗3×3 min。切片甩干,滴加50 μL转化剂-POD。37 ℃ 恒温孵育30 min。PBS冲洗3×3 min。除去PBS,滴加50 μL DAB溶液,显色。PBS冲洗3×3 min。苏木精复染,0.1%盐酸水化,自来水冲洗返蓝。梯度酒精脱水干燥,二甲苯透明。中性树胶封片。
1.4 判别标准 1.4.1 免疫组化检测BMP-2主要在细胞质和细胞核内表达;XIAP主要定位在细胞质,免疫组化染色阳性表达主要在细胞质中,也可见于细胞核。镜下表达以背景清晰胞质或细胞核内出现黄色/棕黄色颗粒为阳性;蓝色为阴性。每张切片在相差显微镜镜下,运 用Motic Med 6.0软件系统,200倍镜下随机选取10个 视野捕捉图像,Image-Proplus 6.0软件进行分析,得出积分光密度IOD值。
1.4.2 原位细胞凋亡TUNEL检测凋亡中的阳性信号均为棕黄色,凋亡的阳性信号位于细胞核中。相差显微镜镜下,运用Motic Med 6.0软件系统,400倍 镜下随机选取5个视野捕捉图像,用Image-Proplus 6.0 软件分析图像,得出每组标本凋亡指数(AI)。AI =凋亡细胞和凋亡小体的数目/肿瘤细胞数。
1.5 回查病历回查各组标本病历,记录患者性别、年龄、发病时间(发现异常到确诊的时间)、肿瘤大小、有无复发、恶变及转移等情况。
1.6 统计学分析实验数据建立EXCEL数据库,经SPSS 18.0统计软件分析。各组数据经过Shapiro-Wilk正态性检验和Bartlett方差齐性检验后,利用单因素方差及LSD-t检验分析比较BMP-2和XIAP在各组之间的差异,及不同分型多形性腺瘤细胞凋亡情况;采用卡方检验和单因素方差分析各组年龄、性别、发病时间(月)等情况,以及不同分型多形性腺瘤复发和恶变情况;采用 Spearman相关分析,分析BMP-2和XIAP的相关性以及BMP-2和XIAP表达情况与细胞凋亡的相关性。实验数据以x±s表示,以P<0.05表示具有统计学意义。
2 结果 2.1 基础资料分析本实验共收集标本92例:A组细胞丰富型24例,女性10例,男性14例,平均年龄47.42岁,瘤体最小 0.8 cm×1.0 cm×1.0 cm,最大1.9 cm×1.7 cm×2.6 cm,复发5例,恶变6例;B组基质丰富型24例,女性15例,男性11例,平均年龄40.75岁,瘤体最小1.0 cm×0.5 cm×0.8 cm,最大1.6 cm×3.0 cm×2.5 cm,复发12例,恶变2例;C组其他型42例,女性22例,男性 20例,平均年龄41.08岁,瘤体最小0.8 cm×1.0 cm ×0.9 cm,最大2.0 cm×2.0 cm×1.8 cm,复发8例,恶变2例。经卡方检验和单因素方差分析可知,各组中年龄(F=1.51)、性别(χ2=1.33)、发病时间(月)(F=1.42)等因素的差别无统计学意义(P>0.05),可排除上述因素的干扰,具有可比性。
2.2 各组复发及恶变情况经卡方检验可知,不同分型多形性腺瘤的复发(χ2=6.62,P<0.05)及恶变(χ2=6.83,P<0.05)情况存在显著差异。基质丰富型多形性腺瘤复发率为46.2%,更易复发;细胞丰富型和基质丰富型多形性腺瘤25%,更易恶变。
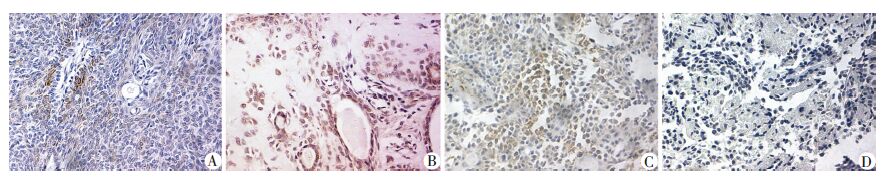
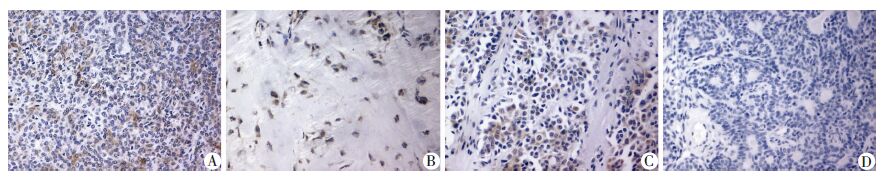
2.3 免疫组化染色结果BMP-2在腺管样的上皮细胞和导管上皮细胞及黏液样组织和软骨样组织中表达显著。而XIAP主要在细胞核和胞质中表达,各组BMP-2、XIAP均有表达,表达情况有所不同,结果显示BMP-2在B组基质丰富型 阳性表达最强;C组其他型和A组细胞丰富型表达依次减弱,且各组中的表达存在显著差异(P<0.05,表 1,图 1)。XIAP在A组细胞丰富型中的表达最强,在B组基质丰富型中的表达次之,在C组其他型中的表达最弱,且各组中表达存在显著差异(P<0.05,表 1,图 2)。
| (x±s) | ||
| 组别 | BMP-2 | XIAP |
| A组 | 22.10±8.41 | 180.82±57.20 |
| B组 | 136.20±48.16a | 104.72±17.28a |
| C组 | 71.74±28.78ab | 63.02±13.48ab |
| a:P<0.05,与A组比较;b:P<0.05,与B组比较 | ||
|
| A:细胞丰富型组(A组);B:基质丰富型组(B组);C:其他型组(C组);D:阴性对照组 图 1 BMP-2在不同分型涎腺多形性腺瘤中的表达 (×200) |
|
| A:细胞丰富型组(A组);B:基质丰富型组(B组);C:其他型组(C组);D:阴性对照组 图 2 XIAP在不同分型涎腺多形性腺瘤中的表达 (×200) |
复发病例中BMP-2表达明显高于未复发病例,提示BMP-2高表达可能与复发有关;而复发与未复发病例间XIAP的表达无明显差别,提示XIAP的表达与复发无关。经两个独立样本t检验,各组间差异具有统计学意义(P<0.05)。恶变病例中XIAP表达明显高于未恶变病例,提示XIAP高水平表达可能与恶变有关;恶变与非恶变病例BMP-2的表达无明显差别,提示恶变与BMP-2的表达无关,而XIAP的高表达与恶变有关。经两个独立样本t检验,各组间差异具有统计学意义(P<0.05,表 2)。
| 指标 | 复发情况 | 恶变情况 | ||
| 复发 | 未复发 | 恶变 | 未恶变 | |
| BMP-2 | 121.44±57.46 | 60.61±40.85a | 95.47±85.29 | 74.91±48.11 |
| XIAP | 121.63±55.64 | 104.00±60.79 | 168.70±65.76 | 100.94±54.77b |
| a:P<0.05,与复发比较;b: P<0.05,与恶变比较 | ||||
经Spearman相关分析,BMP-2与XIAP的表达存在负相关,即BMP-2表达水平越高时,XIAP的表达水平越低(r=-0.297,P<0.05),具有统计学意义。
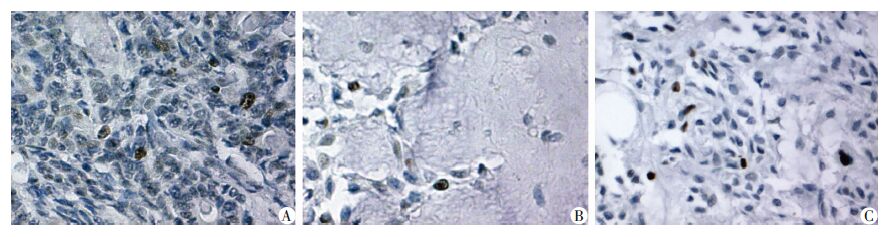
2.6 TUNEL检测结果在细胞丰富型中可见凋亡小体明显少于其他两型,计算各组凋亡指数AI,A组为(0.030±0.006),B组为(0.226±0.046),C组为(0.241±0.048),经单因素方差分析,AI在细胞丰富型和其他两型PA中,存在显著差异(P<0.05),而在基质丰富型和其他型中无显著差异。经Spearman相关分析,BMP-2的表达和细胞凋亡存在正相关,即BMP-2的表达越强,凋亡指数AI值越高(r=0.445,P<0.05)。XIAP的表达和细胞凋亡存在负相关,即XIAP的表达越强,凋亡指数AI值越低(r=-0.661,P<0.05)。经两个独立样本t检验,分析各组AI值与复发及恶变病例,显示复发组与未复发组AI值无显著差异(P>0.05),但恶变组AI值显著低于未恶变组(P<0.05),提示细胞凋亡与复发无关,与恶变有一定相关性(图 3,表 3)。
|
| A:细胞丰富型组(A组);B:基质丰富型组(B组);C:其他型组(C组) 图 3 不同分型涎腺多形性腺瘤中细胞凋亡观察 (×400) |
| (x±s) | |||
| 复发及恶变情况 | AI | t | P |
| 复发 | 0.166±0.080 | -1.011 | 0.316 |
| 未复发 | 0.187±0.106 | ||
| 恶变 | 0.085±0.082 | 3.404 | 0.001 |
| 未恶变 | 0.190±0.096 | ||
多形性腺瘤来源于涎腺上皮,是口腔颌面部最常见的肿瘤之一。肿物内除上皮成分外,还有腺体、黏液样、软骨样组织等[6]。Seifert等根据上皮细胞和基质成分在肿瘤中所占比例,将多形性腺瘤分为四型。此后Seifert和Donath为方便起见,将四型合成两型,即基质丰富型和细胞丰富型[7]。
目前对于多形性腺瘤中软骨组织的来源尚不明确,但BMP是目前所知的唯一可单独诱导异位骨形成的蛋白[8]。上皮肿瘤细胞产生的BMPs可能诱导间质干细胞分化为软骨细胞。低浓度的BMP可诱导间充质细胞向骨组织形成区移行;等浓度的BMP 可促进间充质细胞向成软骨和成骨细胞方向分化;高浓度的BMP 则可促进间充质细胞的增生[9]。本实验研究表明BMP-2在多形性腺瘤中软骨样组织周围的肌上皮细胞和基底膜阳性过表达,由此认为BMP-2在多形性腺瘤软骨样组织的形成中发挥一定作用。Seifert等[7]认为,由于基质丰富型多形性腺瘤的基质成分,像软骨肿瘤一样,对于生存条件要求相对较低,而更易于复发。在多形性腺瘤的上皮性肿瘤组织中软骨组织的形成过程中BMP-2过表达,认为BMP-2在多形性腺瘤的生长过程中以自分泌的形式诱导软骨细胞的形成和细胞外基质的产生[10]。BMP-2 对细胞增殖也有相应的的影响[11]。本实验发现BMP-2与肿瘤细胞的凋亡关系密切,可以推测BMP-2可诱导肿瘤细胞的凋亡,并且与多形性腺瘤的复发有一定关系。
XIAP可通过两条途径来抑制细胞凋亡:一是通过抑制蛋白激酶效应物Caspase来抑制细胞的凋亡,另一种是通过NF-κB 阻止细胞表面受体介导的凋亡途径起到抑制凋亡的作用[12]。在Caspase凋亡通路中,XIAP是唯一能同时抑制起始阶段和效应阶段的IAP。XIAP不仅在诸多恶性肿瘤细胞系中过表达,而且在多类肿瘤患者的肿瘤组织中过表达并且伴随较差的预后[13]。有研究发现,子宫颈癌组织XIAP蛋白表达与癌细胞分化程度呈负相关,与病理分期和年龄无关。XIAP表达强更易发生转移,预后较差;良恶性肿瘤的体腔渗出液中XIAP免疫染色阳性尤其是强阳性时,可提示肿瘤为恶性[14]。一些宫颈癌病例显示,XIAP仅在鳞癌的病损前沿表达,而部分上皮内瘤也受到XIAP 的诱导作用[15]。XIAP在PA 非典型增生细胞内表达增强,说明涎腺肿瘤恶变过程中凋亡路径出现障碍[16]。不但癌细胞内XIAP高表达,而且癌前病损非典型增生细胞和癌周细胞内也出现XIAP高表达,提示癌周细胞已经具有较强的凋亡抵抗能力[17]。本实验中XIAP在细胞丰富型表达较强,与其他两型差异明显,表明细胞丰富型多形性腺瘤较其他两型更易恶变,预后可能较差。XIAP凋亡抑制蛋白只能延缓凋亡的发生,却不能阻断细胞凋亡[18]。有研究显示XIAP还能对细胞周期进行调控,RNAi沉默XIAP基因可通过诱导凋亡和细胞周期阻滞而抑制肿瘤细胞生长[19]。本实验结果显示XIAP与肿瘤细胞的凋亡关系密切,XIAP有抑制细胞凋亡的作用,并且与多形性腺瘤的恶变存在一定关系。而且BMP-2和XIAP表达的结果进行相关分析,可知BMP-2和XIAP存在负相关,BMP-2可能有抑制XIAP表达的作用,从而我们也可以推测BMP-2有诱导多形性腺瘤瘤细胞凋亡的作用。
肿瘤的侵袭和转移是一个多阶段、多因素、多基因参与的复杂连续的过程。本实验由涎腺多形性腺瘤的组织成分的不同作为出发点,从各病例的年龄、性别、发病时间、瘤体大小以及其组织软骨样结果、细胞凋亡等方面做了比较研究,发现肿瘤亚型与多形性腺瘤的复发和恶变有一定相关性,且BMP-2和XIAP表达的结果及原位细胞凋亡TUNEL检测结果反映组织结构的差异与多形性腺瘤的复发、恶变和预后关系密切。
| [1] | 邱蔚六. 口腔颌面外科学[M]. 7版. 北京: 人民卫生出版社, 2014: 363-367. |
| [2] | 黄敏娴, 马大权, 俞光岩, 等. 复发性涎腺多形性腺瘤的临 床与病理分析[J]. 现代口腔医学杂志, 2008, 22(1): 1-4. |
| [3] | Mendenhall W M, Mendenhall C M, Werning J W, et al. Salivary gland pleomorphic adenoma[J]. Am J Clin Oncol, 2008, 31(1): 95-99. |
| [4] | Kelly M P, Savage J W, Bentzen S M, et al. Cancer risk from bone morphogenetic protein exposure in spinal arthrodesis[J]. J Bone Joint Surg Am, 2014, 96(17): 1417-1422. |
| [5] | Wilkinson J C, Wilkinson A S, Galban S, et al. Apoptosis-inducing factor is a target for ubiquitination through interaction with XIAP[J]. Mol Cell Biol, 2008, 28(1): 237- 247. |
| [6] | 张素华, 王献华. 病理组织学彩色图谱[M]. 天津: 天津科学技术出版社, 2005: 34. |
| [7] | Seifert G, Schulz C P. The monomorphic salivary duct adenoma. Classification and analysis of 79 cases (author’s transl)[J]. Virchows Arch A Pathol Anat Histol, 1979, 383(1): 77-99. |
| [8] | 王志勇, 余济春. BMP-2的研究现状[J]. 实用临床医学, 2009, 10(3): 127-128, 131. |
| [9] | Kyvernitakis I, Rachner T D, Urbschat A, et al. Effect of aromatase inhibition on serum levels of sclerostin and dickkopf-1, bone turnover markers and bone mineral density in women with breast cancer[J]. J Cancer Res Clin Oncol, 2014, 140(10): 1671-1680. |
| [10] | 潘军华, 张志, 韩培彦. BMP-2在口腔医学领域的研究与应用[J]. 北京口腔医学, 2006, 14(4): 300-301. |
| [11] | 黄龙璋, 胡炜华, 余静, 等. 重组人BMP-2对人肝癌SSMC-7721细胞迁移和侵袭能力的影响[J]. 南昌大学学报: 医学版, 2010, 50(1): 29-32, 36. |
| [12] | 杨德华, 郭晓东, 余灵祥, 等. XIAP及survivin在原发性肝细胞癌组织中的表达及其相关性研究[J]. 现代生物医学进展, 2014, 14(18): 3426-3428. |
| [13] | 张曙光, 刘芝华, 张林. 凋亡抑制基因XIAP在肿瘤治疗中的研究进展[J]. 世界华人消化杂志, 2006, 14(26): 2626-2631. |
| [14] | 夏春波, 蒋常文, 周思, 等. 子宫颈癌组织XIAP蛋白表达及其意义[J]. 中国妇幼保健, 2009, 24(19): 2715-2718. |
| [15] | Burstein D E, Idrees M T, Li G, et al. Immunohistochemical detection of the X-linked inhibitor of apoptosis protein (XIAP) in cervical squamous intraepithelial neoplasia and squamous carcinoma[J]. Ann Diagn Pathol, 2008, 12(2): 85-89. |
| [16] | Hoch B L, Wu M, Lewis M, et al. An immunohistochemical study of XIAP expression in pleomorphic adenoma and carcinoma ex pleomorphic adenoma[J]. J Oral Pathol Med, 2008, 37(10) : 634-638. |
| [17] | 王翔, 王文梅, 高文信. XIAP、XAF1 在口腔鳞癌癌周角质形成细胞中的表达与定位[J]. 口腔医学研究, 2010, 26(2): 234-237. |
| [18] | 张洪, 张阳德, 王大平, 等. Caspase-3、XIAP 在骨关节炎中的表达及意义[J]. 中国现代医学杂志, 2008, 18(3): 325-327. |
| [19] | 何畔, 梁珊. RNAi抑制XIAP基因诱导MG63细胞凋亡、化疗增敏及其分子机制[J]. 第三军医大学学报, 2010, 32(12): 1312-1315. |



