2400016 重庆,重庆医科大学基础医学院:生物化学与分子生物学教研室
2Department of Biochemistry and Molecular Biology,College of Basic Medical Science,Chongqing Medical University,Chongqing,400016,China
食管癌是常见的消化道肿瘤,我国是世界上食管癌高发地区之一,每年平均有15万人死于食管癌。主要原因是缺乏针对其有效的早期诊断及治疗手段。葡萄糖调节蛋白94 (glucose regulated protein,Grp94)是热休克蛋白90(HSP90)中家族成员之一,主要贮存在内质网,参与内质网的应激反应,是内质网应激反应中的重要因子。目前已证实Grp94基因在多种癌组织中高表达,下调Grp94基因可引起癌细胞走向凋亡[1]。本研究将设计、合成好的靶向Grp94基因的siRNA片段转染人食管癌细胞ECA109中,以探讨沉默Grp94基因表达对ECA109细胞迁移和侵袭能力的影响,为探讨Grp94在食管癌侵袭迁移中的作用奠定基础。
1 材料与方法 1.1 材料及试剂人食管癌细胞株ECA109由本实验室保存;脂质体转染试剂LipofectamineRNAIMAX购自美国Invitrogen公司;蛋白提取试剂盒和ECL发光试剂盒购自上海碧云天生物技术有限公司;兔抗人Grp94单克隆抗体、兔抗人MMP2单克隆抗体和兔抗人MMP9单克隆抗体均购自英国Abcam;Matrigel稀释液购自Bio-Rad公司,抗人β-actin单克隆抗体购自鼎国公司,HRP标记的羊抗兔IgG购自CST公司,Transwell小室购自Millipore公司。
1.2 方法 1.2.1 Grp94 siRNA的合成根据Grp94基因在GenBank 中的序列(Genbank accession NO: NM-003299.2设计靶向Grp94基因的siRNA序列:siGrp94(UGAUGUGGAUGGUACAGUA),同时合成阴性对照siRNA,干粉siRNA用DEPC水稀释成20 μmol/L,-20 ℃ 保存。
1.2.2 细胞培养及转染用含10%胎牛血清的RPMI1640完全培养液,37 ℃,5%孵箱中培养ECA109细胞,转染收集对数期生长细胞5×103个/孔接种于6孔培养板中,参照LiopfectamineRNAIMAX产品说明书,分别将siRNA-control和siRNA-Grp94转染至6孔培养板中,转染6 h后更换新鲜培养基。实验分组为: 对照组(siRNA-control组)和实验组(siRNA-Grp94组)。
1.2.3 Real-time PCR检测转染细胞中Grp94基因mRNA表达水平消化收集转染48 h的各组细胞,抽提各组细胞总RNA,核酸浓度测定仪测定其浓度和纯度,按TaKaRa逆转录反应说明书合成cDNA。用于扩增Grp94 cDNA的上游引物为:5′-GGGAGGTCACCTTCAAGTCG-3′,下游引物为5′-GGGTGTAGACGTGGAGCTC-3′;β-actin的上游引物为:5′-AGCGAGCATCCCCCAAAGTT-3′,下游引物5′-GGGCACGAAGGCTCATCATT-3′,将cDNA产物10倍稀释后,以β-actin为内参进行Real-time PCR,反应条件为95 ℃预变性5 min;95 ℃ 5 s,60 ℃ 15 s,72 ℃ 15 s(39个循环);反应结束建立溶解曲线。同一实验重复3次,实验数据分析采用2-△△Ct法计算。
1.2.4 Western blot检测转染细胞中Grp94蛋白表达水平消化收集转染72 h后的各组,提取总蛋白,采用BCA法测定浓度。取适量细胞裂解液,加入SDS上样缓冲液,100 ℃加热变性处理5 min。取50 μg/孔蛋白样品上样,经8%SDS-PAGE电泳后,将目的蛋白转移到PVDF膜上,5%脱脂奶粉封闭2 h,与一抗(Grp94、β-actin)4 ℃摇床孵育过夜,TBST洗3次,每次10 min,再分别与相应HRP标记的二抗室温孵育2 h,采用ECL化学发光法进行检测。
1.2.5 沉默Grp94基因对细胞迁移及侵袭能力影响的检测Transwell实验不铺Matrigel 胶,37 ℃、5%CO2培养24 h后取出小室,其余步骤参照侵袭实验。
将Matrigel胶4 ℃过夜,用预冷的无血清RPMI1640培养基按1 ∶8稀释后,每孔均匀铺入60 μL Transwell小室上室中,小室置于24孔培养板中,37 ℃孵箱过夜。收集转染24 h后的各组细胞。按1×104个细胞/孔接种于上室,并加入100 μL RPMI1640无血清培养基,下室加入600 μL含10%FBS的RPMI1640培养基。37 ℃孵箱培养24 h,甲醇固定30 min,0.1%结晶紫染色,光镜下随机选取3个视野计数。
1.2.6 沉默Grp94基因后分别使用Real-time PCR法和Western blot法在mRNA水平、蛋白水平对基质金属蛋白酶MMP2和MMP9基因的检测将cDNA产物10倍稀释后,以β-actin为内参进行Real-time PCR,用于扩增MMP2 cDNA的上游引物为5′-CGCAGTG-ACGGAAAGATGTGGT-3′,下游引物为5′-AGAGCTCC-TGAATGCCCTTGATGT-3′;MMP9的上游引物为5′-A-CGCAGACATCGTCATCC-3′,下游引物为5′-AACCGAGTTGAACCACG-3′,反应条件为95 ℃预变性5 min;95 ℃ 5 s,58 ℃ 15 s,72 ℃ 15 s(39个循环);反应结束建立溶解曲线。同一实验重复3次,实验数据分析采用2-△△Ct法计算Western blot实验步骤参照方法1.2.4。
1.3 统计学分析
采用SPSS 18.0统计软件,各组实验数据均以x ±s 表示,配对组间采用t检验。
2 结果 2.1 沉默Grp94基因在ECA109细胞中的鉴定结果Real-time PCR 检测结果显示:实验组Grp94基因 mRNA表达水平(0.06±0.02)明显低于对照组(1.02± 0.25),差异具有统计学意义(P<0.01,图 1)。Western blot检测发现Grp94蛋白表达也明显减少,提示实验组Grp94基因被有效沉默。

|
| 图 1 Western blot检测蛋白水平Grp94siRNA干扰效率 |
显微镜下计数各组穿过基底膜的细胞数,统计分 析结果显示,实验组的迁移细胞数(53.67±8.76)明显少于对照组(111.67±6.89),差异均有统计学意义(P<0.05,图 2)。提示实验组细胞迁移能力明显降低。
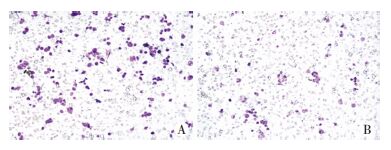
|
| A:对照组;B:实验组 图 2 实验检测siGrp94干扰后各组细胞迁移能力 |
显微镜下计数各组穿过基底膜的细胞数,统计分析结果显示,实验组侵袭细胞数量(8.00±0.58)明显少于对照组(98.67±5.21),差异均有统计学意义(P<0.01,图 3)。提示实验组细胞侵袭能力明显降低。

|
| A:对照组;B:实验组 图 3 Transwell 实验检测siGrp94干扰后各组细胞侵袭 能力 (×100) |
Real-Time PCR、Western blot检测结果显示,实验 组MMP2和MMP9基因表达水平明显低于阴性对照组(P<0.05,图 4、5),说明抑制Grp94基因表达的同时能从mRNA和蛋白水平抑制MMP2和MMP9的表达。

|
| a:P<0.05,与对照组比较 图 4 Real-time PCR mRNA水平检测沉默Grp94表达对MMP2、MMP9的影响 |

|
| 图 5 Western blot 蛋白水平检测沉默Grp94表达对MMP2、MMP9的影响 |
食管癌是威胁人类健康最常见的消化道恶性肿瘤之一,虽然近年来针对食管癌的综合治疗方法在不断地改进和完善,但其5年生存率并没有显著提高,由微转移灶而引起的复发、转移,仍是导致食管癌患者预后不良的重要原因,因此研究食管癌浸润转移因素并阐明其机制,对于提高食管癌患者的生存率是至关重要的[2, 3, 4, 5]。
基质金属蛋白酶家族(matrix metallo-proteinases,MMPs)在肿瘤侵袭转移中起关键性作用,是wnt/β-catenin通路下游的重要调控因子[6, 7],可降解细胞外基质中的各种蛋白成分,其高表达与肿瘤侵袭、转移、血管生成密切相关,从而在肿瘤浸润转移中的作用日益受到重视[8, 9]。有研究表明,MMPs可能促进转录生长因子-α(transforming growth factor-α,TGF-α)释放,介导表皮生长因子受体(epithelial growth factor receptor,EGFR)的激活和磷酸化,活化细胞外信号调节激酶ERK1/2,促进肿瘤细胞增殖和侵袭转移[10]。食管癌细胞的侵袭迁移能力与MMPs家族成员MMP2、MMP9表达水平密切相关[11, 12]。同时抑制MMP2、MMP9的表达可以抑制前列腺癌发生转移[13],而活化的MMP2、MMP9通过降解及重塑细胞外基质促进肿瘤细胞穿过细胞基质、基底膜、血管及淋巴管而向远处侵袭。
内质网分子伴侣Grp94是肿瘤细胞生存的重要因子,在肺癌、乳腺癌、结肠癌等肿瘤中有较高的表达水平,目前已证实在多种肿瘤细胞中呈增高趋势,参与肿瘤细胞的新陈代谢使其正常的生长。实验表明,食管癌患者Grp94基因的表达水平显著高于相应的癌旁组织[14],Grp94在早期浸润性癌呈极显著过度表达,表达增强率62.0%[15],本研究进一步在细胞水平上研究下调Grp94基因表达后对食管癌侵袭转移的影响,及其可能的作用机制。本研究中Transwell 迁移与侵袭实验结果显示敲降Grp94基因后,食管癌ECA109细胞的体外侵袭迁移能力明显降低,证实了下调Grp94表达可抑制食管癌ECA109细胞的体外侵袭迁移能力;同时,Grp94表达下调能使食管癌细胞ECA109中MMP2、MMP9表达下调,提示高表达的Grp94可能通过调控MMPs的表达,从而影响细胞的侵袭转移能力。同时Hua等[16]研究发现,在多发性骨髓瘤细胞中下调Grp94可以阻断wnt/β-catenin信号通路抑制细胞增殖促进凋亡,由此提示我们,在食管癌细胞ECA109中,下调Grp94可能通过阻断wnt/β-catenin信号通路抑制MMPs的表达,进而促进食管癌浸润转移及恶性发展,这将是我们今后工作的重点,为食管癌的基因靶向治疗提供一定的理论依据。
综上,本研究发现Grp94在食管癌的恶性发展中起着重要作用。Grp94有望作为一种新的肿瘤预后标志物,我们相信本研究将为临床上恶性肿瘤的诊断,预后以及个体化治疗方案上提供新的策略。
| [1] | Marzec M, Eletto D, Argon Y. GRP94: an HSP90-like protein specialized for protein folding and quality control in the endoplasmic reticulum[J]. Biochim Biophys Acta, 2012, 1823(3): 774-787. |
| [2] | Tachimori Y, Nagai Y, Kanamori N, et al. Pattern of lymph node metastases of esophageal squamous cell carcinoma based on the anatomical lymphatic drainage system[J]. Dis Esophagus, 2011, 24(1): 33-38. |
| [3] | Kim T, Grobmyer S R, Smith R, et al. Esophageal cancer - - the five year survivors[J]. J Surg Oncol, 2011, 103(2): 179-183. |
| [4] | Shin H R, Carlos M C, Varghese C. Cancer control in the Asia Pacific region: current status and concerns[J]. Jpn J Clin Oncol, 2012, 42(10): 867-881. |
| [5] | Bharat A, Crabtree T. Management of advanced-stage operable esophageal cancer [J]. Surg Clin North Am, 2012, 92(5): 1179-1197. |
| [6] | Planutiene M, Planutis K, Holcombe R F. Lymphoid enhancer-binding factor 1, a representative of vertebrate-specific Lef1/Tcf1 sub-family, is a Wnt-beta-catenin pathway target gene in human endothelial cells which regulates matrix metalloproteinase-2 expression and promotes endothelial cell invasion[J]. Vasc Cell, 2011, 3: 28. |
| [7] | Kwon M, Lee S J, Wang Y, et al. FilaminA interacting protein 1-like inhibits WNT signaling and MMP expression to suppress cancer cell invasion and metastasis[J]. Int J Cancer, 2014, 135(1): 48-60. |
| [8] | Groblewska M, Siewko M, Mroczko B, et al. The role of matrix metalloproteinases (MMPs) and their inhibitors (TIMPs) in the development of esophageal cancer [J]. Folia Histochem Cytobiol, 2012, 50(1): 12-19. |
| [9] | Merdad A, Karim S, Schulten H J, et al. Expression of matrix metalloproteinases (MMPs) in primary human breast cancer: MMP-9 as a potential biomarker for cancer invasion and metastasis[J]. Anticancer Res, 2014, 34(3): 1355-1366. |
| [10] | Khasigov P Z, Podobed O V, Gracheva T S, et al. Role of matrix metalloproteinases and their inhibitors in tumor invasion and metastasis[J]. Biochemistry (Mosc), 2003, 68(7): 711-717. |
| [11] | Jing S W, Wang Y D, Chen L Q, et al. Hypoxia suppresses E-cadherin and enhances matrix metalloproteinase-2 expression favoring esophageal carcinoma migration and invasion via hypoxia inducible factor-1 alpha activation [J]. Dis Esophagus, 2013, 26(1): 75-83. |
| [12] | Shen H, Yang Y, Xia S, et al. Blockage of Nrf2 suppresses the migration and invasion of esophageal squamous cell carcinoma cells in hypoxic microenvironment [J]. Dis Esophagus, 2014, 27(7): 685-692. |
| [13] | Shen K H, Liao A C, Hung J H, et al. α-Solanine inhibits invasion of human prostate cancer cell by suppressing epithelial-mesenchymal transition and MMPs expression [J]. Molecules, 2014, 19(8): 11896-11914. |
| [14] | 李海燕, 王小平, 陈瑞芬, 等. 人食管癌组织中热休克蛋白70和糖调节蛋白94的表达[J]. 首都医科大学学报, 2004, 25(2) : 183-185, |
| [15] | 侯艳芳. 食管鳞癌中多肿瘤标记物表达的临床意义[D]. 开封: 河南大学, 2012. |
| [16] | Hua Y, White-Gilbertson S, Kellner J, et al. Molecular chaperone gp96 is a novel therapeutic target of multiple myeloma[J]. Clin Cancer Res, 2013, 19(22): 6242-6251. |



