2453000 河南 新乡,新乡医学院第一附属医院:儿童重症监护室
2Pediatric Intensive Care Unit,First Affiliated Hospital,Xinxiang Medical University,Xinxiang,Henan Province,453000,China
在过去几十年,随着现代生物研究的发展,对肿瘤疾病的治疗手段也日益丰富。根据肿瘤组织的特点进行靶向治疗成为了热点[1, 2]。整合素受体(integrins receptors)在黑素瘤癌、神经胶质瘤和肺癌等多种肿瘤细胞表面高度表达,因此整合素αvβ3常被用作肿瘤靶向的特异性靶点[3, 4, 5]。精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)能有效识别整合素受体[6]。我们前期的研究已经证实了RGD修饰共载紫杉醇与microRNA-34a脂质体不仅能够增强与肺癌A549细胞具有良好的亲和力和对肿瘤球的穿透能力,还能增强肿瘤细胞增殖抑制能力和肿瘤球生长抑制能力[7]。 本研究进一步探讨RGD修饰共载紫杉醇与microRNA- 34a脂质体的体内药代动力学特点、体内肿瘤靶向性和体内抗肿瘤能力,通过对RGD修饰共载紫杉醇与microRNA-34a脂质体的体内外性质和肿瘤靶向性全面的研究为其临床应用提供实验基础。
1 材料与方法 1.1 材料与仪器microRNA-34a(上海吉玛生物技术有限公司);紫杉醇(重庆美联制药有限公司,批号:S05055,纯度99.7%);精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD,上海强耀生物科技公司);DMEM高糖培养基(美国Gibco公司);其余试剂为分析纯。人源肺癌细胞(A549,ATCC);雄性裸鼠(购自新乡医学院实验动物中心)。
1.2 方法 1.2.1 肺癌移植瘤模型的构建及分组A549细胞,用含100 mg/L双抗,10%胎牛血清的DMEM培养基培养。培养条件为:5%CO2,37 ℃饱和湿度。取体质量20~25 g的雄性裸鼠,将A549细胞悬浊液皮下接种于裸鼠背部,7 d后出现米粒大肿瘤证实接种成功。取3只接种成功后的荷瘤裸鼠分为生理盐水组、RGDLP组和LP组用于近红外活体成像实验。取12只接种成功后的荷瘤裸鼠随机分为miLPs-34a/PTX组、RGD miLPs-34a组、RGDLP-PTX组和RGD miLPs-34a/PTX组,每组3只,用于体内药代动力学实验。取30只接种成功后的荷瘤裸鼠分为生理盐水组、miLPs-34a/PTX组、RGD miLPs-34a组、RGDLP-PTX组和RGDmiLPs-34a/PTX组,每组6只,用于体内抗肿瘤实验。
1.2.2 RGD miLPs-34a/PTX的血清稳定性和体内药代动力学研究通过测定脂质体在50%血清环境下的浊度变化考察脂质体在50%血清中的稳定性[8, 9, 10]。取miLPs-34a/PTX、RGDmiLPs-34a、RGDLP-PTX和RGDmiLPs-34a/PTX,取一定量脂质体与等体积胎牛血清(过膜除去蛋白沉淀,链霉素和青霉素浓度2 000 U/mL)混合后,于37 ℃环境下孵育,分别计算各时间点各组脂质体溶液在含50%血清环境中透光率与含50%FBS的磷酸盐缓冲液透光率的比值。
参照文献[7,11]方法制备microRNA-34a被Cy3标记的RGD miLPs-34a/PTX。从尾静脉以10 μmol/kg 的microRNA-34a浓度注射脂质体样品和Cy3标记的microRNA-34a,分别于 0.16、2、4、8、18、30、48 h 时通过断尾取血法采集约25 μL 血液于肝素管中,混匀后,取20 μL血液于另一EP管中,加入 220 μL生理盐水(pH=7.4),涡旋(1 000 r/min,4 s)混匀,于2 500 r/min离心5 min沉淀血细胞,小心吸取200 μL上清,加入50 μL 10%的 Triton X-100 水溶液,于空气浴摇床中避光孵育裂解脂质体(37 ℃,180 r/min,30 min),取200 μL 裂解液于 96孔荧光酶标板中,用 ScanIt生物发光仪测定其荧光强度(Ex=555 nm,Em=570 nm,测定时间 200 ms)。以0.16 h的Cy3浓度作为注射载药脂质体时,起始点0 h为100%血药浓度,各时间点的相对于起始点0 h的血药浓度百分比按公式计算。ID=(各时间点的Cy3浓度)/(0.16 h的Cy3浓度)×100%。
1.2.3 活体成像取荷瘤裸鼠尾静脉注射载DIR脂质体,24 h后腹腔注射水合氯醛溶液麻醉后置于活体成像仪下观察脂质体的体内分布(Ex=780 nm,Em=810 nm)。心脏灌流将各器官中血液替换完全后分离荷A549 瘤裸鼠肿瘤组织,以4 μm 的厚度冰冻切片,4%多聚甲醛室温固定30 min,PBS 清洗3次,DAPI 孵育5 min 使细胞核染色,冷 PBS 洗涤 3 次后甘油封片,激光共聚焦显微镜下观察各组脂质体在肿瘤组织细胞内的分布情况。
1.2.4 RGD miLPs-34a/PTX抗肿瘤研究荷瘤裸鼠在第3、6、9天和12天尾静脉注射0.1 mL生理盐水、miLPs-34a/PTX、RGDmiLPs-34a、RGDLP-PTX和RGDmiLPs-34a/PTX,每天观察其活动度和饮食习惯,第21天后剖肿瘤,称量,计算抑瘤率。抑瘤率计算公式:抑瘤率=(1-M脂质体/M生理盐水)×100%。其中M脂质体表示各脂质体干预组在第21天处死裸鼠后肿瘤的质量;M生理盐水表示生理盐水组在第21天处死裸鼠后肿瘤的质量。
1.3 统计学方法实验数据以x±s表示,采用SPSS 21.0统计软件进行数据分析,2组间比较用t检验,多组间比较用方差分析。
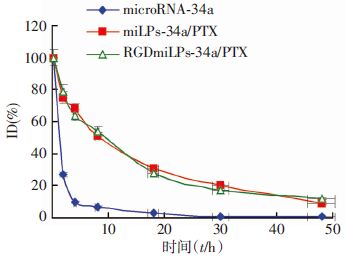
2 结果 2.1 RGD miLPs-34a/PTX的体外血清稳定性和体内药代动力学体外血清性实验结果见图 1,miLPs-34a/PTX、RGD miLPs-34a、RGD LP-PTX和RGD miLPs-34a/PTX在24 h与50%FBS磷酸盐缓冲液的透光率比值均在90%上,表明4种脂质体在50%血清环境中均比较稳定。体内药代动力学分析结果见图 2,在荷瘤小鼠血液中的microRNA-34a的消除速率明显快于miLPs-34a/PTX和RGD miLPs-34a/PTX组,Cy3荧光强度直到第48 h才完全消失。计算得到microRNA-34a的半衰期(t1/2)为(0.29±0.07)h,miLPs-34a/PTX和RGD miLPs-34a/PTX的半衰期分别为(1.79±0.10)h和(1.82±0.09)h。miLPs-34a/PTX和RGD miLPs-34a/PTX的半衰期显著长于microRNA-34a,差异有统计学意义(P<0.05);miLPs-34a/PTX和RGDmiLPs-34a/PTX的半衰期无显著差异(P>0.05)。

|
| 图 1 不同脂质体的体外血清稳定性 |
|
| 图 2 microRNA-34a、miLPs-34a/PTX和RGDmiLPs-34a/PTX在荷瘤裸鼠体内的药时曲线 |
近红外活体成像实验结果见图 3,RGDLP在肿瘤组织中蓄积很明显,在其他组织中分布较少甚至没有分布。RGDLP在肿瘤组织的荧光强度显著强于LP。说明经过RGD修饰后能够增强脂质体的肿瘤蓄积能力。肿瘤组织细胞内的分布情况见图 4,LP组肿瘤组织荧光分布较均匀且较弱,相较于LP组,RGDLP组荧光强度较强,这与近红外活体成像的结果一致。

|
| A:生理盐水组;B:LP组;C:RGDLP组 图 3 各组荷瘤裸鼠的近红外成像观察 |

|
| 图 4 激光共聚焦显微镜观察各组荷瘤裸鼠脂质体在肿瘤组织细胞内的分布情况 |
对荷瘤裸鼠的治疗结果见表 1,与生理盐水组比较,miLPs-34a/PTX、RGDmiLPs-34a、RGDLP-PTX和RGDmiLPs-34a/PTX都能有效抑制肺癌移植瘤的生长。RGDmiLPs-34a/PTX对肿瘤生长的抑制作用显著强于其他脂质体,差异有统计学意义(P<0.01)。
| 组别 | 肿瘤质量(g) | 抑瘤率(%) |
| 生理盐水组 | 5.16±0.24 | 0 |
| miLPs-34a/PTX组 | 3.84±0.22a | 25.6±4.9a |
| RGDmiLPs-34a组 | 4.28±0.21a | 19.0±3.3a |
| RGDLP-PTX组 | 3.18±0.18a | 38.4±7.2a |
| RGDmiLPs-34a/PTX组 | 1.81±0.09ab | 64.9±7.5ab |
| a:P<0.01,与生理盐水组比较;b:P<0.01,与miLPs-34a/PTX、RGDmiLPs-34a组和RGDLP-PTX组比较 | ||
整合素受体是在肿瘤细胞表面大量表达的特异性受体[12]。将与整合素受体具有特异性亲和力的RGD肽连接到纳米给药系统的表面进行肿瘤靶向治疗已经被广泛研究,并取得了初步成效[13, 14]。张小文等[15]将RGD连接到脂质体表面,实现了对卵巢癌细胞的靶向递药。MicroRNA-34a是与人类癌症的发生和发展相关的最突出的内源性miRNA之一,它是一种肿瘤抑制基因,它能够有效地抑制肿瘤的发展[16]。在肺癌发 生后,MicroRNA-34a水平通常会下调。增加 MicroRNA- 34a在肺内的表达可以下调肿瘤中的 survivin 蛋白,因而可以抑制肿瘤的生长[17],我们的研究同样表明 MicroRNA-34a能够通过直接抑制肺癌干细胞的增殖[18],因此本研究通过脂质体给药系统对荷瘤小鼠进行MicroRNA-34a递药以期望增强抗肺癌生长作用。紫杉醇是临床上常用的抗肿瘤药物。我们前期的研究也已经证实,经过RGD修饰后能够增强共载紫杉醇与microRNA-34a脂质体被肺癌A549细胞摄取和对A549细胞的增殖抑制作用。本研究进一步探讨了RGD修饰共载紫杉醇与microRNA-34a脂质体的体外血清稳定性和体内抗肿瘤活性。
研究结果证实,RGD修饰共载紫杉醇与microRNA-34a脂质体具有良好的体外血清稳定性,这为体内药代动力学实验提供了实验依据。利用Cy3标记microRNA-34a,然后测定血液当中Cy3的荧光强度来表示脂质体的量,考察脂质体的药时曲线,用二室模型进行模拟[19]脂质体在体内的代谢过程。体内药代动力学实验结果显示,microRNA-34a在很短的时间内从荷瘤裸鼠血液中消失,这可能是由于microRNA-34a被血液中的核酸酶所分解[20],而脂质体组的microRNA-34a直到第48 h后才消失。脂质体组的半衰期也显著长于microRNA-34a。这有助于脂质体通过EPR效应实现肿瘤蓄积。近红外活体成像仪常常被用于纳米载体的靶向性的定性研究,结果显示,经过RGD修饰的脂质体能够增强肿瘤蓄积能力,肿瘤组织切片结果显示,RGDLP在肿瘤细胞细胞核周围大量分布,在实体肿瘤中也显示出良好的入胞能力,这与我们前期体外实验结果一致。裸鼠治疗实验结果显示出RGDmiLPs-34a/PTX对荷瘤裸鼠移植瘤的生长抑制作用最强。这也证实了体外研究中细胞增殖抑制实验的结果。
综上所述,RGD修饰共载紫杉醇与microRNA-34a脂质体不仅能够在体外具有良好的肺癌细胞亲和力和肺癌细胞增殖抑制能力,其在体内也具有优异的肺癌靶向性和肺癌治疗效果。RGD修饰共载紫杉醇与microRNA-34a脂质体是一种潜在有效的肺癌靶向给药系统。
| [1] | Calzolari A, Oliviero I, Deaglio S, et al. Transferrin receptor 2 is frequently expressed in human cancer cell lines[J]. Blood Cells Mol Dis, 2007, 39(1): 82-91. |
| [2] | Shah N, Chaudhari K, Dantuluri P, et al. Paclitaxel-loaded PLGA nanparticles surface modified with transferrin and Pluronic((R))-P85, an in vitro cell line and in vivo biodistribution studies on rat model[J]. J Drug Target, 2009, 17(7): 533-542. |
| [3] | Schiffelers R M, Molema G, ten-Hagen T L, et al. Ligand-targeted liposomes directed against pathological vasculature [J]. J Liposome Res, 2002, 12(1/2): 129-135. |
| [4] | Xiong X B, Huang Y, Lu W L, et al. Enhanced intracellular uptake of sterically stabilized liposomal Doxorubicin in vitro resulting in improved antitumor activity in vivo[J]. Pharm Res, 2005, 22(6): 933-939. |
| [5] | Oba M, Fukushima S, Kanayama N, et al. Cyclic RGD peptide-conjugated polyplex micelles as a targetable gene delivery system directed to cells possessing alphavbeta3 and alphavbeta5 integrins[J]. Bioconjug Chem, 2007, 18(5): 1415-1423. |
| [6] | Teesalu T, Sugahara K N, Kotamraju V R, et al. C-end rule peptides mediate neuropilin-1-dependent cell, vascular, and tissue penetration[J]. Proc Natl Acad Sci USA, 2009, 106(38): 16157-16162. |
| [7] | 赵欣. RGD修饰共载紫杉醇与microRNA-34a脂质体靶向抑制A549肺癌细胞的初步研究[J]. 第三军医大学学报, 2014, 36(11): 1183-1186. |
| [8] | Kuai R, Yuan W, Qin Y, et al. Efficient delivery of payload into tumor cells in a controlled manner by TAT and thiolytic cleavable PEG co-modified liposomes[J]. Mol Pharm, 2010, 7(5): 1816-1826. |
| [9] | Kuai R, Yuan W, Li W, et al. Targeted delivery of cargoes into a murine solid tumor by a cell-penetrating peptide and cleavable poly(ethylene glycol) comodified liposomal delivery system via systemic administration[J]. Mol Pharm, 2011, 8(6): 2151-2161. |
| [10] | Ying X, Wen H, Lu W L, et al. Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals[J]. J Control Release, 2010, 141(2): 183-192. |
| [11] | Chang S, Guo J, Sun J, et al. Targeted microbubbles for ultrasound mediated gene transfection and apoptosis induction in ovarian cancer cells[J]. Ultrason Sonochem, 2013, 20(1): 171-179. |
| [12] | Garcia-Garcia E, Andrieux K, Gil S, et al. Colloidal carriers and blood-brain barrier (BBB) translocation: a way to deliver drugs to the brain? [J]. Int J Pharm, 2005, 298(2): 274-292. |
| [13] | Huile G, Shuaiqi P, Zhi Y, et al. A cascade targeting strategy for brain neuroglial cells employing nanoparticles modified with angiopep-2 peptide and EGFP-EGF1 protein[J]. Biomaterials, 2011, 32(33): 8669-8675. |
| [14] | Zhang L, Zhang L. Lipid-polymer hybrid nanoparticles: synthesis, characterization and applications[J]. Nano LIFE, 2010, 1(1/2): 163-173. |
| [15] | 张小文, 吴静. 整合素受体介导共载紫杉醇和姜黄素脂质体的构建及其抗肿瘤研究[J]. 中国生化药物杂志, 2014, 34(1): 62-64. |
| [16] | Zhan C, Gu B, Xie C, et al. Cyclic RGD conjugated poly(ethylene glycol)-co-poly(lactic acid) micelle enhances paclitaxel anti-glioblastoma effect[J]. J Control Release, 2010, 143(1): 136-142. |
| [17] | Chen Y, Zhu X, Zhang X, et al. Nanoparticles modified with tumor-targeting scFv deliver siRNA and miRNA for cancer therapy[J]. Mol Ther, 2010, 18(9): 1650-1656. |
| [18] | 赵欣. 载microRNA-34a脂质体靶向治疗肺癌干细胞靶的研究[J]. 中国生化药物杂志, 2014, 34(1): 68-71. |
| [19] | Chang J, Jallouli Y, Kroubi M, et al. Characterization of endocytosis of transferrin-coated PLGA nanoparticles by the blood-brain barrier[J]. Int J Pharm, 2009, 379(2): 285-292. |
| [20] | Jiang X, Xin H, Gu J, et al. Solid tumor penetration by integrin-mediated pegylate poly(trimethylene carbonate) nanoparticles loaded with paclitaxel[J]. Biomaterials, 2013, 34(6): 1739-1746. |



