2233030 安徽 蚌埠,蚌埠医学院:临床检验基础教研室
2Department of Basic Clinical Laboratory Medicine,Bengbu Medical College,Bengbu,Anhui Province,233030,China
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是磷脂酰肌醇3-激酶相关激酶(phosphatidylinositol 3-kinase-related kinase,PIKK)蛋白家族的成员之一,属于丝/苏氨酸蛋白激酶[1]。mTOR复合体能够通过磷酸化其下游的靶蛋白如40S 核糖体S6 蛋白激酶(p70 ribosomal protein S6 kinases,p70S6K)和真核启动因子4E结合蛋白1(eukaryotic initiation factor 4E binding protein 1,4E-BP1)等来调节细胞的生长、增殖和凋亡等活动。近年来研究表明,mTOR信号通路的异常活化与多种癌症发生发展密切相关[2]。在粒细胞白血病细胞中,mTOR通路处于异常活化状态[3]。
三七总皂苷(Panax notoginseng saponins,PNS)是从植物三七中提取的有效药用成分[4]。研究显示PNS及其单体具有抗肿瘤作用[5],然而,有关PNS对白血病细胞的作用研究较少,且其作用的机制尚不明确。本研究通过观察PNS抑制K562细胞增殖过程中mTOR信号通路部分信号分子的变化来探讨PNS抑制K562细胞增殖的机制。
1 材料与方法 1.1 主要试剂K562细胞株为本实验室冻存,胎牛血清购自杭州四季青生物工程材料有限公司,RPMI1640培养基购自Gibco公司,MTT、DMSO购自Sigma公司,蛋白裂解液和蛋白定量试剂盒购自碧云天生物技术研究所,三七总皂苷购自南京广润生物制品有限公司,一抗mTOR、p70S6K、4E-BP1、p-mTOR(Ser2448)、p-p70S6K(Thr229/389)、p-4E-BP1(Thr37/46)购自Affinity Biosciences 公司,二抗为HRP标记的羊抗兔IgG和HRP标记的羊抗鼠IgG,购自Santa Cruz公司。
1.2 主要溶液配制三七总皂苷用含10%胎牛血清的RPMI1640培养基溶解并稀释成5 mg/mL,分装后4 ℃保存。
1.3 细胞培养使用含10%胎牛血清的RPMI1640培养基,在37 ℃、5% CO2的饱和湿度培养箱中培养。待细胞浓度达到106/mL时进行半量换液,半量换液3次后离心去除培养基进行传代。选择对数生长期的细胞进行各项实验。
1.4 MTT法测定三七总皂苷对K562细胞增殖活性的影响取对数生长期的K562细胞,离心后弃去旧培养基,加入新鲜培养基,调整细胞浓度为105/mL,每孔50 μL 接种于3个96孔板,再加入三七总皂苷稀释液,最后补齐培养基100 μL,使三七总皂苷的终浓度分别为0、50、100、200、400、800 μg/mL,每种浓度设置5个复孔,同时设置空白孔。3个96孔板分别孵育24、48、72 h,结束孵育前4 h向各孔加入20 μL MTT溶 液(5 mg/mL),继续培养4 h后2 000 r/min离 心15 min,吸去上清,最后每孔加入150 μL DMSO,震荡10 min,充分溶解后使用酶标仪检测各孔光密度值[D(490)],计算5个复孔的平均值。细胞存活率= [D(490)给药-D(490)空白]/[D(490)对照-D(490)空白]。 实验重复3次。
1.5 AO/EB双荧光染色法观察三七总皂苷作用后K562细胞的凋亡及死亡率取对数生长期的K562细胞离心去旧培养基,加入新鲜培养基重悬,接种于6孔板中,加入三七总皂苷稀释液,最后补齐培养基3 mL,使细胞浓度为2×105/mL,三七总皂苷终浓度分别为0、100、200、400 μg/mL。培养24 h后收集全部细胞于离心管中,1 000 r/min 离心10 min,使用PBS重悬细胞,调整细胞浓度为106/mL,取细胞悬液100 μL,加入AO、EB 工作液(100 μg/mL)各2 μL,混匀后取1滴涂于载破片上,在荧光显微镜下计数200个细胞并计算红色荧光细胞的比例。分类标准:A活细胞:核染色质呈均匀绿色荧光并结构正常;B早期凋亡细胞:核染色质呈绿色固缩状或串珠状;C晚期凋亡细胞和死亡细胞:核染色质为桔红色并呈固缩或圆珠状或核染色质着均匀桔红色。实验重复3次。
1.6 RT-PCR 检测三七总皂苷作用后K562细胞的mTOR、p70S6K和4E-BP1mRNA表达量的变化K562细胞分组及加药情况同1.5,72 h后收集细胞,提取总RNA,紫外分光光度计测量RNA浓度,每组取2 μg RNA进行逆转录,合成cDNA第1条链后,按照剂盒要求对各组样本目的基因mTOR、p70S6K、4E-BP1及内参基因GAPDH 进行扩增。引物序列、扩增长度及退火温度见表 1。PCR扩增条件:94 ℃预变性5 min;94 ℃变性35 s,退火35 s,72 ℃延伸35 s,共30个循环;继而72 ℃10 min终止延伸,4 ℃保存。反应完成后取5 μL PCR产物在1.5%的琼脂糖凝胶中电泳。使用Bio-Rad凝胶成像仪检测条带并进行灰度分析。计算各组mTOR、p70S6K和4E-BP1mRNA的相对表达量。
| 引物名称 | 引物序列 | 扩增长度 | 退火温度 |
| mTOR | 上游:5′-CGCTGTCATCCCTTTATCG-3′ | 193 bp | 53 ℃ |
| 下游:5′-ATGCTCAAACACCTCCACC-3′ | |||
| p70S6K | 上游:5′-TACTTCGGGTACTTGGTAA-3′ | 188 bp | 49 ℃ |
| 下游:5′-GATGAAGGGATGCTTTACT-3′ | |||
| 4E-BP1 | 上游:5′-ACCGGAAATTCCTGATGGAG-3′ | 156 bp | 55 ℃ |
| 下游:5′-CCCGCTTATCTTCTGGGCTA-3′ | |||
| GAPDH | 上游:5′-CAAGGTCATCCATGCAACTTTG-3′ | 496 bp | 58 ℃ |
| 下游:5′-GTCCACCACCCTGTTGCTGTAG-3′ |
实验分组、药物浓度及培养时间同1.6,收集各组细胞后用蛋白裂解液提取细胞总蛋白,用BCA法进行蛋白定量,蛋白变性后各取30 μg蛋白进行SDS-PAGE电泳。其中mTOR使用6%分离胶,p70S6K及β-actin使用10%分离胶,4E-BP1使用12%分离胶。然后转膜至PVDF膜,室温封闭2 h。4 ℃孵育一抗过夜。TBST洗膜后37 ℃孵育二抗2 h。TBST洗膜,ECL显色后在Bio-Rad凝胶成像仪上曝光检测条带并进行灰度分析。
取对数生长期的K562细胞接种于6孔板中,加入三七总皂苷稀释液,最后补齐培养基3 mL,使细胞浓度为2×105/mL,对照组不加药培养3 h后收集细胞提取总蛋白,实验组三七总皂苷终浓度为200 μg/mL,分别于培养1、2、3 h后收集全部细胞提取总蛋白,使用p-mTOR(Ser2448)、p-p70S6K(Thr229/389)、p-4E-BP1(Thr37/46)蛋白抗体检测磷酸化蛋白,方法同上。
1.8 统计学处理使用SPSS 17.0软件进行统计学分析,数据以x±s 表示。组间比较采用单因素方差分析,两两比较采用SNK法。
2 结果 2.1 三七总皂苷抑制K562细胞增殖采用1.4中的公式处理MTT实验中的光密度结果,计算得出细胞存活率(表 2)。结果显示PNS浓度为50 μg/mL时,作用时间达到72 h,药物才表现出抑制细胞增殖的作用(P<0.05)。PNS浓度为100~800 μg/mL,作用时间为24~72 h时,其对细胞增殖的抑制作用具有时间依赖性和浓度依赖性,即随着时间的延长及药物浓度的增加,PNS对细胞增殖的抑制作用逐渐增强,且差异具有统计学意义(P<0.05)。通过统计分析得出PNS对K562细胞72 h的IC50为(229.07±2.36)μg/mL。
| PNS浓度(μg/mL) | 24 h | 48 h | 72 h |
| 0 | 100 | 100 | 100 |
| 50 | 99.55±1.18 | 98.29±1.66 | 94.48±2.25ab |
| 100 | 87.37±3.47ab | 82.82±1.29ab | 77.65±2.14ab |
| 200 | 75.87±3.81ab | 65.64±2.51ab | 51.21±2.19ab |
| 400 | 57.36±2.38ab | 45.13±3.32ab | 27.19±3.50ab |
| 800 | 28.15±2.04ab | 18.69±2.10ab | 9.19±2.05ab |
| a:P<0.05,与相同药物浓度的其他作用时间比较;b:P<0.05,与相同作用时间的其他药物浓度比较 | |||
经AO/EB染色后放大200倍镜检(图 1)显示,三七总皂苷作用于K562细胞24 h后,红色荧光细胞数目较对照组增多,且红色荧光的细胞数目所占的比例随着药物浓度的增加而增加。在浓度为100、200、400 μg/mL 时,红色荧光细胞比例分别为(12.2±2.0)%、(24.8±1.9)%、(44.2±2.1)%,差异有统计学意义(P<0.05)。结果显示,三七总皂苷能够促进K562细胞的死亡及凋亡,且具有浓度依赖性。
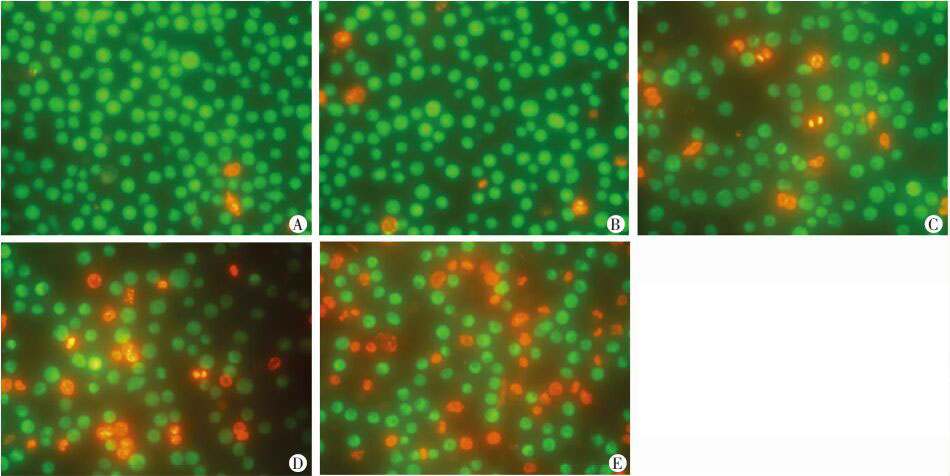
|
| A:对照组;B:50 μg/mL组;C:100 μg/mL组;D:200 μg/mL组;E:400 μg/mL组 图 1 AO/EB 双荧光染色法检测三七总皂苷作用24h后K562细胞的凋亡及死亡变化 (×200) |
RT-PCR 结果显示:经100、200、400 μg/mL PNS 作用72 h后,mTOR mRNA 的表达量均有降低。 上述3种药物浓度下,mTOR mRNA的相对表达量较对照组均显著降低(P<0.05,图 2)。而p70S6K及4E-BP1的mRNA没有明显变化,差异无统计学意义(P>0.05)。
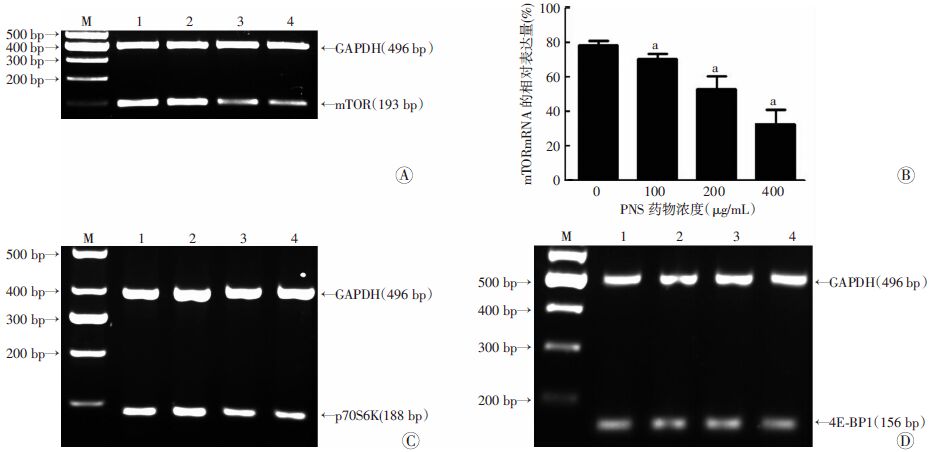
|
| A:RT-PCR检测mTOR mRNA表达;B:mTOR mRNA相对表达;C:RT-PCR检测p70S6K mRNA表达;D:RT-PCR检测4E-BP1 mRNA表达 M:标准,1:对照组,2:100 μg/mL组,3:200 μg/mL组,4:400 μg/mL组;a:P<0.05,与对照组(0 μg/mL)比较 图 2 PNS作用于K562细胞72 h后mTOR、p70S6K及4E-BP1 mRNA的变化 |
mTOR信号通路中各蛋白大部分以无活性状态存在,当上游信号刺激后发生磷酸化,转变为活化状态。癌细胞中的mTOR信号通路异常活化。Western blot结果显示三七总皂苷作用于K562细胞72 h后,100 μg/mL 组、200 μg/mL组、400 μg/mL组 mTOR总蛋白的相对表达量较对照组显著降低(P<0.05,图 3)。而p70S6K及4E-BP1这两种总蛋白的变化无 统计学意义(P>0.05)。图 4显示对照组及200 μg/mL 三七总皂苷作用于K562细胞1、2、3 h后,mTOR、p70S6K及4E-BP1的磷酸化水平逐渐减低,且差异具有统计学意义(P<0.05)。
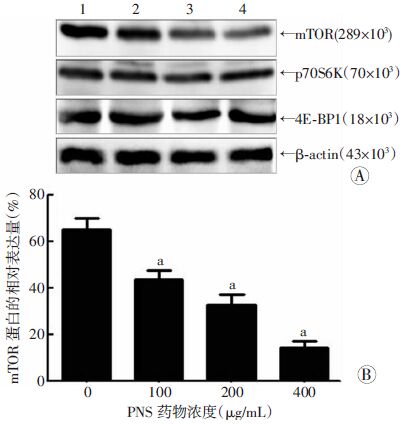
|
| A:Western blot检测结果 1:对照组,2:100 μg/mL组,3:200 μg/mL 组,4:400 μg/mL组;B:半定量分析 a:P<0.05,与对照组(0 μg/mL)比较 图 3 PNS作用于K562细胞72 h后mTOR、p70S6K和4E-BP1的蛋白表达变化 |
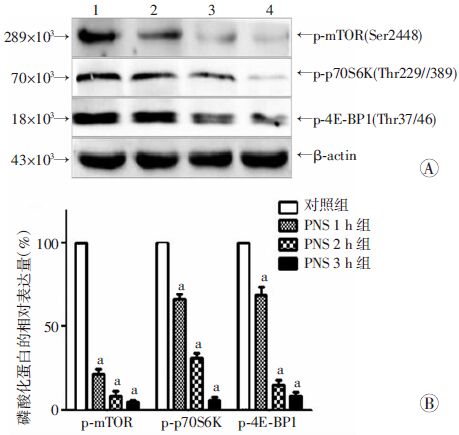
|
| A:Western blot检测结果 1:对照组,2:PNS作用1 h组,3:PNS 作用2 h组,4:PNS作用3 h组;B:半定量分析 a:P<0.05,与对照组(0 h)比较 图 4 三七总皂苷作用于K562细胞不同时间后mTOR、p70S6K及4E-BP1蛋白磷酸化水平变化 |
三七是常用的传统中药,三七皂苷被认为是三七的主要生理活性成分。近年来研究发现PNS能够明显抑制肝癌、前列腺癌、宫颈癌等癌细胞增殖。研究结果显示,浓度为200 μg/mL PNS作用72 h对宫颈癌HeLa细胞的抑制率为(54.57±0.976)%[6];PNS对前列腺癌PC-3细胞的48 h IC50值为931.3 μg/mL[7];200 μg/mL 的PNS作用72 h对HepG2、BEL-7402和 SMMC-7721三株肝癌细胞的增殖抑制率分别为(33.18± 0.13)%、(29.40±0.04)%、(33.38±0.18)%,而PNS对正常肝细胞L-02的增殖抑制不明显[8]。本实验MTT结果显示,当浓度为100~800 μg/mL,PNS对K562细胞增殖有明显的抑制作用且具有时间依赖性 和浓度依赖性,其72 h的IC50为(229.07±2.36)μg/mL。 由上述研究结果可知PNS对多种癌细胞具有增殖抑制作用,且不同癌细胞对PNS的敏感度不同。
由于PNS并非单一化学物质,因此其作用的靶点可能有多个。目前研究发现30 μmol/L PNS中的单体三七皂苷R1、人参皂苷Rb1和Rg1作用SW480细胞48 h后能够显著增加其凋亡,且能将细胞阻滞在S期及G2/M期[9]; PNS能够抑制乳腺4T1细胞迁徙和侵袭[10]; PNS能够降低PC-3细胞MMP-2及VCAM-1的 表达,抑制PC-3细胞迁移[7]。通过观察本实验AO/EB 双荧光染色结果可发现,PNS能够促进K562细胞死亡及凋亡,浓度为100、200、400 μg/mL的PNS作用于K562细胞24 h后,死亡及凋亡的细胞总比例分别为(12.2±2.0)%、(24.8±1.9)%、(44.2±2.1)%。表明PNS主要是通过促进肿瘤细胞凋亡、抑制肿瘤细胞增殖和迁移来发挥抗肿瘤作用。
K562细胞株是慢性粒细胞白血病急性变细胞株。Bcr/Abl是慢粒细胞的特征性融合蛋白,具有强烈的酪氨酸激酶活性[11],可促进Ras/MAPK、Jun/STAT5、PI3K/Akt/mTOR等多种信号途径的激活,其中PI3K/Akt/mTOR途径是Bcr/Abl介导的细胞恶性转化的关键环节[12, 13]。有学者研究发现,Bcr/Abl阳性细胞株中mTOR途径激活,其下游底物p70S6K及4E-BP1以Bcr/Abl依赖性方式被磷酸化[14]。mTOR信号通路可整合多种细胞外信号,参与基因转录、核糖体合成、蛋白质翻译等生物过程,在肿瘤细胞的生长和凋亡中发挥重要作用。那么PNS对K562细胞的抑制作用是否是与mTOR通路有关?本实验使用100~400 μg/mL PNS作用K562细胞72 h后发现,PNS能够通过降低K562细胞mTOR的转录水平来抑制mTOR蛋白的表达,并且能够降低K562细胞mTOR、p70S6K及4E-BP1蛋白的磷酸化水平。因为mTOR信号通路与细胞的生长、增殖及凋亡情况密切相关,且实验结果显示,mTOR信号通路的活性在PNS抑制K562细胞增殖的过程中受到了抑制,所以,降低mTOR信号通路的活性可能是PNS抑制K562细胞增殖的机制之一。
目前白血病的临床治疗多采用大剂量的联合化疗法,此疗法副作用大,尤其对机体免疫系统有很大伤害。研究人员发现PNS联合化疗药物比单独化疗药物具有更强的抗肿瘤作用。崔玲玲等[15]发现PNS能明显增加K562细胞对Ara-C的敏感性;王远航等[16]使用PNS联合低剂量的环磷酰胺作用于黑色素瘤模型小鼠,发现此种方法有增强抗肿瘤效果,并且能够提高小鼠免疫力。总之,PNS不仅具有抗肿瘤的作用,而且能够降低化疗药物的毒副作用,这提示PNS可以作为临床化疗药物的辅助用药。本实验研究发现降低mTOR信号通路的活性可能是PNS抑制K562细胞增殖的机制之一,为PNS治疗白血病的临床应用提供了一定的理论基础。
| [1] | Gibbons J J, Abraham R T, Yu K. Mammalian target of rapamycin: discovery of rapamycin reveals a signaling pathway important for normal and cancer cell growth[J]. Semin Oncol, 2009, 36(Suppl 3): S3-S17. |
| [2] | Sato T, Nakashima A, Tamanoi F. Rheb-mTOR signaling pathway involved in tumor formation[J]. Tanpakushitsu Kakusan Koso, 2010, 55(1): 11-17. |
| [3] | Martelli A M, Evangelisti C, Chappell W, et al. Targeting the translational apparatus to improve leukemia therapy: roles of the PI3K/PTEN/Akt/mTOR pathway[J]. Leukemia, 2011, 25(7): 1064-1079. |
| [4] | 熊敏琪, 陈瑜, 张腾. 三七皂苷临床应用的基础研究进展[J]. 中医药信息, 2014, 31(3): 149-153. |
| [5] | He F, Ding Y, Liang C, et al. Antitumor effects of dammarane-type saponins from steamed Notoginseng[J]. Pharmacogn Mag, 2014, 10(39): 314-317. |
| [6] | 邹存华, 付婷婷, 鲁强, 等. 三七总皂苷抑制Hela细胞增殖的实验研究[J]. 中华肿瘤防治杂志, 2012, 19(12): 888-891. |
| [7] | 倪晓辰, 赵志红, 仇炜, 等. 三七总皂苷对前列腺癌PC-3细胞增殖及迁移的抑制作用[J]. 中国肿瘤临床, 2011, 38(11): 638-641. |
| [8] | 文玲玲, 肖彬, 周辉. 三七总皂苷对三种不同人肝癌细胞株增殖的影响[J]. 肿瘤药学, 2013, 3(2): 100-103, 125. |
| [9] | Wang C Z, Xie J T, Fishbein A, et al. Antiproliferative effects of different plant parts of Panax notoginseng on SW480 human colorectal cancer cells[J]. Phytother Res, 2009, 23(1): 6-13. |
| [10] | Wang P, Cui J, Du X, et al. Panax notoginseng saponins (PNS) inhibits breast cancer metastasis[J]. J Ethnopharmacol, 2014, 154(3): 663-671. |
| [11] | Rumjanek V M, Vidal R S, Maia R C. Multidrug resistance in chronic myeloid leukaemia: how much can we learn from MDR-CML cell lines[J]. Biosci Rep, 2013, 33(6): e00081. |
| [12] | Vakana E, Sassano A, Platanias L C. Induction of autophagy by dual mTORC1-mTORC2 inhibition in BCR-ABL-expressing leukemic cells[J]. Autophagy, 2010, 6(7): 966-967. |
| [13] | Cilloni D, Sagilo G. Molecular pathway: BCR-ABL[J]. Clin Cancer Res, 2012, 18(4): 930-937. |
| [14] | Machado-Neto J A, Favaro P, Lazarini M, et al. Knockdown of insulin receptor substrate 1 reduces proliferation and downregulates Akt/mTOR and MAPK pathways in K562 cell[J]. Biochim Biophys Acta, 2011, 1813(8): 1404-1411. |
| [15] | 崔玲玲, 尹利明, 郑智茵. 三七总皂苷联合阿糖胞苷对K562细胞的影响[J]. 浙江中医药大学学报, 2012, 36(9): 1025-1028. |
| [16] | 王远航, 祝延, 张翠玲, 等. 三七总皂苷联合环磷酰胺节律化疗抗肿瘤效应观察[J]. 北京中医药大学学报, 2010, 33(1): 36-40, 插3. |



