膀胱癌发病率较高,占泌尿系肿瘤90%以上[1, 2]。其发病机制不详,可能涉及癌基因激活和抑癌基因失活[3]。临床根治性膀胱切除术仍是膀胱癌治疗的主要治疗方式,但术后病人生活质量极度下降,且术后复发率高,5年生存率仅50%左右[4, 5]。因此,发现利于临床诊断、治疗、预后评估的分子标志显得尤为重要。
机体衰老是肿瘤发生的易感因素,研究证实长寿相关基因参与调控这种易感性,如线虫长寿相关基因Sir2、daf-2、lin2、dct2、nnt-1等既能调控寿命,也能促进肿瘤细胞的增殖或凋亡,而它们在哺乳动物都有相应的同源基因[6, 7, 8, 9]。同时肿瘤细胞线粒体DNA突变率高,诸如线粒体Cyt b、ND6等基因突变甚至能促进肿瘤细胞演进,因此线粒体DNA突变所致的线粒体功能障碍已成为肿瘤细胞重要特点之一[10, 11, 12]。最新研究发现线粒体核糖体蛋白S5(mitochondrial ribosomal protein S5,MRPS5)基因通过线粒体代谢机能障碍途径调控线虫及小鼠的寿命,而且MRPS5作为线粒体核糖体28S小亚基成员,与线粒体能量代谢相关,我们由此推测肿瘤中MRPS5也可能发生功能改变进而调控肿瘤生物学功能。关于其在膀胱癌中的作用尚少见报道,本实验将探讨其对膀胱癌细胞增殖及干性特征的影响。 1 资料与方法 1.1 实验材料
人膀胱癌及癌旁组织由第三军医大学西南医院泌尿外科张恒提供,经患者知情同意用于研究。标本收集时间为2014年2-7月,均经病理诊断确诊。NOD/SCID小鼠购于重庆腾鑫生物技术公司并饲养于第三军医大学西南医院实验动物中心。人膀胱癌T24细胞由我室保存。RPMI1640培养基,胎牛血清,胰酶等细胞培养相关试剂购自Gibco公司。兔抗人MRPS5,Nanog,Oct4抗体购自Abcam公司,兔抗人GAPDH,Sox2抗体购自Cell Signaling公司,小鼠抗人c-Myc抗体购自Santa Cruz公司。CellTiter-Blue Cell Viability Assay试剂盒购自Promega公司。细胞周期检测试剂盒购自碧云天公司。分子克隆试剂及慢病毒包装质粒等主要由本室保存。BBG16UV151L二氧化碳培养箱及CKX41-A32PH倒置相差显微镜等分别购自Thermo,Olympus公司,流式细胞仪、Varioskan Flash多功能酶标仪由第三军医大学西南医院公共实验平台提供。 1.2 方法 1.2.1 细胞培养
T24细胞培养于10%胎牛血清RPMI1640(含青、链霉素)培养基中,在温度为37 ℃,5%CO2浓度的培养箱中孵育,细胞密度达80%~90% 进行传代。实验采用对数期长势良好的细胞。成球培 养基为DMEM/F12,含20 ng/mL EGF、20 ng/mL bFGF、20 mg/mL B27、 1%甲基纤维素。培养条件同前。 1.2.2 慢病毒干扰载体感染T24细胞
按分子 克隆技术制备靶向干扰MRPS5的载体PLKO.1-shMRPS5 及对照载体PLKO.1-shScramble,进行慢病毒包装后收集病毒液分装储存于-80 ℃。细胞分为PLKO.1-shMRPS5实验组及PLKO.1-shScramble对照组。感染前细胞接种于6孔板内,待融合度达40%时分别加病毒液感染16 h,再换液后继续培养。 1.2.3 Western blot检测
病毒感染72 h后裂解细胞提取总蛋白,煮沸变性后行SDS-PAGE电泳,湿转到NC膜,5%脱脂牛奶室温封闭2 h后,一抗4 ℃过夜,PBST洗涤,二抗室温孵育1 h,PBST洗涤后显影拍照。MRPS5表达用于检测病毒干扰效率。Nanog、Oct4、c-Myc、Sox2抗体用于反映肿瘤干性转录因子[13, 14]的表达。人膀胱癌及癌旁组织经裂解后检测MRPS5的差异表达。GAPDH作为内参。结果重复3次。 1.2.4 细胞增殖能力检测
分别收集感染近60 h的T24细胞,流式细胞仪计数(排除7-AAD阳性死细胞)后铺96孔板。每孔100 μL培养基,各含1 000个 活细胞。铺板后第2天起检测细胞活力(计为第1天)。 按照CellTiter-Blue Cell Viability Assay试剂说明操作。实验重复3次。 1.2.5 细胞周期检测
分别收集病毒感染72 h的细胞,PBS洗,70%乙醇4 ℃固定过夜,按照周期检测试剂说明行PI染色后流式488 nm波长检测。实验重复3次。 1.2.6 成球实验
感染72 h的T24细胞,经流式细胞仪计数(排除7-AAD阳性的死细胞)后铺超低黏附96孔板。每孔100 μL成球培养基,含10个活细胞,各铺10个复孔。静置培养14 d后倒置显微镜下观察成球率(每孔细胞球数目总和/每孔加入的细胞数×100%)及直径,并拍照。 1.2.7 小鼠体内成瘤实验
10只5周龄雄性NOD/SCID小鼠,体质量16~18 g,随机均分为PLKO.1-shMRPS5实验组及PLKO.1-shScramble对照组。将分别经病毒感染72 h后的T24细胞传代扩大培养后,分别用无菌PBS制成单细胞悬液并计数。实验组每只小鼠双侧背部皮下各注射5×106实验组细胞,对照组则注射相同数目对照组细胞。待小鼠皮下成瘤后,每2天记录移植瘤体积(肿瘤体积=短径2×长径×0.52),第6周末处死小鼠并取出移植瘤,拍照并称量。 1.3 统计学处理
计量资料以x±s表示,采用SPSS 13.0行两独立样本t检验。 2 结果 2.1 临床组织标本检测MRPS5差异表达
临床收集的12对膀胱癌及癌旁正常组织裂解提蛋白,行Western blot检测,结果显示(图 1),8对癌组织中(66.7%)MRPS5表达高于癌旁组织。
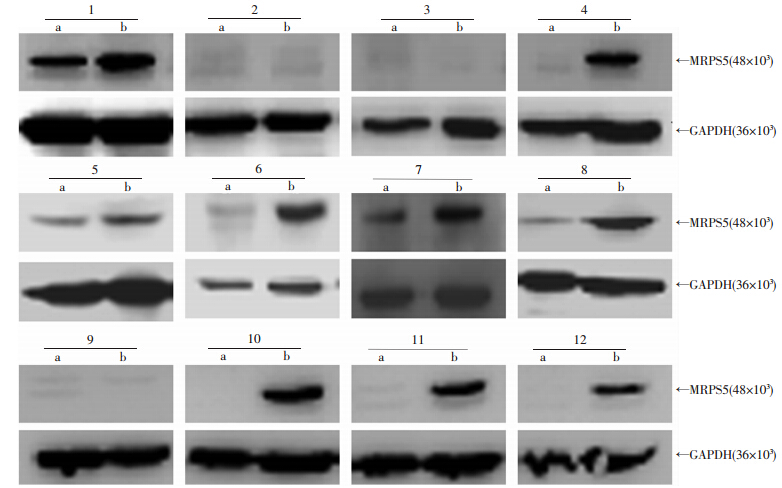 |
| a:膀胱癌癌旁正常组织;b:膀胱癌组织;1~12:12对膀胱癌及癌旁组织标本编号 图 1 Western blot检测12对膀胱癌及癌旁组织MRPS5表达 |
慢病毒PLKO.1-shMRPS5(实验组)感染T24细胞72 h后,Western blot检测MRPS5蛋白变化,与PLKO.1- shScramble(对照组)相比,MRPS5表达降低(图 2)。表明构建的干扰载体有效。
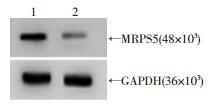 |
| 1:对照组;2:实验组 图 2 Western blot检测MRPS5的干扰效率 |
慢病毒PLKO.1-shMRPS5(实验组)及PLKO.1-shScramble(对照组)分别感染T24细胞60 h后,流式铺板,第2天起按试剂说明连续5 d检测细胞生长曲线,与对照组相比,干扰MRPS5后细胞增殖能力下降,差异具有统计学意义(P<0.05,P<0.01,图 3)。
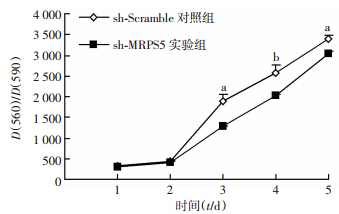 |
| a: P<0.01,b: P<0.05,与shMRPS5实验组比较 图 3 干扰MRPS5对T24细胞生长的影响 (x±s,n=5) |
慢病毒PLKO.1-shMRPS5及PLKO.1-shScramble分别感染T24细胞,72 h后收集细胞进行PI单染流式细胞术检测,结果显示干扰MRPS5后S期细胞明显增多(图 4),提示干扰MRPS5后细胞可阻滞于S期。
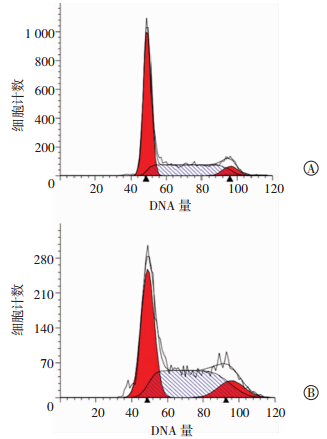 |
| A:PLKO.1-shScramble对照组;B:PLKO.1-shMRPS5实验组 图 4 流式细胞术检测干扰MRPS5对T24细胞周期的影响 |
PLKO.1-shMRPS5(实验组)及PLKO.1-shScramble (对照组)病毒分别感染T24细胞,行成球实验及Western blot检测。结果显示实验组平均成球率为(0.050±0.053),与对照组平均成球率(0.060±0.052)相比无统计学差异(P>0.05),但同高倍镜下实验组成球直径明显减小(图 5);同时,与肿瘤干细胞干性特征相关的部分转录因子Nanog、Oct4、c-Myc、Sox2表达也下调。由此可见,干扰MRPS5可以减弱T24中的干细胞的干性特征。
 |
| A:成球实验(倒置显微镜×200);B:Western blot检测干性转录因子表达 a:对照组;b:实验组 图 5 干扰MRPS5对T24细胞干性特征的影响 |
对照组及实验组小鼠均成瘤10个。对照组 瘤体平均体积[(0.784±0.278) cm3]大于实验组[(0.500± 0.245) cm3](P<0.05,图 6),且对照组瘤体平均质量[(0.862±0.372) g]较实验组[(0.412±0.248) g]大(P<0.05,图 6)。
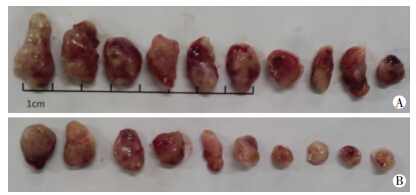 |
| A:对照组;B:实验组 图 6 干扰MRPS5对小鼠成瘤能力的影响大体观察 |
膀胱癌是最常见的泌尿系恶性肿瘤,其发生、发展机制十分复杂,主要涉及c-Myc、h-ras、EGFR等癌基因的激活,以及p21、p53、Rb、p16ink4a/p19ink4b等抑癌基因的失活[3, 15]。但最近研究发现除了经典的癌基因及抑癌基因,一些参与线粒体能量代谢的关键蛋白,如细胞色素B(Cytb)、丙酮酸脱氢酶激酶1(PDK1)、异柠檬酸脱氢酶1/2(IDH1/2)、延胡索酸水化酶(FH)、琥珀酸脱氢酶(SDH)等基因的突变也能参与正常细胞的恶性转化并促进肿瘤的发生发展[10, 16, 17, 18] 。
MRPS5作为线粒体核糖体蛋白28S小亚基成员,其主要作用是参与合成线粒体有氧呼吸链的部分蛋白,与机体能量代谢有关,因此几乎广泛分布于各组织器官。近期研究表明,MRPS5能调控线虫及小鼠的寿命,而机体的衰老与肿瘤发生易感性具有相关性[8]。并且已鉴定的多种寿命相关基因同时扮演着癌基因或抑癌基因的角色,这提示我们MRPS5可能参与肿瘤的发生、发展。本课题合作组成员前期发现在人肝癌组织中MRPS5表达明显高于正常组织,且本研究通过对12对人膀胱癌及癌旁组织MRPS5表达的检测也发现存在这种差异,提示MRPS5在膀胱癌发生、发展中起着重要作用。而针对MRPS5对某一肿瘤细胞生物学功能的研究较少,其是否影响膀胱癌细胞增殖、干性能力等也不清。本研究结果显示,慢病毒干扰载体PLKO.1-shMRPS5能显著降低MRPS5表达,且干扰MRPS5后膀胱癌T24细胞的增殖能力下降,其一方面机制可能是通过抑制细胞周期转换,使周期阻滞于S期。同时,干扰MRPS5不改变T24细胞平均成球率但减小成球体积,同时降低肿瘤干细胞相关转录因子Nanog、Oct4、c-Myc、Sox2的表达,而肿瘤干细胞理论认为肿瘤中存在一小群具自我更新和分化潜能的细胞,它们参与肿瘤的起始,生长,侵袭转移,复发等[14, 19]。因此提示MRPS5可影响膀胱癌细胞中的干细胞的干性能力,但遗憾的是尚没有可靠的分子标志以探讨MRPS5对T24中干细胞干性表型的影响。进一步通过NOD/SCID小鼠皮下成瘤实验证实干扰MRPS5能抑制小鼠的成瘤能力,使成瘤体积减小质量减少。综上可知MRPS5能促进膀胱癌细胞增殖能力及干性特征,可能在膀胱癌中扮演类似癌基因的角色。除此之外,我们也证实MRPS5并不影响T24细胞的迁移能力。从MRPS5作为线粒体代谢调控因子角度看,肿瘤作为代谢性疾病,其发生、发展与线粒体代谢性功能紊乱有关,而MRPS5功能突变只是部分事件,或许正是在肿瘤微环境的适应过程中MRPS5发生了这些功能性改变。有关MRPS5对膀胱癌细胞能量代谢如ATP、乳酸、活性氧的影响亟待深入研究,这将帮助我们了解MRPS5代谢性调控膀胱癌细胞功能的相关机制。
综上所述,本研究初步证实了MRPS5在膀胱癌细胞中的部分生物学作用,有关其更多功能及分子机制需后续进一步研究。这也许能为膀胱癌的诊断、治疗及预后提供可靠的分子标志。
| [1] | Feng C, Guan M, Ding Q, et al. Expression of pigment epithelium-derived factor in bladder tumour is correlated with interleukin-8 yet not with interleukin-1alpha [J]. J Huazhong Univ Sci Technolog Med Sci, 2011, 31(1): 21-25. |
| [2] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1): 11-30. |
| [3] | Dinney C P, McConkey D J, Millikan R E, et al. Focus on bladder cancer [J]. Cancer Cell, 2004, 6(2): 111-116. |
| [4] | Liu J Y, Qian D, He L R, et al. PinX1 suppresses bladder urothelial carcinoma cell proliferation via the inhibition of telomerase activity and p16/cyclin D1 pathway [J]. Mol Cancer, 2013, 12(1): 148. |
| [5] | Fu L, Liu N, Han Y, et al. ADAM10 regulates proliferation, invasion, and chemoresistance of bladder cancer cells [J]. Tumour Biol, 2014, 35(9): 9263-9268. |
| [6] | Deng C X. SIRT1, is it a tumor promoter or tumor suppressor? [J]. Int J Biol Sci, 2009, 5(2): 147-152. |
| [7] | Rahman S, Islam R. Mammalian Sirt1: insights on its biological functions [J]. Cell Commun Signal, 2011, 9:11. |
| [8] | Pinkston J M, Garigan D, Hansen M, et al. Mutations that increase the life span of C. elegans inhibit tumor growth[J]. Science, 2006, 313(5789): 971-975. |
| [9] | Pinkston-Gosse J, Kenyon C. DAF-16/FOXO targets genes that regulate tumor growth in Caenorhabditis elegans [J]. Nat Genet, 2007, 39(11): 1403-1409. |
| [10] | Dasgupta S, Hoque M O, Upadhyay S, et al. Mitochondrial cytochrome B gene mutation promotes tumor growth in bladder cancer [J]. Cancer Res, 2008, 68(3): 700-706. |
| [11] | Guney A I, Ergec D S, Tavukcu H H, et al. Detection of mitochondrial DNA mutations in nonmuscle invasive bladder cancer [J]. Genet Test Mol Biomarkers, 2012, 16(7): 672-678. |
| [12] | Ishikawa K, Takenaga K, Akimoto M, et al. ROS-generating mitochondrial DNA mutations can regulate tumor cell metastasis [J]. Science, 2008, 320(5876): 661-664. |
| [13] | Shan J, Shen J, Liu L, et al. Nanog regulates self-renewal of cancer stem cells through the insulin-like growth factor pathway in human hepatocellular carcinoma [J]. Hepatology, 2012, 56(3): 1004-1014. |
| [14] | Liu C, Liu L, Shan J, et al. Histone deacetylase 3 participates in self-renewal of liver cancer stem cells through histone modification [J]. Cancer Lett, 2013, 339(1): 60-69. |
| [15] | Varol N, Konac E, Onen I H, et al. The epigenetically regulated effects of Wnt antagonists on the expression of genes in the apoptosis pathway in human bladder cancer cell line (T24) [J]. DNA Cell Biol, 2014, 33(7): 408-417. |
| [16] | 童晶涛, 梁后杰, 陈建芳, 等. 丙酮酸脱氢酶激酶-1在人结肠癌中的表达及意义 [J]. 第三军医大学学报, 2010, 32(3): 257-260. |
| [17] | Dang C V, Hamaker M, Sun P, et al. Therapeutic targeting of cancer cell metabolism [J]. J Mol Med (Berl), 2011, 89(3): 205-212. |
| [18] | Yen K E, Bittinger M A, Su S M, et al. Cancer-associated IDH mutations: biomarker and therapeutic opportunities[J]. Oncogene, 2010, 29(49): 6409-6417. |
| [19] | 胡保全, 唐鹏, 齐晓伟, 等. 槐耳清膏对乳腺癌细胞系SUM-159细胞干性特征的影响 [J]. 第三军医大学学报, 2013, 35(11): 1107-1110. |



