溃疡性结肠炎(ulcerative colitis,UC)是一种原因尚不十分清楚的直肠与结肠慢性非特异性炎症性疾病,以迁延不愈、反复发作、病因不明为特征,其病因及发病机制迄今尚未完全明确,认为可能与遗传易感性、免疫调节紊乱、感染、环境以及结肠组织的炎症[1]等因素有关。肠三叶因子(intestinal trefoil factor,ITF)属三叶因子家族(trefoil factor family,TFF)肽,是一种肠黏膜保护因子,在肠黏膜的保护和修复中起重要作用,与UC的发病、预后有着密切的关系。本研究观察重组人小肠三叶因子(recombinated mutant of human intestinal trefoil factor,rhITF)对UC模型大鼠一般生理状态、结肠病理、疾病活动指数(disease activity index,DAI)评分、血清及结肠组织中转化生长因子-β1(transforming growth factor-β1,TGF-β1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)产生的影响,探讨其作用机制。
1 材料与方法 1.1 药物及试剂rhITF(大连联合博泰生物技术有限公司);美沙拉秦缓释颗粒剂(500 mg/袋),(国药准字11287);2-4-6三硝基苯磺酸 (trinitrobenzenesulfonic acid,TNBS),SIGMA公司中国代理;TRIzoL,Invitrogen公司中国代理;TGF-β1 ELISA试剂盒,Ameko公司中国代理; TNF-α ELISA试剂盒,Ameko公司中国代理。
1.2 方法 1.2.1 动物分组与模型建立SPF级SD雄性大鼠32只,鼠龄11~12周,体质量(200±20)g,由辽宁长生生物技术有限公司提供[合格证号SCXK(辽)2010-0001]。采用随机数字表法,将大鼠按体质量随机分为4组:正常组、模型组、美沙组、ITF组(n=8)。除正常组外各组大鼠造模采用TNBS造模方法[2, 3, 4],将大鼠经肛门按100 mg/kg灌入TNBS的50%乙醇溶液。正常组大鼠灌入等量的生理盐水。
1.2.2 给药方法按照文献[5]折算,60 kg人与200 g体质量大鼠折算比为6.25 ∶1,换算出每组大鼠灌胃药物的对应浓度:美沙组灌胃浓度为0.016 g/mL的美沙拉秦缓释颗粒剂溶液,ITF组灌胃浓度为0.05 mg/mL 的rhITF溶液;模型组,每日灌胃蒸馏水。各组实验大鼠从造模后第2天开始灌胃,早晚各1次,每次2 mL,共12 d。正常组,正常饲养,不进行灌胃。
1.2.3 DAI评分每日称量各组大鼠体质量,记录每组大鼠的大便性状,运用便隐血检测试纸(四甲基联苯胺法)对每组大鼠的粪便进行隐血检测。DAI为大鼠体质量下降分数,大鼠大便隐血分数,大鼠大便性状分数之总和(除以3)[6]。在实验进程的第1、4、8、12天对各组大鼠进行DAI评分。见表 1。
| 评分 | 大便性状 | 体质量下降(%) | 便血 |
| 0 | 正常 | 无 | 隐血试验阴性 |
| 1 | 软便 | 1~5 | 隐血试验阴性 |
| 2 | 软便 | 6~10 | 隐血试验阳性 |
| 3 | 腹泻 | 11~15 | 隐血试验阳性 |
| 4 | 腹泻 | >15 | 肉眼血便 |
实验总进程的第13天,各组大鼠用10%水合氯醛麻醉,开腹,拨开肠管、网膜找到腹主动脉,用头皮针刺入,取血约5 mL,每1 mL 血中加入抑肽酶10 μL,混匀,凉置2 h;再以3 000 r/min 离心(R=16 cm)10 min,取上部血清,装入EP管中。ELISA法检测大鼠血清及结肠组织中TGF-β1、TNF-α的含量,两项指标方法相同。大鼠取血后处死,无菌条件下打开大鼠腹腔,在肛门1 cm以上取4~6 cm病变肠管组织(或依病变部位而定),纵行剪开后,用生理盐水冲洗,操作动作尽量轻柔,防止因病变而致肠壁韧性变差的肠管脱落。用5%多聚甲醛固定,以病理切片观察各组大鼠肠黏膜的组织形态学变化。
1.3 统计学方法实验数据采用SPSS 17.0软件进行统计学处理,计量资料以x±s表示,组间比较采用单因素方差分析。
2 结果 2.1 一般情况与DAI评分正常组8只大鼠在实验进程13 d内反应灵活、食欲旺盛、无腹泻血便,体质量逐渐增加,各组大鼠均有不同程度精神萎靡、懒动、肉眼血丝便、体质量下降。第4天开始,ITF组内大鼠懒动、腹泻便血、体质量下降等症状减轻。第8天,ITF组大鼠症状较模型组病情明显好转、大鼠精神状态较好、体质量增加、腹泻便血症状减轻、食量增加。第12天,ITF组大鼠精神状态佳、活动度增加、饮食量增加、无肉眼血丝便、体质量增加。各组间大鼠DAI评分示意图。见表 2。
| (n=8,x±s) | ||||
| 组别 | 第1天 | 第4天 | 第8天 | 第12天 |
| 正常组 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| 模型组 | 2.29±0.33a | 2.38±0.60ab | 2.0±0.25ab | 2.17±0.53ab |
| 美沙组 | 2.58±0.24a | 1.88±0.53ab | 1.17±0.18ab | 0.96±0.33ab |
| ITF组 | 2.13±0.56a | 1.42±0.50a | 0.46±0.18a | 0.37±0.22a |
| a:P<0.01,与正常组比较;b:P<0.05,与ITF组比较 | ||||
正常组:结肠黏膜层,单层柱状上皮细胞排列整齐,可见到大量吸收细胞与杯状细胞,黏膜下层可见小动脉、静脉及淋巴管,肌层薄厚均匀无异常改变。见图 1A。模型组:结肠黏膜层,可见大量浸润的炎性细胞,杯状细胞基本消失,部分黏膜上皮脱落,形态、结构被破坏。见图 1B。美沙组:结肠形态、结构有所改善,可见黏膜层单层柱状上皮细胞有所恢复,吸收细胞与杯状细胞较少,黏膜下层仍可见大量浸润的炎性细胞。见图 1C。ITF组:结肠形态、结构有所恢复,可见黏膜层单层柱状上皮细胞、吸收细胞与杯状细胞排列较整齐,黏膜下层仍可见浸润的炎性细胞,黏膜肌层薄厚较均匀。见图 1D。
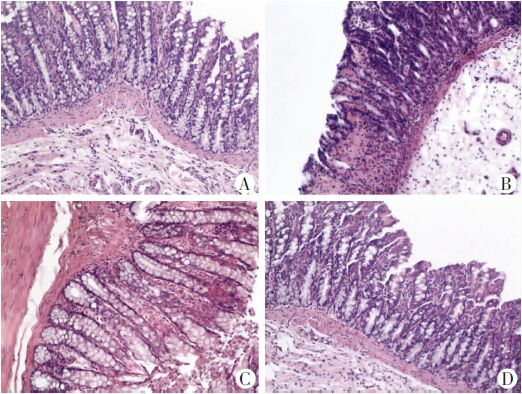
|
| A:正常组;B:模型组;C:美沙组;D:ITF组 图 1 不同干预后TNBS模型大鼠结肠组织病理变化(HE×100) |
血清、肠组织中TGF-β1含量:模型组最低,正常组最高;ITF组明显高于美沙组、模型组,与美沙组、模型组和正常组比较,均有显著性差异(P<0.05)。模型组与正常组比较,有显著性差异(P<0.05)。血清、肠组织中TNF-α含量:模型组最高,正常组最低;ITF组明显低于美沙组、模型组,与美沙组、模型组和正常组比较,均有显著性差异(P<0.05)。模型组与正常组比较,有显著性差异(P<0.05)。见表 3、4。
| (ng/L,n=8,x±s) | ||
| 组别 | TGF-β1 | TNF-α |
| 正常组 | 669.27±4.86a | 12.57±2.68a |
| 模型组 | 152.77±17.36ab | 145.27±5.58ab |
| 美沙组 | 352.26±38.61a | 56.12±2.03a |
| ITF组 | 414.07±54.24 | 44.89±2.54 |
| a:P<0.05,与ITF组比较;b:P<0.05,与正常组比较 | ||
| (ng/L,n=8,x±s) | ||
| 组别 | TGF-β1 | TNF-α |
| 正常组 | 674.97±8.59a | 8.45±2.12a |
| 模型组 | 151.19±11.72ab | 117.95±8.41ab |
| 美沙组 | 335.03±24.10a | 57.28±4.77a |
| ITF组 | 418.60±19.74 | 48.67±7.12 |
| a:P<0.05,与ITF组比较;b:P<0.05,与正常组比较 | ||
UC的发病可能是肠黏膜局部的免疫紊乱造成的,而促炎症性细胞因子增多和抗炎症性细胞因子减少是引起肠黏膜免疫反应异常和慢性炎症的主要原因。由于多种因素相互作用,导致体内免疫系统失调,细胞因子网络平衡破坏,大量炎症细胞活化并向炎症部位趋化募集,释放多种炎症因子,而引起肠组织的炎症反应[1]。
ITF作为一种新的胃肠黏膜保护因子,它既能与黏液糖蛋白结合成凝胶,增强黏膜防御功能,又可以促上皮细胞移动,加速损伤修复,保持肠黏膜完整,减轻免疫所致的肠道炎症反应。在UC急性期,炎症反应在体内迅速发生,而随着溃疡的不断愈合,血清中的抗炎因子TGF-β1、促炎因子TNF-α也随着升高和下调。TGF-β1是一种十分重要的抗炎症性细胞因子,通过下调过度的免疫反应而抑制炎症的发生与发展,对血管平滑肌细胞有促进增殖、抑制凋亡,能够促进创伤愈合和组织修复[7]。TNF-α 是主要的炎性启动因子,能刺激单核巨噬细胞和中性粒细胞等合成IL-1、IL-6、IL-8 等细胞因子[8],可以加强T细胞、B细胞的增殖和分化,促进中性粒细胞的聚集,影响机体内部慢性炎症的发生,其与UC肠黏膜损伤密切相关[9]。ITF能够激发TGF-β1的活性,减轻机体内部炎症的发生,抑制TNF-α 的活化,减少TNF-α与炎症细胞相互作用,从而减轻局部肠黏膜的炎症损伤,促进肠黏膜修复与溃疡愈合[10]。
本次研究显示,rhITF有明显的促进结肠溃疡愈合的作用,能够有效降低DAI评分,ITF组治疗后第4、8、12天分别为(1.75±0.59)、(0.83±0.31)、(0.59±0.30),为逐渐降低趋势;在经过治疗后,ITF组大鼠溃疡愈合程度良好,均优于其它组。ITF组大鼠血清、肠组织中TGF-β1含量为(414.07±54.24)、(418.60±19.74)ng/L,明显高于美沙组、模型组,与美沙组、模型组和正常组比较,均有显著性差异(P<0.05);ITF组大鼠血清、肠组织中TNF-α含量为(44.89±2.54)、(48.67±7.12)ng/L,明显低于美沙组、模型组,与美沙组、模型组和正常组比较,均有显著性差异(P<0.05)。表明rhITF能够上调抗炎因子TGF-β1、抑制促炎因子TNF-α 的水平。模型组大鼠血清中TGF-β1、TNF-α含量分别明显低于和高于正常组,表明TGF-β1、TNF-α为参与UC发病的重要细胞因子。
因此我们认为,rhITF可以显著改善UC大鼠症状,减轻UC大鼠模型受损肠组织的炎症反应,结直肠病灶、病理形态对比模型组均有明显改善,减轻炎症细胞浸润。表明rhITF对UC活动期有治疗作用,及抑制炎症进一步发展的作用。ITF作为胃肠黏膜的保护因子,可以通过调节大鼠血清和结肠组织中TGF-β1、TNF-α的水平,调节机体的免疫功能,抑制肠道炎症反应,促使损伤的肠组织修复愈合,而起到治疗UC的作用。
| [1] | Sanchez-Munoz F, Dominguez-Lopez A, Yamamoto-Furusho J K. Role of cytokines in inflammatory bowel disease[J]. World J Gastroenterol, 2008, 14(27): 4280-4288. |
| [2] | Peterson T C, Peterson M R, Raoul J M. The effect of pentoxifylline and its metabolite-1 on inflammation and fibrosis in the TNBS model of colitis[J]. Eur J Pharmacol, 2011, 662(1/3): 47-54. |
| [3] | 侯丽娟, 唐方, 王晓红, 等. 溃疡性结肠炎模型的建立及影响因素[J]. 世界华人消化杂志, 2011, 19(31): 3242-3245. |
| [4] | 靳迺诗, 董志, 傅洁民, 等. 阿格列汀治疗三硝基苯磺酸诱导的溃疡性结肠炎小鼠的实验研究[J]. 第三军医大学学报, 2011, 33(16): 1722-1725. |
| [5] | 丁虹. 实验药理学[M]. 北京: 科学出版社, 2008: 73. |
| [6] | 王坤, 宣秀敏, 王莲, 等. 溃疡性结肠炎大鼠外周血CD4+ CD25+ Treg的变化及相关性研究[J]. 安徽医科大学学报, 2012, 47(3): 354-356. |
| [7] | Chen Y, Xiao Y, Ge W, et al. miR-200b inhibits TGF-beta1-induced epithelial-mesenchymal transition and promotes growth of intestinal epithelial cells[J]. Cell Death Dis, 2013, 4: e541. |
| [8] | 贾媛媛, 高晓唯, 田艳明, 等. MyD88 依赖性NF-κB信号途径改变对家兔PVR模型玻璃体内TNF-α变化的影响[J]. 眼科新进展, 2010, 30(10): 933-936. |
| [9] | Ghilardi N, Ouyang W. Targeting the development and effector functions of TH17 cells[J]. Semin Immunol, 2007, 19(6): 383-393. |
| [10] | 杜立阳, 陈铭诗, 刘清芳, 等. 复方青黛颗粒对溃疡性结肠炎大鼠NF-κB P65、TNF-α表达的影响[J]. 世界华人消化杂志, 2011, 19(12): 1290-1294. |



