2 421001 湖南 衡阳,湖南环境生物职业技术学院检验教研室
2 Department of Biochemistry, Hunan Institute of Environmental Biology, Hengyang, Hunan Province, 421001, China
间充质干细胞(mesenchymal stem cell,MSC)具有免疫原性低、肿瘤趋向性和靶向迁移能力等诸多优势,使其在肿瘤的临床治疗研究中受到越来越多的关注。然而,MSC应用于肿瘤治疗的安全性问题仍存在争议,并且MSC与肿瘤细胞间的相互作用关系亦不明确[1, 2]。Zhu等[3]以及Shinagawa等[4]将人骨髓来源的间充质干细胞(BD-MSC)与结肠癌细胞共同注射至动物模型皮下形成移植瘤,均发现BD-MSC对结肠癌的生长发挥促进作用。但是,Ohlsson等[5]通过将MSC与鼠结肠癌细胞H1D2共同注射至大鼠皮下,却观察到MSC对鼠结肠癌的生长具有抑制作用。换言之,MSC对结肠癌的发生、发展是促进还是抑制作用尚无定论。本研究通过体外条件下BD-MSC与结肠癌细胞系HT29共培养后,检测HT29细胞在增殖和迁移能力的变化,体内条件下BD-MSC与HT29共同注射动物模型皮下,观察成瘤情况,研究BD-MSC对结肠癌细胞的影响以及其中可能的机制,为BD-MSC在肿瘤临床治疗研究提供实验依据。 1 材料与方法 1.1 实验材料
骨髓来源间充质干细胞由南华大学外总教研室分离培养;人结肠癌细胞系HT29购自中科院上海细胞所;低糖α-MEM培养液、DMEM高糖培养液、DMEM/F12培养液、人重组表皮成长因子(EGF)、人重组碱性成纤维生长因子(bFGF)、B27、胎牛血清、胰酶及相关培养试剂均购自Gibco公司;CCK-8试剂盒购自碧云天公司;Transwell小室购自Millipore公司;引物设计由南京金斯瑞公司完成;RNA提取试剂盒和Real-time PCR试剂均购自TaKaRa公司;所用抗体:CD105、CD90、CD34、CD45、E-Cadherin、Twist1和Twist2购自BD公司,N-Cadherin、Vimentin和Fibronectin购自Cell Signaling Technology公司,Snail1、Snail2和GAPDH购自Sant Cruz公司。二氧化碳培养箱购自Thermo公司;实时荧光定量PCR仪购自Bio-Rad公司;倒置显微镜购自Olympus公司;流式细胞仪购自BD公司。 1.2 方法 1.2.1 细胞培养人骨髓来源间充质干细胞
培养于7.5%胎牛血清的低糖α-MEM培养液,人结肠癌细胞系HT29培养于10%胎牛血清的DMEM高糖培养液中,置于温度为37 ℃ ,5% CO2浓度的培养箱中孵育,待细胞成长度达到70%~80%进行相关实验或胰酶消化传代。
Transwell双室细胞共培养时,将结肠癌细胞系HT29用胰酶消化并制备为单细胞悬液,按照每孔1×105个细胞接种于Transwell小室(0.4 μm孔径,BD falcon)的下室。将间充质干细胞制备为单细胞悬液,按照每孔1×105个细胞接种于Transwell小室的上室。上、下室各加入2 mL的干细胞培养液,两种细胞共培养48 h后,获取细胞用于实验。 1.2.2 Transwell迁移实验
HT29的对照组和共培养组细胞各5×104个细胞计数至200 μL无血清的DMEM培养液中。将Transwell小室置于含20%胎牛血清的DMEM培养液的24孔板内并向上室中加入重悬的细胞悬液。每组设置3个复孔。常规培养24 h后,PBS洗涤Transwell小室3遍,清洗后置于4%的多聚甲醛中固定30 min,PBS洗涤3遍,加入0.1%的结晶紫染色约30 min,用棉签擦去上室细胞后用清水洗涤,将Transwell小室随机取5个视野拍照,使用拍照软件进行细胞数分析。 1.2.3 CCK-8法细胞增殖实验
HT29的对照组和共培养组细胞各2×103个细胞计数至96孔板中,每组设3个复孔,按照CCK-8试剂盒说明书操作,使用酶标 仪分别于0、24、48、72 h后检测光密度值[D(450)]。 实验重复3次,以X轴为时间、Y轴为对应时间点的D(450)值,作增殖曲线。 1.2.4 克隆形成实验
通过流式细胞仪分别分选出200个HT29细胞的对照组和共培养组细胞,加入24孔板中,每组设3个复孔。常规培养2周后终止培养。每孔加入4%的多聚甲醛将细胞固定,30 min后PBS洗去多聚甲醛,每孔加入500 μL结晶紫染色液,细胞染色30 min后于烘箱中将24孔板干燥。在显微镜计数每组细胞的克隆形成数、拍照并统计。克隆形成率=(克隆形成数/接种细胞数)×100%。 1.2.5 成球实验
根据以往文献[6]报道,在非贴的24孔板中每孔添加500 μL含有10 ng/mL EGF、10 ng/mL bFGF、20 mg/mL B27的无血清DMEM/F12成球培养液,每孔通过流式细胞仪计数100个细胞,每组各做3个复孔的重复,再放入培养箱培养,在培养过程必须添加少许DMEM/F12培液,2周后在倒置显微镜下,对每孔细胞球的成球情况进行记录和分析。成球率=(细胞球数/加入的细胞总数)×100%。 1.2.6 体内成瘤实验
6只5周龄雌性裸鼠购自南华大学实验动物中心,按照动物实验伦理准则进行实验。通过流式细胞仪计数,对照组为1×105个未经处理的HT29细胞;实验组为5×104个BD-MSCs细胞和5×104个HT29细胞共同混合制备单细胞悬液。每只1×105个细胞分别注射至裸鼠皮下,每组注射3只裸鼠。每5天观察并记录移植瘤体积。肿瘤体积=瘤体长(L)×瘤体宽的平方(W2)/2。在第4周末处死裸鼠并取出移植瘤。 1.2.7 荧光定量PCR检测
取HT29的对照组和共培养组细胞,按照totalRNA提取试剂盒(TaKaRa)和cDNA反转试剂盒(Fermantas)的说明,进行totalRNA的提取并反转为cDNA。加入SYBR Green试剂(TaKaRa)进行荧光定量PCR反应,通过对荧光定量PCR溶解曲线的分析,验证无非特异性扩增后,2-△△Ct法计算各基因相对GAPDH的相对表达水平。相关基因的引物序列见表 1。
基因 | 引物序列(5′→3′) | 片段长 度(bp) |
| E-Cadherin | 正义链:TGCCCAGAAAATGAAAAAGG | 200 |
| 反义链:GTGTATGTGGCAATGCGTTC | ||
| N-Cadherin | 正义链:ACAGTGGCCACCTACAAAGG | 201 |
| 反义链:CCGAGATGGGGTTGATAATG | ||
| VVimetin | 正义链:GAGAACTTTGCCGTTGAAGC | 163 |
| 反义链:GCTTCCTGTAGGTGGCAATC | ||
| Fibronectin | 正义链:CAGTGGGAGACCTCGAGAAG | 168 |
| 反义链:TCCCTCGGAACATCAGAAAC | ||
| Snail1 | 正义链:CACTATGCCGCGCTCTTTC | 113 |
| 反义链:GGTCGTAGGGCTGCTGGAA | ||
| Snail2 | 正义链:AAACTACAGCGAACTGGACACA | 203 |
| 反义链:GCCCCAAAGATGAGGAGTATC | ||
| Twist1 | 正义链:AGTCCGCAGTCTTACGAGGA | 161 |
| 反义链:GCCAGCTTGAGGGTCTGAAT | ||
| Twist2 | 正义链:CAAGCTGAGCAAGATCCAGAC | 97 |
| 反义链:GGTCATCTTATTGTCCATCTCG | ||
| GAPDH | 正义链:ACCCACTCCTCCACCTTTGA | 110 |
| 反义链:TCCACCACCCTGTTGCTGTA |
将对照组和BD-MSCs共培养组细胞提取蛋白。细胞离心后加入蛋白裂解液,将细胞裂解物进行BCA定量后使用。每孔按照50 μg 目的总蛋白样品进行上样,SDS-PAGE电泳后湿转法转移到PVDF膜上。含5%的脱脂奶粉的PBST孵育封闭2 h,加入稀释好的一抗孵育过夜,PBST洗涤3次,加入对应的二抗孵育2 h,PBST洗涤后,凝胶成像仪采集图像,并使用图像软件Image J 2x进行条带灰度值分析。 1.3 统计学处理
每组实验均重复至少3次,采用SPSS 16.0统计软件进行单因素方差分析,2组间比较采用两独立样本t检验。 2 结果 2.1 BD-MSCs与结肠癌细胞系HT29共培养
流式细胞仪检测BD-MSCs表面抗原的阳性率,其中CD105和CD90的阳性率分别为93.5%及99.1%,而CD34和CD45的阳性率均为0.1%(图 1)。在对 BD-MSCs鉴定完成后,将BD-MSCs与结肠癌细胞系HT29共培养48 h,倒置显微镜观察细胞形态:BD-MSCs 呈现成纤维样细胞形态(图 2A);普通培养条件下的HT29细胞呈现扁圆的上皮样细胞形态(图 2B);结肠癌细胞系HT29在与BD-MSCs共培养后,细胞形态由上皮样向间质样细胞形态转变(图 2C)。
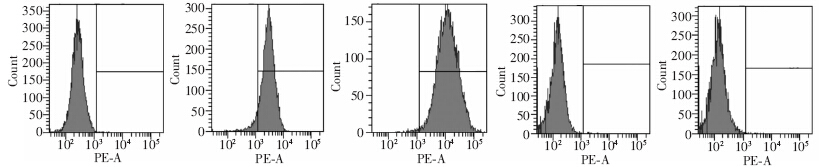 |
| A:IgG;B:CD105;C:CD90;D:CD34;E:CD45图 1 流式细胞仪检测BD-MSCs表明抗原的阳性率变化 |
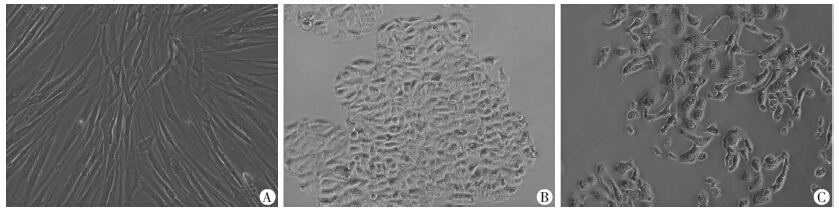 |
| A:骨髓来源间充质干细胞;B:普通培养条件下HT29细胞;C:共培养后HT29细胞形态图 2 倒置显微镜观察间充质干细胞与结肠癌细胞系HT29共培养后的细胞形态变化(×40) |
利用Transwell迁移实验检测HT29细胞在与BD-MSCs 共培养后迁移能力的变化。对照组细胞穿过Transwell小室的细胞数为(81.6±15.74)/视野(图 3A),而共培养组细胞穿过Transwell小室的细胞数为(259.6±19.23)/视野(图 3B)。相对于对照组,共培养组细胞的迁移能力显著增强(P<0.01),说明BD-MSCs可促进HT29细胞的迁移能力。
 |
| A:对照组;B:共培养组 图 3 Transwell实验检测2组HT29细胞的迁移能力(结晶紫×20) |
与对照组细胞相比,HT29细胞在与BD-MSCs共培养72 h后,共培养组细胞的增殖能力显著增强(P<0.05,图 4),说明BD-MSCs可促进HT29细胞的增殖能力。
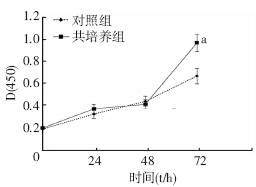 |
| a:P<0.05,与对照组相比图 4 CCK-8法检测对照组与共培养组细胞增殖能力 |
对照组细胞的克隆形成率为[(15.33±2.87)%],而BD-MSCs共培养组细胞的克隆形成率为[(37± 2.94)%]。两者比较差异有统计学意义(P<0.05,图 5)。
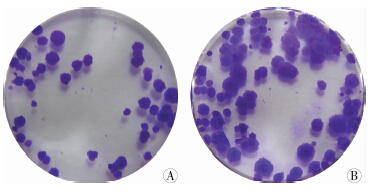 |
| A: 对照组;B: 共培养组图 5 两组细胞克隆形成实验结果(结晶紫) |
HT29细胞的BD-MSCs共培养组细胞所成球的体积是显著大于对照组细胞(图 6),对照组细胞的成球率为[(10.33±2.62)%],BD-MSCs共培养组细胞的成球率为[(31±3.27)%],两者比较差异有统计学意义(P<0.05)。
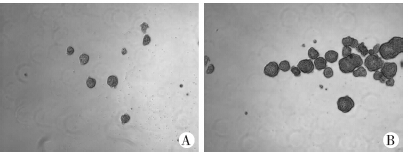 |
| A: 对照组;B: 共培养组 图 6 两组细胞成球实验结果(倒置显微镜×40) |
与BD-MSCs共同注射的实验组所成肿瘤的体积显著大于对照组(图 7)。并且两组间细胞所成肿瘤的 重量也是具有显著差异的[(1.73±0.62)g vs (0.54± 0.81)g,P<0.05]。说明在体内条件下,BD-MSCs促进HT29细胞的成瘤能力。
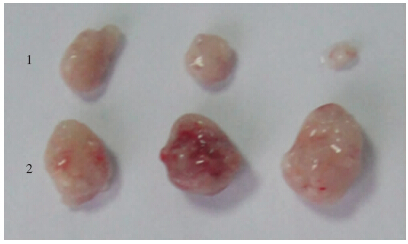 |
| 1:HT29对照组;2:HT29与BM-MSCs共注射组 图 7 各组裸鼠皮下成瘤大体观察 |
为了探究BD-MSCs促进HT29细胞增殖和迁移能力的作用机制,从转录水平和翻译水平分别检测了对 照组和共培养组细胞中EMT相关的标记物E-Cadherin、 N-Cadherin、Vimentin、Fibronectin、Snail1、Snail2、Twist1和Twist2的表达情况。实验结果发现,与对照组细胞相比,与BD-MSCs共培养的HT29细胞中在mRNA和蛋白水平均发现:上皮样标记物E-Cadherin出现显著下调表达,而间质样标记物Vimentin和Twist1则显著上调表达(图 8)。这些结果说明了,骨髓来源的间充质干细胞促进结肠癌细胞的增殖与迁移能力是通过上皮-间质转化来完成的。
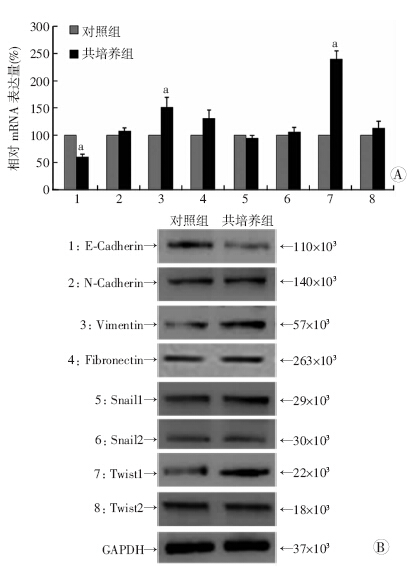 |
| A:RT-PCR检测结果 a:P<0.05,与对照组相比;B:Western blot检测结果图 8 RT-PCR与Western blot检测EMT相关标记物的表达 |
MSCs属于多潜能干细胞,存在于多种正常组织中,包括脂肪组织,骨髓和肝脏[7]。MSCs在特定的培养条件下可以分化成脂肪细胞、骨、神经、心肌、内皮细胞等多种组织细胞,可用于衰老和病变引起的组织器官损伤修复[8]。已有大量研究表明了MSCs与肿瘤之间的相关性,但是二者间的相互作用是促进还是抑制仍然存在争议[9]。
MSCs在结肠癌中的作用,早期文献[10]的报道主要认为是促进作用,但是也有研究者例如Ohlsson等[5]认为MSCs在结肠癌中发挥的是抑制作用。由于 MSCs在体内注射途径、输注剂量及次数、输注时机等诸多影响因素,导致可能得出完全不同的研究结果。首先,为了探究MSCs在结肠癌中的确切作用,本研究通过Transwell迁移实验发现HT29细胞在与BD-MSCs共培养后的迁移能力是显著增强的,这说明BD-MSCs对结肠癌的侵袭转移是具有促进作用的。CCK-8增殖实验、克隆形成、成球实验和裸鼠体内成瘤实验证明了与BD-MSCs共培养后的HT29细胞具有更强的增殖能力。同时,在HT29细胞与BD-MSCs共培养后,通过形态学的观察,我们发现HT29细胞呈现出上皮-间质转化特征。
上皮-间质转化EMT被报道称其参与了肿瘤的发生、发展,在肿瘤的侵袭转移过程中也发挥了极其重要的作用,EMT导致了肿瘤细胞的表型变化并增加了侵袭能力[11]。E-cadherin的下调被认为是EMT这一过程的关键事件,以及目前是EMT的最可靠的标记物[12]。同时,间质特征的蛋白水平的表达会随之增加,例如,锌指蛋白家族(Snail1、Snail2、ZEB1)[13],螺旋-环-螺旋家族(bHLH )成员Twist1和 Twist2[14]。波形蛋白(Vimentin)、纤维连接蛋白(Fibronectin)以及细胞外基质重塑酶(matrix metallo proteinases),并伴随着肌动蛋白的改变,细胞骨架发生重组[15]。
基于以上研究表明,我们探究骨髓来源的间充质干细胞促进结肠癌细胞的增殖与迁移能力的可能机制,我们从转录水平和翻译水平分别检测了对照组和共培养组细胞中EMT相关的标记物的表达情况。实验结果发现,与对照组细胞相比,与BD-MSCs共培养的HT29细胞中上皮样标记物E-Cadherin出现显著下调表达,而间质样标记物Vimentin和Twist1则显著上调表达。这些结果说明了,BD-MSCs促进HT29细胞的增殖与迁移能力是通过EMT来完成的。
诸多研究者利用MSCs作为载体,对其进行基因修饰,使其作用肿瘤细胞,造成肿瘤杀伤效果。但是,MSCs作为肿瘤治疗载体的同时,存在促进肿瘤发展和迁移的隐患,这使其在临床应用中的发展受到了限制。本研究通过比较结直肠癌细胞HT29与BD-MSCs共培养前后生物学活性的变化,发现BD-MSCs促进HT29细胞的增殖和迁移能力,并且阐明了EMT在其中发挥的作用机制。作为肿瘤微环境中的重要因子,MSCs可通过分泌多种细胞因子,例如:TGF-β1、IL-6、FGF2、CCL5等激活胞内Wnt、PI3K/Akt、JAK2/STAT3等信号通路的传导,从而影响肿瘤细胞的命运[9]。这些细胞因子以及信号通路又是如何调控结直肠癌细胞EMT,将是我们接下来工作的重点。
| [1] | Huang W H, Chang M C, Tsai K S, et al. Mesenchymal stem cells promote growth and angiogenesis of tumors in mice[J]. Oncogene, 2013, 32(37): 4343-4354. |
| [2] | Qiao L, Xu Z, Zhao T, et al. Suppression of tumorigenesis by human mesenchymal stem cells in a hepatoma model[J]. Cell Res, 2008, 18(4): 500-507. |
| [3] | Zhu W, Xu W, Jiang R, et al. Mesenchymal stem cells derived from bone marrow favor tumor cell growth in vivo[J]. Exp Mol Pathol, 2006, 80(3): 267-274. |
| [4] | Shinagawa K, Kitadai Y, Tanaka M, et al. Mesenchymal stem cells enhance growth and metastasis of colon cancer[J]. Int J Cancer, 2010, 127(10): 2323-2333. |
| [5] | Ohlsson L B, Varas L, Kjellman C, et al. Mesenchymal progenitor cell-mediated inhibition of tumor growth in vivo and in vitro in gelatin matrix[J]. Exp Mol Pathol, 2003, 75(3): 248-255. |
| [6] | 朱传琳, 姚超, 钱程, 等. 应用Lv-pNanog-GFP慢病毒载体探讨Nanog在调控结直肠癌细胞的自我更新与转移能力中的作用[J]. 第三军医大学学报, 2014, 36(1): 29-32. |
| [7] | Tian L L, Yue W, Zhu F, et al. Human mesenchymal stem cells play a dual role on tumor cell growth in vitro and in vivo[J]. J Cell Physiol, 2011, 226(7): 1860-1867. |
| [8] | Le-Blanc K, Frassoni F, Ball L, et al. Mesenchymal stem cells for treatment of steroid-resistant, severe, acute graft-versus-host disease: a phase II study[J]. Lancet, 2008, 371(9624): 1579-1586. |
| [9] | 庞一琳, 张斌, 陈虎. 间充质干细胞与肿瘤细胞相互作用: 促进还是抑制[J]. 中华细胞与干细胞杂志: 电子版, 2013, 3(1): 30-37. |
| [10] | Lin J T, Wang J Y, Chen M K, et al. Colon cancer mesenchymal stem cells modulate the tumorigenicity of colon cancer through interleukin 6[J]. Exp Cell Res, 2013, 319(14): 2216-2229. |
| [11] | Nieto M A. Epithelial-Mesenchymal Transitions in development and disease: old views and new perspectives[J]. Int J Dev Biol, 2009, 53(8/10): 1541-1547. |
| [12] | Lim J, Thiery J P. Epithelial-mesenchymal transitions: insights from development[J]. Development, 2012, 139(19): 3471-3486. |
| [13] | de-Herreros A G, Peiro S, Nassour M, et al. Snail family regulation and epithelial mesenchymal transitions in breast cancer progression[J]. J Mammary Gland Biol Neoplasia, 2010, 15(2): 135-147. |
| [14] | Lander R, Nordin K, LaBonne C. The F-box protein Ppa is a common regulator of core EMT factors Twist, Snail, Slug, and Sip1[J]. J Cell Biol, 2011, 194(1): 17-25. |
| [15] | Roussos E T, Keckesova Z, Haley J D, et al. AACR special conference on epithelial-mesenchymal transition and cancer progression and treatment[J]. Cancer Res, 2010, 70(19): 7360-7364. |



