肺癌是世界上发病率和死亡率较高的一种恶性肿瘤,分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中非小细胞肺癌发病率较高,占80%左右。Wnt(wingless-type MMTV integration site family)信号通路是调控细胞增殖和癌变的关键途径[1]。 Wnt信号通路的异常激活与肺癌的发生、发展密切相关,其核心分子β-catenin与核内转录因子T细胞因子(TCF)/淋巴细胞增强因子(LEF)结合是经典WNT信号通路传导的关键事件[2]。T细胞因子3(T cell factor 3,TCF-3)是TCF/LEF家族中的重要成员,是经典Wnt信号通路的最终效应分子,其在肺癌中的研究甚少。本实验采用50例非小细胞肺癌组织标本及其正常癌旁对照,5种人非小细胞肺癌细胞系,2种正常人支气管上皮细胞系,检测TCF-3在非小细胞肺癌中的表达情况,从而为以Wnt通路为靶点的肺癌分子靶向治疗提供依据。 1 材料与方法 1.1 材料
50例非小细胞肺癌标本及其正常癌旁对照组织来自重庆医科大学附属第一医院2011-2012年胸外科手术切除的原发性非小细胞肺癌组织,术前未接受过放疗化疗。患者平均年龄60(39~81)岁,男性 ∶女性比例7 ∶5,按WHO肺癌分类标准,鳞癌19例,腺癌29例,腺鳞癌2例。组织分化程度,高分化18例,中低分化30例,依据国际抗癌联盟(UICC)2009版肺癌P-TNM分期标准:Ⅰ、Ⅱ期27例,Ⅲ、Ⅳ期21例。
5株非小细胞细胞系分别为人肺鳞癌细胞系NCI-H226,NCI-H520,SK-MES-1;人肺腺癌细胞系A549;人大细胞肺癌细胞系NCI-H460。2株人正常支气管上皮细胞系HBE、BEP-2D作为正常对照。细胞均用含10%胎牛血清的1640培养基,于含0.5%CO2的37 ℃孵箱内培养。
TCF-3抗体购自Cell Signaling Technology(CST),免疫组化超敏型二步法试剂盒、DAB酶底物显色试剂盒购自北京中杉金桥生物技术公司,TRIzol 裂解液、反转录试剂盒及实时荧光定量PCR试剂盒均购自日本TaKaRa公司。引物设计与合成由上海生物工程公司提供。 1.2 免疫组化
标本经10%中性福尔马林液固定、石蜡包埋,以4 μm 厚度连续切片,60 ℃烘片后,常规二甲苯脱蜡,梯度乙醇复水,柠檬酸缓冲液高压修复抗原,3%双氧水封闭内源性过氧化物酶活性,滴加一抗TCF-3(1 ∶100稀释),继以免疫组化超敏二步法,DAB染色,苏木精复染,中性树脂封片。
结果判定[3, 4, 5, 6]:阳性细胞百分比计分按视野内阳性细胞所占总细胞数的比例计分,≤5%,6%~25%、26%~50%、51%~75%、>75%分别记分为0、1、2、3、4分。着色强度记分:按阳性细胞着色,无为0分、 弱(淡黄)为1分、中(黄色)为2分、强(棕黄)为3分。 结果判定:每张切片随机选取5个高倍视野(10×40倍),镜下视野清晰,无出血、坏死。每个视野均进行阳性细胞百分比记分与着色强度记分,上述两种记分结果相乘:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。 1.3 实时荧光定量PCR
传代细胞在培养瓶(25 cm2大小)中长至70%~80%左右,用PBS清洗2次,到掉多余的水分,加入1 mL TRIzol试剂,提取细胞总RNA,具体操作按说明书进行。使用核酸测定仪检测样本总RNA浓度,所有样品的D(260)/D(280)比值均需在1.8~2.0之间。利用反转录试剂盒得到cDNA,实时荧光定量PCR引物序列分别为:TCF-3上游引物5′-GCGGTCCTCTGAAATGGTT-3′,下游引物5′-TCTGGGATTGTGAAGGGATG-3′。具体操作按说明书要求进行。 1.4 Western blot
蛋白裂解液分别提取7种处于对数期生长的细胞总蛋白,用BCA法测定蛋白浓度。按4 ∶1体积加入5× 上样Buffer后热变形蛋白,每个蛋白样品上样60 μg进行10%SDS-PAGE凝胶电泳、转膜、5%脱脂奶粉封闭2 h,加一抗TCF-3(1 ∶1 000稀释)于4 ℃孵育过夜,TBST洗10 min×5次,加二抗于室温孵育1 h,再TBST洗10 min×4次,化学发光液发光,蛋白凝胶成像仪曝光成像。 1.5 统计学方法
采用SPSS statistics 17.0软件分析,实验结果以x±s表示,采用卡方检验、t检验进行统计分析。检验水准α=0.05。 2 结果 2.1 TCF-3在肺癌组织及癌旁正常组织中的表达
TCF-3在肺癌细胞中表达,表达率为48%(24/50),细胞核与细胞浆同表达,细胞核表达为主,正常癌旁组织中未见表达(图 1)。鳞癌中表达率为36.84%(7/19),腺癌中表达率为51.72%(15/29),采用卡方检验进行分析P=1.02>0.05,差异无统计学意义,说明TCF-3在肺腺癌和鳞癌中表达无差异。TCF-3蛋白在肺癌中的表达水平与患者性别、肿瘤分级分期、吸烟情况以及有无淋巴结转移无关(P>0.05,表 1)。
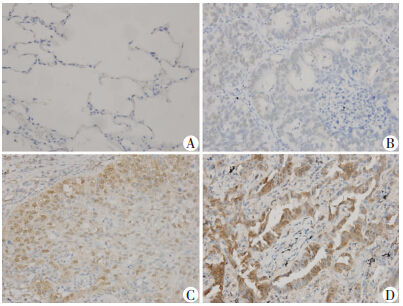 |
| A:TCF-3在癌旁组织中不表达,呈阴性(-);B~D:依次为TCF-3在肺癌组织中表达,呈弱阳性(+)、阳性(+ +)、强阳性(+ + +) 图 1 免疫组化观察TCF-3在肺癌组织及癌旁正常组织中的表达(S-P×400) |
| 临床特征 | 例数 | 阴性 | 阳性 | 阳性率(%) | χ2 | P值 |
| 性别 | ||||||
| 男 | 28 | 16 | 12 | 42.86 | 0.24 | 0.62 |
| 女 | 20 | 10 | 10 | 50.00 | ||
| 组织学类型 | ||||||
| 腺癌 | 29 | 14 | 15 | 51.72 | 1.02 | 0.31 |
| 鳞癌 | 19 | 12 | 7 | 36.84 | ||
| 分级 | ||||||
| 中低分化 | 30 | 18 | 12 | 40.00 | 1.10 | 0.30 |
| 高分化 | 18 | 8 | 10 | 55.56 | ||
| 分期 | ||||||
| Ⅰ、Ⅱ期 | 27 | 16 | 11 | 40.74 | 0.65 | 0.422 |
| Ⅲ、Ⅳ期 | 21 | 10 | 11 | 52.38 | ||
| 淋巴结转移 | ||||||
| 有 | 28 | 18 | 10 | 35.71 | 2.77 | 0.10 |
| 无 | 20 | 8 | 12 | 60.00 | ||
| 吸烟情况 | ||||||
| 吸 | 26 | 14 | 12 | 46.15 | 0.002 | 0.96 |
| 否 | 22 | 12 | 10 | 45.45 | ||
7种细胞株分别进行3次荧光定量PCR,每次均设3个复孔,3复孔差异在1个Ct值之间,以GAPDH作为内参校正每个样本的循环阈值Ct,得到ΔCt,以正常支气管上皮细胞BEP-2D作为对照,目的基因的相对表达量以2-△△Ct表示,TCF-3 mRNA水平在HBE为(0.97±0.15)倍,在A549为(1.24±0.50)倍,SK-MES-1为(0.09±0.02)倍(P<0.05),H226为(1.78± 0.79)倍,H520为(1.45±0.60)倍,H460为(0.09±0.02)倍(P<0.05,图 2)。
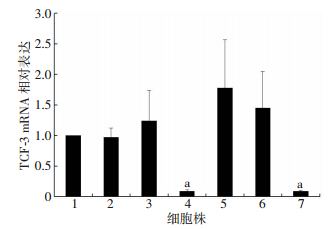 |
| 1: BEP-2D; 2: HBE; 3: A549; 4:SK-MES-1; 5: H226; 6: H520; 7: H460 a:P<0.01,与其余各细胞株比较 图 2 实时荧光定量PCR检测TCF-3 mRNA在各细胞株中的表达水平 |
采用Quantity One分析Western blot结果,如图 3所示TCF-3在A549、BEP-2D、HBE、H520中表达。在BEP-2D、HBE中表达水平较高;在H520、A549中居中;而在H226、SK-MES-1、H460中未见表达。
 |
| 1: A549;2: BEP-2D; 3:SK-MES-1; 4: H226;5: H520; 6: H460;7: HBE 图 3 Western blot检测TCF-3在各细胞株中的表达 |
Wnt信号通路是存在于机体中的一条基本信号通路,其对细胞增殖、分化的调控是通过其核内转录因子TCF/LEF 激活一系列靶基因的转录来实现的,而其异常激活参与了多种肿瘤的发病过程。转录因子TCF/LEF家族包括TCF-1、TCF-3、TCF-4以及LEF。TCF/LEF是经典Wnt通路下游的重要效应分子,具备双向调节功能,当缺乏Wnt号刺激时,细胞内β-catenin与Axin/GSK-3β/APC形成复合物被降解,TCF/LEF与转录抑制因子CBP、Grouch及CtBP等相互作用,抑制靶基因的转录。然而当Wnt路激活时,大量游离的β-catenin进入核内与之结合,导致Wnt靶基因的转录,从而调控细胞的增殖与分化[7]。目前研究表明,Wnt通路可能参与肺癌的发生、发展[8],探讨Wnt通路中的关键核转录因子TCF/LEF的表达及作用具有重要的意义。TCF-3是Wnt通路下游核转录因子之一,目前国内外尚少见TCF-3在肺癌中表达的报道。
鉴于以上原因,本实验首先采用50例临床非小细胞肺癌标本及其正常癌旁组织作为对照,采用免疫组化检测TCF-3在肺癌组织水平的表达情况,我们发现TCF-3在肺癌组织中有表达,表达率48%(24/50),而在正常癌旁组织中未见表达。24例阳性表达TCF-3的肺癌标本中细胞核与细胞质同表达占22例,且以细胞核表达为主。经统计分析表明,TCF-3表达情况与患者性别、肿瘤的组织学类型、分级分期、吸烟情况以及有无淋巴结转移无关(P>0.05)。由此我们初步证实TCF-3在肺癌组织中表达。
为进一步研究TCF-3在非小细胞肺癌中的表达及丰度情况,本实验选取5种非小细胞肺癌细胞系,以及2种正常人支气管上皮细胞系,采用荧光定量PCR技 术及Western blot,分别从mRNA和蛋白水平检测 TCF-3在细胞系中的表达情况。实验发现,TCF-3 mRNA 水平在各胞系之间表达不一致。在肺鳞癌H226与H520中表达最高;在肺腺癌A549表达水平稍低于鳞癌;在正常人支气管上皮细胞系HBE和BEP-2D中也出现表达;在肺鳞癌SK-MES-1细胞及大细胞肺癌H460中表达最低。实验还发现,在同一种组织学类型的细胞系中TCF-3的表达水平也不一致,如在H226、H520中mRNA水平明显高于SK-MES-1,差异有统计学意义(P<0.05)。
根据Western blot 检测发现,TCF-3在7种细胞中蛋白表达水平不同,在正常人支气管上皮细胞BEP-2D中表达最高,HBE其次,H520及A549居中,在H226、SK-MES-1、H460中未见表达,与mRNA表达水平不太符合,可能与基因转录效率、蛋白翻译后修饰及半衰期等有关[9]。
通过本实验,我们发现TCF-3在肺癌组织中及肺癌细胞系中有表达,同时我们发现TCF3在正常支气管上皮细胞中亦有表达,且在各胞系之间的表达水平并不一致,初步了解了TCF-3在肺癌中的表达分布情况。TCF-3是Wnt通路下游的核转录因子,既往研究认为TCF-3通过与β-catenin结合,起到促进Wnt通路下游靶蛋白的表达,从而发挥Wnt通路调控细胞增殖 及凋亡的作用。然而最新研究发现,TCF-3可能是通过竞争性抑制TCF-4与β-catenin结合起到下调Wnt通路靶蛋白表达的作用[10],因此,TCF-3在肺癌发病中的作用尚不明确。结合免疫组化结果,我们发现TCF-3在部分肺癌组织中表达,而在癌旁细胞中无表达,提示TCF-3可能起到促进肺癌发生的作用,然而细胞系中的结果与上述结果相反,肺癌细胞系中TCF-3蛋白表达量低于正常支气管上皮细胞中TCF-3蛋白表达,提示TCF-3可能参与抑制肺癌的发生。因此,如何解释TCF-3的表达与肺癌的发生、发展是否均有相关性及何种相关性,需要通过小分子RNA干扰TCF-3表达或通过过表达TCF-3以进一步研究。
| [1] | Luo W, Lin S C. Axin: a master scaffold for multiple signaling pathways[J]. Neurosignals, 2004, 13(3): 99- 113. |
| [2] | Shapiro L. beta-catenin and its multiple partners: promiscuity explained[J]. Nat Struct Biol, 200l, 8(6): 484-487. |
| [3] | Jacobs T W, Gown A M, Yaziji H, et al. Comparison of fluorescence in situ hybridization and immunohistochemistry for the evaluation of HER-2/neu in breast cancer[J]. J Clin Oncol, 1999, 17(7): 1974-1982. |
| [4] | 张愚, 屈文东, 黄华, 等. bFGF及TGF-β1在实验性肝硬化中的免疫组化研究[J].胃肠病学和肝病学杂志, 2005, 14(1): 40-44. |
| [5] | 于萍, 步宏, 王华, 等. 免疫组化结果的图像分析与人工计数方法的对比研究[J].生物医学工程学杂志, 2003, 20(2): 288-290. |
| [6] | 徐洪, 杨方, 袁媛, 等. 免疫组织化学Image Pro Plus图像半定量分析的参数选择[J].解剖学杂志, 2012, 35(1): 37-41. |
| [7] | Saito-Diaz K, Chen T W, Wang X, et al. The way Wnt works: components and mechanism [J].Growth Factors, 2013, 31(1): 1-31. |
| [8] | Uematsu K, He B, You L, et al. Activation of the Wnt pathway in non small cell lung cancer: evidence of disheveled overexpression [J]. Oncogene, 2013, 22(46): 7218-7221. |
| [9] | 潘佳忻, 张志文. 翻译调控——联系基因组学和蛋白质组学的有效手段[J]. 生物学通报, 2003, 38(3): 18-19. |
| [10] | Solberg N, Machon O, Machonova O, et al. Mouse Tcf3 represses canonical Wnt signaling by either competing for β-catenin binding or through occupation of DNA-binding sites[J]. Mol Cell Biochem, 2012, 365(1/2): 53-63. |



