泌尿系统感染是最常见的院内感染,且有研究表明尿路感染和尿管的使用相关,尿管的使用时间越长,感染的概率越大[1, 2]。长期使用的尿管易于细菌附着,形成生物膜,成为尿路感染的感染源,细菌一旦形成生物膜便高度耐药,并且可以逃避免疫系统的攻击,使感染慢性化,迁延难愈[3]。头孢他啶是临床感染治疗常用的β-内酰胺类抗菌药物,本课题组前期的研究[4]发现头孢他啶可以抑制大肠埃希菌MG1655生物膜的形成。因头孢他啶代谢时主要经肾以高度活性的原形药物随尿液排泄,而其是否可以抑制尿管内临床分离大肠埃希菌生物膜的形成尚少见报道。因此本研究拟以临床尿管内分离的大肠埃希菌为研究对象,观察亚抑菌浓度头孢他啶对尿管附着的大肠埃希菌的粘附和细菌生物膜的形成,以期为头孢他啶在临床尿路感染的预防使用和临床抗菌药物的合理使用方案提供理论依据。 1 材料与方法 1.1 实验材料 1.1.1 菌株来源
15株大肠埃希菌(E1~E15)均分离自2012年12月至2013年12月西南医院住院患者的98份尿管标本。大肠埃希菌实验室菌株MG1655和质控菌株ATCC25922均为西南医院国家药物临床试验机构保存菌株。 1.1.2 抗菌药物
阿米卡星、氨曲南、氨苄西林、环丙沙星、左旋氧氟沙星、庆大霉素、妥布霉素、头孢他啶、头孢哌酮、头孢噻肟、头孢吡肟、亚胺培南、美洛培南和哌拉西林购自中国食品药品检定研究院。头孢他啶、头孢他啶/克拉维酸、头孢噻肟、头孢噻肟/克拉维酸药敏纸片购自英国Oxoid公司。 1.1.3 试剂及设备
血琼脂平板(重庆庞通医疗器械有限公司),MH培养基(北京陆桥生物技术有限公司),胰蛋白胨、酵母提取物(英国Oxoid公司);VITEK-2全自动细菌分析仪(法国生物梅里埃公司),酶标仪(美国MD公司),多点接种仪(日本佐久间公司)。 1.2 实验方法 1.2.1 菌株的分离和鉴定
收集患者使用3 d以上的尿管,无菌操作剪开尿管,在尿管的中上部用无菌棉签擦刮尿管壁后送检,按照标准检验操作程序,鉴定采用法国梅里埃API鉴定系统和生化方法。鉴定后收集大肠埃希菌存-80 ℃备用。 1.2.2 细菌最低抑菌浓度(MIC)和超广谱β-内酰胺酶(extended spectrum beta-lactamases,ESBLs)的测定
采用标准琼脂平板倍比稀释法测定MIC值。大肠埃希菌划线接种于血琼脂平板,37 ℃培养18 h。挑取单菌落接种于10 mL LB培养基,37 ℃、200 r/min培养过夜。用无菌生理盐水稀释菌液至0.5麦氏单位(约108 CFU/mL),以多点接种仪将1~2 μL菌液接种至含不同浓度抗菌药物的M-H琼脂平板,每个接种点的含菌量约105 CFU/mL。37 ℃孵育18 h后判断结果,以能完全抑制细菌生长的最低药物浓度为MIC。ESBLs检测同时用头孢他啶和头孢他啶/克拉维酸(CAZ/CLAV,30 μg/10 μg)以及头孢噻肟和头孢噻肟/克拉维酸(CTX/CLAV,30 μg/10 μg)的双纸片抑制法。大肠埃希菌ATCC25922作为药敏标准株,结果判读均根据CLSI标准。 1.2.3 生长曲线的测定
将大肠埃希菌过夜培养物用LB培养基稀释1 000倍。每个菌株均分为空白对照组、头孢他啶组和头孢噻肟组。空白对照组每孔加入500 μL菌液和500 μL LB培养基;头孢他啶和头孢噻肟处理组每孔分别加入500 μL菌液和500 μL抗生素,使其药物终浓度为1/4 MIC。每个样本做3个复孔。然后将24孔板放入全波段酶标仪中,在波长600 nm条件下测定其生长曲线。每2小时测定1次读数,测定周期为24 h。 1.2.4 细菌粘附能力的检测
采用菌落计数法。将大肠埃希菌过夜培养物稀释至0.5麦氏单位,再用LB肉汤稀释100倍。实验分为空白对照组、头孢他啶组和头孢噻肟组。空白对照组在CLSM培养皿中加入1 mL菌液和1 mL LB培养基。头孢他啶和头孢噻肟处理组分别加入1 mL菌液和1 mL抗生素,使其药物终浓度为1/4 MIC。37 ℃孵育4 h后,用无菌的PBS缓冲液轻柔冲洗2次,去除浮游菌。然后将PBS缓冲液加入培养皿中超声10 min,以使粘附的细胞脱落。最后将细胞悬浮液稀释至适当浓度后,取100 μL菌液涂布于LB固体培养基上,37 ℃培养24 h后计数。每个样本设置3个平行组,实验重复3次。 1.2.5 细菌生物膜形成能力的检测
参照文献[4]采用96孔板结晶紫染色法。LB平板转大肠埃希菌过夜活化,挑单菌落于10 mL LB肉汤摇菌约18 h,以比浊法稀释至0.5麦氏单位,再用LB肉汤稀释100倍。每个菌株均分为空白对照组、头孢他啶组和头孢噻肟组(终浓度均为1/4 MIC),每组设置3个复孔,37 ℃ 孵育24 h。小心吸取培养液,以每孔200 μL PBS缓冲液轻柔冲洗2次,置于通风阴凉处倒置风干固定。固定24 h后,以每孔200 μL 1%结晶紫溶液染色10 min,移除结晶紫溶液,并以流水冲洗至空白对照孔肉眼未见明显颜色,再次倒置于通风阴凉处进行风干。风干后每孔加入100 μL 30 %冰醋酸溶液充分溶解染色液,酶标仪590 nm波长处测定光密度值[D(590)]。根据前期实验结果和文献[4]报道,选择1/4 MIC为本实验的浓度。 1.3 统计学分析
细菌粘附和生物膜形成的数据均以x±s表示,细菌粘附和生物膜形成的差异采用SPSS 10.0统计软件行t检验。 2 结果 2.1 细菌MIC和ESBLs测定
抗菌药物对15株临床分离大肠埃希菌的MIC结果如表 1所示。大肠埃希菌对阿米卡星、氨曲南、氨苄西林、环丙沙星、左旋氧氟沙星、庆大霉素、妥布霉素、头孢他啶、头孢哌酮、头孢噻肟、头孢吡肟、亚胺培南、美洛培南、哌拉西林的耐药率分别为0%、 46.7%、73.3%、46.7%、46.7%、40.0%、46.7%、33.3%、73.3%、 73.3%、53.3%、0%、0%、73.3%。大肠埃希菌ESBLs阳性检出率为73.3%(11/15)。
| 抗菌药物 | E1 | E2 | E3 | E4 | E5 | E6 | E7 | E8 | E9 | E10 | E11 | E12 | E13 | E14 | E15 |
| 阿米卡星 | 8 | 2 | 4 | 8 | 16 | 1 | 8 | 4 | 2 | 2 | 16 | 8 | 4 | 32 | 4 |
| 氨曲南 | 64 | 4 | 16 | 16 | 32 | 2 | 16 | 16 | 4 | 2 | 128 | 64 | >256 | 128 | 256 |
| 氨苄西林 | 32 | 2 | 128 | >256 | 64 | 16 | 32 | 128 | 2 | 4 | >256 | 256 | >256 | 128 | >256 |
| 环丙沙星 | 0.5 | <0.25 | 8 | 4 | 1 | 0.25 | 0.5 | 8 | <0.25 | <0.25 | 16 | <0.25 | 32 | 8 | 32 |
| 左旋氧氟沙星 | 1 | <0.25 | 16 | 8 | 2 | 0.5 | 1 | 16 | 0.5 | <0.25 | 32 | 0.5 | 64 | 16 | 64 |
| 庆大霉素 | 2 | <0.25 | 64 | 32 | 16 | 0.5 | 2 | 0.5 | <0.25 | 0.25 | 32 | 2 | 64 | 64 | 4 |
| 妥布霉素 | 2 | <0.25 | 64 | 32 | 16 | 0.5 | 2 | 0.5 | <0.25 | 0.25 | 32 | 2 | 64 | 64 | 16 |
| 头孢他啶 | 4 | 1 | 8 | 2 | 4 | 4 | 8 | 8 | 2 | 2 | 256 | 128 | >256 | 128 | >256 |
| 头孢哌酮 | 128 | 8 | 256 | >256 | 128 | 16 | 128 | 256 | 8 | 8 | >256 | >256 | >256 | 256 | >256 |
| 头孢噻肟 | 256 | 8 | 256 | >256 | 128 | 4 | 256 | >256 | 8 | 4 | >256 | >256 | >256 | 256 | >256 |
| 头孢吡肟 | 128 | 4 | 64 | 256 | 8 | 4 | 16 | 16 | 4 | 8 | 128 | 64 | 256 | 128 | >256 |
| 亚胺培南 | 2 | <0.25 | 1 | 0.5 | 1 | <0.25 | 2 | 0.25 | <0.25 | <0.25 | 0.5 | 2 | 1 | 4 | 2 |
| 美洛培南 | 2 | <0.25 | 1 | 1 | 1 | <0.25 | 2 | 0.5 | <0.25 | <0.25 | 1 | 4 | 2 | 4 | 2 |
| 哌拉西林 | 256 | 8 | 128 | >256 | 256 | 8 | 128 | >256 | 4 | 16 | 256 | >256 | 256 | >256 | >256 |
1/4MIC头孢他啶和头孢噻肟对大肠埃希菌生长的影响结果显示,在0~24 h的12个观察时间点,1/4 MIC头孢他啶和头孢噻肟对16株大肠埃希菌生长均无明显影响。 2.3 细菌粘附能力的测定
1/4 MIC头孢他啶和头孢噻肟对大肠埃希菌粘附性的影响如表 2所示。 头孢他啶组粘附细胞数显著低 于空白对照组(P<0.05),减低比例为25.7%~ 68.5%。而头孢噻肟组粘附细胞数和空白对照组相比差异无统计学意义(P>0.05)。
| 菌株 | 空白对照组 | 头孢他啶组 | 头孢噻肟组 |
| E1 | 1.27±0.13 | 0.56±0.14a | 1.18±0.11 |
| E2 | 1.13±0.09 | 0.54±0.08a | 1.20±0.15 |
| E3 | 1.69±0.17 | 0.76±0.12a | 1.74±0.07 |
| E4 | 1.43±0.11 | 0.45±0.08a | 1.46±0.07 |
| E5 | 1.17±0.11 | 0.62±0.09a | 1.05±0.12 |
| E6 | 0.95±0.11 | 0.54±0.11a | 0.87±0.11 |
| E7 | 1.36±0.11 | 0.65±0.09a | 1.24±0.14 |
| E8 | 1.11±0.11 | 0.43±0.05a | 1.21±0.17 |
| E9 | 0.83±0.09 | 0.45±0.08a | 0.85±0.11 |
| E10 | 0.93±0.09 | 0.47±0.07a | 0.86±0.08 |
| E11 | 1.52±0.09 | 1.04±0.11a | 1.33±0.13 |
| E12 | 1.28±0.09 | 0.56±0.07a | 1.18±0.11 |
| E13 | 1.17±0.08 | 0.53±0.09a | 1.14±0.12 |
| E14 | 1.16±0.12 | 0.63±0.11a | 1.10±0.17 |
| E15 | 1.26±0.12 | 0.53±0.10a | 1.19±0.16 |
| MG1655 | 1.13±0.04 | 0.84±0.12a | 1.06±0.11 |
| a:P<0.05,与空白对照组比较 | |||
1/4 MIC头孢他啶和头孢噻肟对大肠埃希菌生物膜形成的影响如图 1所示。1/4 MIC头孢他啶对大肠埃希菌生物膜形成均有抑制作用,生物膜形成能力降低8.7%~58.0%。除了大肠埃希菌E11和E15差异不显著外(P>0.05),亚抑菌浓度头孢他啶对其他14株菌的生物膜均有显著的抑制效果(P<0.05)。而1/4 MIC头孢噻肟对16株大肠埃希菌的生物膜形成均无明显作用(P>0.05)。
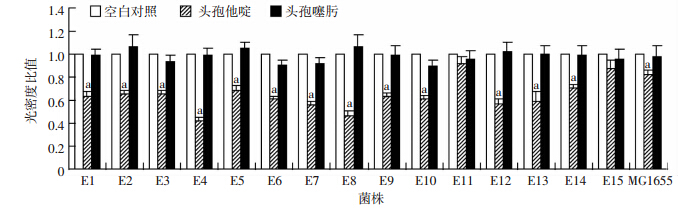 |
| a: P<0.05,与空白对照比较 图 1 亚抑菌浓度头孢他啶对大肠埃希菌生物膜形成的影响 |
细菌生物膜是细菌粘附于生物或非生物表面形成的具有立体结构的多细胞群落,细菌生物膜是细菌对外界不利环境所产生的一种自我保护机制,细菌形成生物膜后可通过生物膜的屏障作用等多种机制抵制外界不利环境的影响,一旦外界环境适应细菌生长,细菌生物膜可以释放出游离细菌。而研究表明临床的感染85%是由生物膜导致的,尤其是在内置医疗植入物、尿管和气管插管等医疗器械上形成生物膜后,可使感染慢性化,给临床治疗带来极大困难[3]。
尿管是临床最常见的侵入性操作,也是导致医院感染的重要病因。在留置尿管导致的尿路感染中,大肠埃希菌是尿路感染的最常见致病菌[5, 6, 7]。本研究中大肠埃希菌的阳性率为15.3%(15/98),略低于文献[7, 8]报道的尿管留置患者大肠埃希菌感染率为30%左右的结论。本研究结果显示,大肠埃希菌对青霉素类和头孢类抗菌药物具有较高的耐药性,而对阿米卡星、亚胺培南和美洛培南全部敏感,因此治疗大肠埃希菌相关的尿路感染应根据药敏结果和患者的临床情况合理选用抗菌药物。而本研究检测的ESBLs的阳性率为73.3%,高于同时期内医院分离大肠埃希菌ESBLs阳性率,其原因可能为部分患者使用了抗菌药物,且由于菌株的差异,感染的大肠埃希菌可能并未附着于尿管,检查过程中我们仅擦刮了尿管的一部分,也可能出现漏检的情况。尿管壁有大肠埃希菌附着,说明尿管可能成为泌尿感染的感染源。
根据文献报道和我们前期的实验结果,1/2MIC抗菌药物对细菌的生长有影响,我们将抗菌药物的浓度定为1/4MIC,并且未发现在此浓度条件下对细菌的生长有抑制作用,且1/4MIC头孢噻肟对细菌生物膜无明显作用,而1/4MIC头孢他啶在不影响细菌生长的条件下,可以抑制细菌的初始粘附和细菌生物膜形成,结果提示头孢他啶对生物膜的影响可能是多方面的,但对不同菌株粘附和生物膜的形成的影响不同,且差异较大。有研究发现亚抑菌浓度的抗菌药物对不同菌株生物膜的作用不同[9, 10],表现为抑制和诱导等不同的效应,而本研究只发现了头孢他啶对细菌生物膜的抑制作用,并未发现其诱导作用,研究提示头孢他啶可能成为预防泌尿系统感染的抗菌药物。有研究提示抗菌药物可以作为细菌之间信息传递的信号分子[11],头孢他啶可以通过抑制铜绿假单胞菌群体感应系统抑制细菌生物膜的形成[12],铜绿假单胞菌和大肠埃希菌具有相似的群体感应系统,我们推测头孢他啶对大肠埃希菌生物膜的抑制可能是通过抑制群体感应系统后,导致胞外多糖减少所致[13]。但本研究细菌的来源单一、数目较少,且没有进行深入的机制研究和相关的动物实验,尚需进一步研究证实。
| [1] | Hug B L, Fluckiger U, Widmer A F. Nosocomial urinary tract infection in adults[J]. Internist (Berl), 2006, 47(11): 1151-1162. |
| [2] | Stickler D J. Bacterial biofilms and the encrustation of urethral catheters[J]. Biofouling, 1996, 9(4): 293-305. |
| [3] | Costerton J W, Stewart P S, Greenberg E P. Bacterial biofilms: a common cause of persistent infections[J]. Science, 1999, 284(5418): 1318-1322. |
| [4] | Shi H Q, Sun F J, Chen J H, et al. Opposite effects of cefoperazone and ceftazidime on S-ribosylhomocysteine lyase/autoinducer-2 quorum sensing and biofilm formation by an Escherichia coli clinical isolate[J]. Mol Med Rep, 2014, 10(5): 2334-2340. |
| [5] | Wang Q, Sun F J, Liu Y, et al. Enhancement of biofilm formation by subinhibitory concentrations of macrolides in icaADBC-positive and -negative clinical isolates of Staphylococcus epidermidis[J]. Antimicrob Agents Chemother, 2010, 54(6): 2707-2711. |
| [6] | Ksycki M F, Namias N. Nosocomial urinary tract infection[J]. Surg Clin North Am, 2009, 89(2): 475-481, ix-x. |
| [7] | 曹弟勇, 徐彬,陈大斌. 尿路感染的病原菌分布特征及耐药性检测分析[J]. 中国实验诊断学, 2010,14(8): 1262-1264. |
| [8] | 巫娜, 荣桂芳. 留置导尿管致泌尿系感染的相关因素分析[J]. 中国医药指南, 2011, 9(32): 29, 31. |
| [9] | 杨学军. 留置导尿管致尿路感染的菌群分布及药敏结果分析[J]. 中国误诊学杂志, 2002, 2(9): 1347-1348. |
| [10] | Kaplan J B. Antibiotic-induced biofilm formation [J]. Int J Artif Organs, 2011, 34(9): 737-751. |
| [11] | Fajardo A, Martinez J L. Antibiotics as signals that trigger specific bacterial responses[J]. Curr Opin Microbiol, 2008, 11(2): 161-167. |
| [12] | Skindersoe M E, Alhede M, Phipps R, et al. Effects of antibiotics on quorum sensing in Pseudomonas aeruginosa [J]. Antimicrob Agents Chemother, 2008, 52(10): 3648-3663. |
| [13] | 邱春华, 王静, 刘玉敏. 330株铜绿假单胞菌耐药情况分析[J]. 第三军医大学学报, 2014, 36(15): 1613, 1618. |



