脊髓缺血再灌注损伤(spinal cord ischemic-reperfusion injury,SCIRI)表现为脊髓功能进行性的且发展迅速的丧失,是脊柱手术和动脉瘤等手术后患者严重致残和死亡的重要原因。目前SCIRI尚无有效干预措施,疗效亦欠佳。右美托咪定(dexmedetomidine,DEX)具有镇静、镇痛、抗焦虑、利尿等作用,近年来广泛应用于临床麻醉[1, 2, 3]。研究发现,DEX作为α2受体激动剂具有多器官保护作用[4, 5, 6, 7],涉及心、脑和肾脏多个器官。Bell等[8, 9]在一项DEX对脊髓缺血再灌注损伤研究中发现DEX对SCIRI也具有保护作用,但其机制尚不清楚。本研究主要探讨DEX对SCIRI的作用及其机制,旨在为SCIRI的防治策略及机制的研究提供参考。 1 材料与方法 1.1 实验动物与试剂
健康成年SD大鼠96只(雌雄不限),体质量(200±20)g,由重庆医科大学实验动物中心提供。盐酸右美托咪定注射液(200 μg:2 mL;江苏恒瑞医药股份有限公司,批号13122432),盐酸育亨宾(西安天宝生物科技有限公司,批号TB20140121),兔源Bcl-2多克隆抗体(Proteintech生物公司,货号12789-1-AP),兔源Bax多克隆抗体(Proteintech生物公司,货号50599-2-lg),兔源Caspase3多克隆抗体(Proteintech生物公司,货号19677-1-AP),辣根过氧化物酶标记山羊抗兔IgG(碧云天生物技术研究所进口分装,编号A0208),TUNEL试剂盒(美国Roche公司)。 1.2 大鼠脊髓缺血再灌注模型制作
根据改良Zivin法[10, 11]建立脊髓缺血再灌注模型,按大鼠体质量腹腔注射10%水合氯醛0.4 mL/100 g 麻醉,头皮针尾静脉穿刺置管,将大鼠仰卧位固定,腹部常规脱毛后消毒,然后沿腹白线剖开腹腔,将肠管向左推,分离暴露出腹主动脉并仔细辨认双侧肾动脉,在左、右肾动脉之间穿线后,以无创动脉夹阻断腹主动脉,缺血45 min后松夹恢复血液灌注,最后逐层关闭腹腔并腹腔注射5万U青霉素,术中用烤灯维持肛温36 ℃左右,术后常规饲养。模型成功标准:①缺血:腹主动脉阻断部位以下的动脉搏动消失,大鼠后肢苍白;②再灌注:松开动脉夹后,大鼠后肢转为红润;③大鼠能正常进食,前肢功能正常,双后肢瘫痪,伴不同程度的大小便功能障碍。 1.3 实验分组与处理
将96只SD大鼠按随机数字表法分为4组(n=24):①假手术组(S组):只行手术操作,不阻断腹主动脉。经尾静脉缓慢注射生理盐水3 mL/kg 5 min后再以3 mL/(kg·h)连续泵注120 min;②缺血再灌注组(IR组):经尾静脉缓慢注射生理盐水3 mL/kg 5 min后阻断腹主动 脉,并再以生理盐水3 mL/(kg·h)连续泵注120 min;③缺血再灌注右美托咪定组(DEX组):经尾静脉缓慢注射DEX 3 μg/kg 5 min后阻断腹主动脉,并再以DEX 3 μg/(kg·h)连续泵注120 min;④缺 血再灌注右美托咪定+育亨宾组(DY组):经尾静脉缓慢注射DEX 3 μg/kg+育亨宾3 μg/kg 5 min后阻断腹主动脉,并再以DEX 3 μg/(kg·h)+育亨宾3 μg/(kg·h)连续泵注120 min。
每组分为再灌注后12、24、48、72 h 4个亚组(n=6),各组大鼠均于上述各时间点在麻醉下断头处死,采用后部正中切口,分离取出脊髓L2~L6节段。L2~L3节段留做Westren blot检测,L4~L6以4%多聚甲醛固定,脱水,包埋,切片备检。 1.4 观察指标 1.4.1 大鼠运动功能评分
对每组大鼠采用Basso 的BBB评分法[12]分别在缺血再灌注后12、24、48、72 h 对大鼠后肢运动功能评分。 1.4.2 脊髓组织病理学改变
HE染色并于光镜下观察比较各组脊髓组织病理学改变。光镜下正常脊髓神经元清晰,呈现多极性,核仁清楚,可见清晰的树突与轴突,无水肿出血,未见中性粒细胞浸润等。神经元损伤则表现为不同程度细胞肿胀,周围间隙增宽出血,空泡形成,中性粒细胞浸润等。根据文献[13]计 数正常神经元和损伤神经元,计算运动神经元异常率= 每张切片的异常运动神经元数/该切片中运动神经元总数×100%。 1.4.3 细胞凋亡率检测
采用TUNEL法检测细胞凋亡率,即凋亡细胞占神经细胞总数的百分比。 将石蜡切片二甲苯脱蜡梯度酒精水化,PBS冲洗,蛋白酶K 37 ℃消化30 min,PBS冲洗,玻片干后滴加50 μL TUNEL反应混合液(50 μL脱氧核糖核苷酸转移酶+450 μL荧光素标记的dUTP)并在暗湿盒37 ℃反应1 h,PBS冲洗,玻片干后滴加50 μL标记荧光素抗体的HRP 37 ℃孵育30 min,PBS冲洗后DAB显色,苏木精复染、脱水、中性树脂封片。 1.4.4 免疫组化检测Bcl-2、Bax表达
将石蜡切片常规脱蜡水化,沸水修复抗原,PBS冲洗,滴加正常山羊血清封闭液室温20 min,滴加一抗Bcl-2、Bax兔源多克隆抗体室温静置1 h,PBS冲洗,滴加二抗辣根过氧化物酶标记山羊抗兔IgG室温静置1 h,PBS冲洗,DAB显色5~10 min,PBS冲洗后,苏木精复染、脱水、中性树脂封片。 1.4.5 Western blot检测Caspase3表达
将L2~L3段脊髓放入2 mL EP管中并加入2粒钢珠和1 mL裂解液RIPA(含PI),放入研磨仪中(70 Hz,2 min,4次)后冰上静置15 min,离心机离心并挑除沉淀,使用BCA法测量蛋白浓度后取30 μg蛋白变性,配制12%SDS-PDGE胶加样与蛋白Marker,加样后的胶置入电泳仪(120 V,1.5 h)跑胶,电泳仪中转膜(90 V,3 h),将硝酸纤维素膜取出放入5%脱脂牛奶中封闭1 h,加入一抗兔源Caspase3多克隆抗体5 μL并置入摇床4 ℃过夜,加入5%脱脂牛奶5 mL和1.7 μL二抗辣根过氧化物酶标记山羊抗兔IgG并置入摇床室温2 h,加入HRP酶促化学发光底物液,最后通过胶片显影观察结果。 1.5 统计学处理
采用SPSS 19.0统计软件,数据以x±s表示,两组间比较采用两独立样本均数t验,多组间两两比较用LSD-t检验。 2 结果 2.1 各组大鼠各时间点的BBB评分
各组大鼠术后12、24、48、72 h BBB评分见表 1。各时间点与S组比较,IR组、DEX组和DY组BBB评分明显降低(P<0.01),其中DEX组>DY组>IR组,各组间差异具有统计学意义(P<0.05)。
| 组别 | 12 h | 24 h | 48 h | 72 h |
| S组 | 21.0±0.0 | 21.0±0.0 | 21.0±0.0 | 21.0±0.0 |
| IR组 | 12.7±0.8a | 12.2±0.8a | 11.8±0.4a | 13.2±0.8a |
| DEX组 | 17.2±0.8ab | 16.3±0.5ab | 15.5±0.5ab | 16.3±0.5ab |
| DY组 | 14.2±0.8abc | 13.7±0.5abc | 13.3±0.5abc | 14.5±0.5abc |
| a: P<0.01,与S组比较;b: P<0.05,与IR组比较;c: P<0.05,与DEX组比较 | ||||
光镜下见S组脊髓前角神经元清晰,呈现多极性,核仁清楚,可见清晰的树突与轴突,无水肿出血,未见中性粒细胞浸润等。IR组神经元肿胀明显,神经元周围间隙增加,可见较多的神经元坏死,空泡形成,中性粒细胞浸润。与IR组比较,DEX组和DY组神经元损伤较轻,见图 1。S组各时点运动神经元异常率为0,IR组、DEX组和DY组运动神经异常率明显升高,其中IR组>DY组>DEX组,组间比较差异均有统计学意义(P<0.05)。见表 2。
 |
| A:S组;B:IR组;C:DEX组;D:DY组 图 1 缺血再灌注后48 h各组大鼠脊髓病理学观察(HE ×400) |
| 组别 | 12 h | 24 h | 48 h | 72 h |
| S组 | 0±0 | 0±0 | 0±0 | 0±0 |
| IR组 | 62±2 | 65±2 | 69±3 | 65±2 |
| DEX组 | 49±3a | 47±2a | 53±3a | 51±3a |
| DY组 | 55±2ab | 53±2ab | 67±3ab | 67±3ab |
| a:P<0.05,与IR组比较;b: P<0.05,与DEX组比较 | ||||
TUNEL法检测细胞凋亡阳性细胞核为棕黄色,而正常细胞核显示蓝紫色。与S组比较,IR组、DEX组和DY组细胞凋亡率明显升高(P<0.01),其中凋亡率IR组>DY组>DEX组,差异有统计学意义(P<0.05)。各组细胞凋亡随缺血后时间逐渐升高,48 h达到凋亡高峰(图 2、3)。
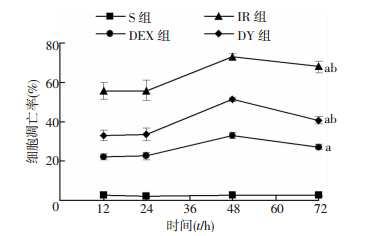 |
| a: P<0.01,与S组比较;b: P<0.05,与DEX组比较 图 2 各组大鼠缺血再灌注后不同时间点神经细胞凋亡率变化 |
 |
| A:S组;B:IR组;C:DEX组;D:DY组 图 3 TUNEL染色观察各组大鼠脊髓缺血再灌注48 h后变化(×400) |
Bax和Bcl-2免疫组化检测阳性细胞的细胞质呈棕黄色,正常细胞质不染色。各组大鼠各时间点脊髓细胞Bax和Bcl-2表达水平较S组均明显升高(P<0.01),其中Bax蛋白表达IR组>DY组>DEX组,Bcl-2蛋白表达DEX组>DY组>IR组,差异有统计学意义(P<0.05,图 4~7)。
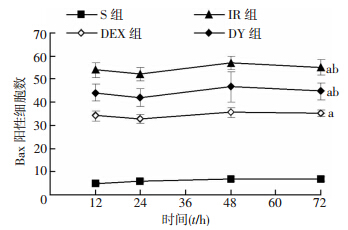 |
| a: P<0.01,与S组比较;b: P<0.05,与DEX组比较 图 4 各组缺血再灌注后不同时间点Bax阳性细胞数变化 |
 |
| A:S组;B:IR组;C:DEX组;D:DY组 图 5 免疫组化检测各组缺血再灌注后48 h脊髓Bax表达(×400) |
 |
| a:P<0.01,与S组比较;b:P<0.05,与DEX组比较 图 6 各组缺血再灌注后不同时间点Bcl-2阳性细胞数变化 |
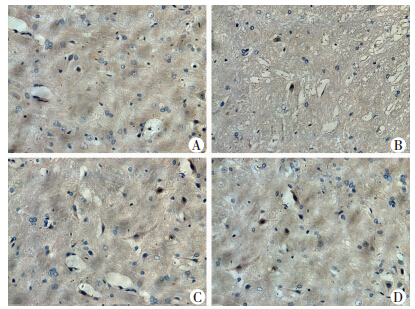 |
| A:S组;B:IR组;C:DEX组;D:DY组 图 7 免疫组化检测各组缺血再灌注48 h后脊髓Bcl-2表达(×400) |
通过Image J软件测定各条带灰度值,并计算出各Caspase3目标条带与β-actin内参条带灰度值比,与S组比较,IR组、DEX组和DY组各时点大鼠脊髓Caspase3蛋白表达均明显升高,于再灌注后48 h S组脊髓Caspase3灰度值比为5.7%,而DEX组为23.4%,DY组为64.8%,IR组为84.5%。见图 8。
 |
| 1:S组;2:DEX组;3:DY组;4:IR组 图 8 Western blot检测各组缺血再灌注后48 h脊髓 Caspase3表达 |
SCIRI是脊髓损伤后恢复的一个重要障碍,往往对神经细胞造成严重的损伤,是脊柱手术和动脉瘤等手术后患者严重致残和死亡的重要原因。本研究采用临床常用的首次负荷量加持续微量泵给药方式予以右美托咪定和育亨宾处理,并通过与外科动脉瘤手术相似的改良Zivin法阻断大鼠腹主动脉建立脊髓缺血再灌注损伤模型。
SCIRI病理生理过程复杂,主要包括细胞内Ca2+超载、自由基损伤、脂质过氧化反应、兴奋性氨基酸毒性、炎症反应、细胞凋亡[14]等,1998年Sakurai等[15]建立兔脊髓缺血15 min再灌注损伤模型,利用TUNEL染色发现脊髓前角运动神经元存在凋亡现象,推断细胞凋亡可能是SCIRI后引起运动神经元死亡并导致动物肢体瘫痪的重要原因,其危害可能甚至超过细胞坏死。因此,我们推测DEX对SCIRI的保护作用可能与抗细胞凋亡相关,并通过连续检测缺血再灌注损伤后4个时间点凋亡相关蛋白Caspase3、Bax和Bcl-2的表达变化来研究DEX对SCIRI的作用。其中Caspase3作为多种凋亡途径的共同作用点,是凋亡过程中的关键因子,是细胞凋亡的必经之路。Bcl-2家族蛋白对于线粒体通透性转换孔(mitochondria permeability transition pore,MPTP)的开放和关闭起关键的调节作用,促凋亡蛋白Bax可介导MPTP的开放,抗凋亡蛋白Bcl-2可阻止Bax介导MPTP的开放而发挥抗凋亡效应。MPTP开放会引起线粒体跨膜电位下降和细胞色素C(cytochrome C,CytC;apoptotic protease activating factor-2,Apaf-2)释放,释放到细胞质的CytC能引起Apaf-1多聚化而激活。Apaf-1具有激活Caspase3的作用,从而启动Caspase级联反应,最终导致细胞凋亡。本研究显示脊髓缺血再灌注损伤后各组脊髓促凋亡蛋白Bax和Caspase3表达均明显升高并于48 h达到高峰,脊髓神经细胞凋亡率也于48 h达高峰。与IR组比较,DEX组各时间点Bax和Caspase3表达低,Bcl-2表达高,神经细胞凋亡少,大鼠脊髓缺血再灌注损伤明显减轻。此外我们还发现DEX处理的同时给予α2受体阻滞剂育亨宾,脊髓神经细胞凋亡率升高,DEX的神经保护作用明显减弱,因此我们认为DEX也能直接通过激动α2受体[16],减少腺苷酸环化酶激活,增加磷酸化的黏着斑激酶(focal adhesion kinase,FAK)含量发挥神经保护作用[17],同时右美托咪定能增加脊髓缺血再灌注损伤后抗细胞凋亡蛋白Bcl-2表达,减少促细胞凋亡蛋白BAX和Caspase3表达。Bell等[8, 9]研究发现DEX对SCIRI神经保护作用也与其促进腺苷反应元件结合蛋白(cyclic AMP response-element binding protein,CREB)磷酸化有关,Zhu等[7]研究则认为DEX对大鼠脑缺血再灌注损伤的保护作用与其介导PI3K/Akt和ERK1/2信号通路有关。
综上所述,DEX对SCIRI的保护效应主要与其激动α2受体,并同时上调Bcl-2表达,下调Bax和Caspase3表达的抗凋亡作用有关。本研究初步探讨了 DEX对SCIRI的保护机制,并揭示了脊髓缺血再灌注损伤后神经细胞凋亡规律,为临床中脊髓缺血再灌注损伤防治使用DEX提供实验依据。另外,DEX对SCIRI的保护效应尚有其他机制参与,有待进一步研究。
| [1] | Rutkowska K, Knapik P, Msiolek H. The effect of dexmedetomidine sedation on brachial plexus block in patients with end-stage renal desease[J]. Eur J Anaesthesiol, 2009, 26(10): 851-855. |
| [2] | Tan J A, Ho K M. Use of dexmedetomidine as a sedative and analgesic agent in critically ill adult patients: a meta-analysis[J]. Intensive Care Med, 2010, 36(6): 926-939. |
| [3] | 李然, 许幸, 吴新民, 等. 右美托咪定对高血压患者全麻恢复期气管拔管反应的影响:多中心、随机、盲法、安慰剂对照临床研究[J]. 中华麻醉学杂志, 2013, 33(4): 397-401. |
| [4] | Sugita S, Okabe T, Sakamoto A. Continuous infusion of dexme- detomidine improves renal ischemia-reperfusion injury in rat kidney[J]. J Nippon Med Sch, 2013, 80(2): 131-139. |
| [5] | Kilic K, Hanci V, Selek S, et al. The effects of dexmedetomidine on mesenteric arterial occlusion-associated gut ischemia and reperfusion-induced gut and kidney injury in rabbits[J]. J Surg Res, 2012, 178(1): 223-232. |
| [6] | Hanci V, Erol B, Bektas S, et al. Effect of dexmedetomidine on testicular torsion/detorsion damage in rats[J]. Urol Int, 2010, 84(1): 105-111. |
| [7] | Zhu Y M, Wang C C, Chen L, et al. Both PI3K/Akt and ERK1/2 pathways participate in the protection by dexmedetomidine against transient focal cerebral ischemia/reperfusion injury in rats[J]. Brain Res, 2013, 1494: 1-8. |
| [8] | Bell M T, Puskas F, Smith P D, et al. Attenuation of spinal cord ischemia-reperfusion injury by specific α-2a receptor activation with dexmedetomidine[J]. J Vasc Surg, 2012, 56(5): 1398-1402. |
| [9] | Bell M T, Puskas F, Bennett D T, et al. Dexmedetomidine, an α-2a adrenergic agonist, promotes ischemic tolerance in a murine model of spinal cord ischemia-reperfusion[J]. J Thorac Cardiovasc Surg, 2014, 147(1): 500-506. |
| [10] | Zivin J A, DeGirolami U. Spinal cord infarction: a highly reproducible stroke model[J]. Stroke, 1980, 11(2): 200-202. |
| [11] | 曾小华, 刘丹彦, 安民. 胞二磷胆碱预处理对大鼠脊髓缺血再灌注损伤的影响[J]. 第三军医大学学报, 2011, 33(24): 2587-2591. |
| [12] | Basso D M, Beattie M S, Bresnahan J C. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995, 12(1): 1-21. |
| [13] | 方华, 王泉云, 李昌熙, 等. 脊髓分级缺血再灌注损伤模型的建立与病理学评价[J]. 四川动物, 2007, 26(3): 689-692. |
| [14] | Kiyoshima T, Fukuda S, Matsumoto M, et al. Lack of evidence for apoptosis as a cause of delayed onset paraplegia after spinal cord ischemia in rabbits[J]. Anesth Analg, 2003, 96(3): 839-846. |
| [15] | Sakurai M, Hayashi T, Abe K, et al. Delayed and selective motor neuron death after transient spinal cord ischemia: a role of apoptosis?[J]. J Thorac Cardiovasc Surg, 1998, 115(6): 1310-1315. |
| [16] | Schoeler M, Loetscher P D, Rossaint R, et al. Dexmedetomidine is neuroprotective in an in vitro model for traumatic brain injury[J]. BMC Neurol, 2012, 12: 20. |
| [17] | Dahmani S, Rouelle D, Gressens P, et al. Effects of dexmede- tomidine on hippocampal focal adhesion kinase tyrosine phosphorylation in physiologic and ischemic conditions[J]. Anesthesiology, 2005, 103(5): 969-977. |



