姜黄色素是从姜科姜黄属植物 (如姜黄 、郁金及莪术)根茎中提取的一种天然多酚类化合物[1]。研究表明,姜黄色素能穿过血脑屏障,在体内具有较高的生物活性[2],如抗炎、抗氧化、抗肿瘤以及抗菌等活性[3],最新的研究报道,姜黄色素还有一定的抗辐射功能[4]。此外,姜黄色素还可用于医药化妆品的着色及食品添加剂[5]。因此,对姜黄色素的性质及其在体内的代谢动力学吸引了研究人员和临床医生的广泛关注[6]。然而,姜黄色素却因其水溶解度低[7]、血浆半衰期短、生物利用度低、吸收差[8, 9]等缺点,一定程度上制约了姜黄色素的推广使用[10]。
姜黄色素主要包括姜黄素(curcumin)、去甲氧基姜黄素(demethoxycurcumin,DTI)、双去甲氧基姜黄素,这3种成分结构相似,具有多种相似的药理活性[5]。研究表明,将纳米技术与生物医药相结合,能够显著改善难溶性药物吸收差、半衰期短、生物利用度低等导致临床应用受限的问题[11]。近年来研究发现去甲氧基姜黄素降血脂的活性明显高于姜黄素[12],本实验将去甲 氧基姜黄素制备成去甲氧基姜黄素纳米乳(demetho-xycurcumin-nanoemulsion,DTNE)制剂,研究以DTNE为模型药物灌胃给药后在大鼠体内的动力学特征,旨在为新药剂型设计提供一定的理论基础和方法。 1 材料与方法 1.1 材料 1.1.1 仪器
DF-101S集热式恒温加热磁力搅拌器(巩义市于华仪器有限责任公司);KQ2200B型超声波清洁器(江苏昆山市超声仪器有限公司);TGL-16B台式高速离心机(上海安亭科学仪器厂);FA1004A电子天平(上海精天电子仪器有限公司);DZF-6020型真空干燥箱(上海博迅实业有限公司医疗设备厂);QL-901涡旋仪(海门市其林贝尔仪器制造有限公司);BCD-649WE冰箱(青岛海尔股份有限公司);LC-2010AHT高效液相色谱仪(日本岛津公司);激光粒度仪(英国Malvern公司)。 1.1.2 试药
姜黄色素(西安帅诺生物科技有限公司);去甲氧基姜黄素(纯度>99%,实验室自制);油酸乙酯(分析纯,上海化学试剂二厂);聚氧乙烯蓖麻油(EL-35,德国 BASF公司);聚乙二醇(PEG-400,分析纯,天津精细化工有限公司);维生 素E聚乙二醇琥珀酸酯(成都艾科试剂化学技术有限公司)。 1.1.3 实验动物
清洁级雄性SD大鼠,体质量(250±20)g,由重庆医科大学实验动物中心提供,实验前并未使用过其他药物。 1.2 方法 1.2.1 DTNE的制备
精密称取油酸乙酯、聚氧乙烯蓖麻油EL-35、聚乙二醇PEG-400及维生素E聚乙二醇琥珀酸酯于反应瓶中,恒温40 ℃搅拌溶解后,加入DTI 15 mg,待药物溶解后,加入水相,制备得澄清透明淡黄色纳米乳。 1.2.2 DTI 混悬液的制备
精密称取DTI 15.0 mg于干燥洁净的研钵中,研磨1.5 h后,称取研磨后的药物,加入适量无水乙醇作为润湿剂,然后再加入0.5%的CMC-Na 15 mL,超声混匀,制备淡黄色混悬液。 1.2.3 DTNE和DTI的粒径及Zeta电位的测定
取适量制备得到的DTNE和DTI,蒸馏水稀释一定倍数后,用激光粒径测定仪测定DTNE和DTI的粒径及Zeta电位。 1.2.4 DTNE和DTI体外释放行为的考察
用动态透析法考察DINE和DTI的体外释药,以0.1 mol/L HCl溶液(pH=1.2),pH6.8磷酸盐缓冲液分别模拟胃、肠道生理环境作为释放介质,并加入20%乙醇和0.5%SDS,释放介质体积为100 mL,取1 mL的DTNE和DTI置于透析袋中,密闭置于恒温水浴振荡器中,在37 ℃下,以100 r/min的速度搅拌。分别于1、2、4、6、8、10、12、24、48、72、96、120、144、168 h取出1 mL释放介质,同时补充等温等体积的释放介质。 1.2.5 给药方案及样品采集
用单剂量给药方案。雄性SD大鼠12只,不分大小,分为2组,每组6只。分别灌胃给予DTI和DTNE(均相当于给药量DTI 50 mg/kg),给药前禁食12 h,不禁水。分别在给药后5、10、15、30、45 min等眼底静脉采血于肝素浸润过的试管中,6 000 r/min离心10 min 后分离血浆于洁净的EP管中,放入-20 ℃冷冻,待高效液相法检测。 1.2.6 色谱条件
采用全紫外波长检测器;检测波长420 nm;流动相:乙腈 ∶5%冰醋酸= 43 ∶57;流速1 mL/min;色谱柱:大连伊利特LichrospherC18柱 (250 mm×4.6 mm,5 μm);柱温30 ℃;进样量20 μL。 1.2.7 血浆样品的处理方法
吸取血浆样品200 μL 于2 mL离心管,加入内标尼群地平(NT)工作 液,再加入乙酸乙酯,漩涡后,12 000 r/min离心10 min,转移上层有机相于另一离心管中,用氮气吹干仪吹干。最后用100 μL流动相复溶,取复溶液20 μL进样。 1.2.8 标准曲线的制备
分别精密称量DTI 10.0 mg 和NT 5.0 mg溶于甲醇溶液中,移至50 mL棕色容量瓶中定容,摇匀即得200 μg/mL DTI工作溶液和100 μg/mL NT内标工作溶液,于4 ℃冰箱中保存。临用时将吸取DTI工作溶液适量用甲醇稀释成浓度为0.5 μg/mL作为对照品溶液;取空白血浆200 μL于2 mL离心管中,分别加入适量的DTI(0.5 μg/mL) 对照品溶液配制成浓度为15、70、105、140、175、210、245 ng/mL系列浓度的DTI对照品溶液,再加入100 μL NT内标工作溶液。按照1.2.7方法操作后,得到标准曲线。 1.2.9 方法学考察 1.2.9.1 精密度试验
分别取高、中、低浓度 (210、140、70 ng/mL)加有DTI的血浆样品,按1.2.7 操作方法处理后,进样20 μL测定分析,每个浓度3次,连续测定5 d。 1.2.9.2 回收率试验
分别取浓度为210、140、70 ng/mL 加有DTI的血浆样品,按1.2.7操作方法处理后,进样20 μL测定分析,每个浓度测定3次,按标准曲线法计算血浆药物浓度,以所得浓度与实际浓度的比求平均回收率。 2 结果 2.1 粒径的测定
DTNE和DTI的平均粒径分别为36.91、1 288 nm,Zeta电位分别为-3.17、-59.1 mV。 2.2 DTNE和DTI体外释放行为结果 2.2.1 DTNE和DTI累积释放时间曲线
在相同pH释放介质中,DTNE释放速率比DTI快,相同时间点释药量较DTI多,说明DTNE比DTI溶解度大,有利 于药物的吸收;在不同pH释放介质中,DTNE和DTI释放曲线都无明显差异。DTNE和DTI释放曲线见图 1。
 |
| 图 1 DTNE和DTI在释放介质为pH 1.2及pH 6.8时体 外释放曲线(n=3) |
通过对DTNE和DTI体外释放进行模型拟合,拟合时以决定系数(r)最大的为最好拟合结果,使用的模型有零级释放模型、一级释放模型、Higuchi模型、Hixcon-Crowell模型、Ritger-Peppas模型、Weibull模型;DTNE以Weibull模型为最佳拟合结果,DTI以Weibull模型拟合结果较佳;拟合结果见表 1。
| 制剂 | 释放介质 | 0.1 mol/L HCl | pH 6.8 PBS |
| DTI | 零级动力学模型 | Q=0.248 4t+17.707,r=0.839 8 | Q=0.277 0t+ 21.480,r=0.846 8 |
| 一级动力学模型 | ln(1-Q)=-0.003 7t-0.201 5,r=0.880 1 | ln(1-Q)=-0.004 5t-0.249 8,r=0.888 0 | |
| Higuchi model | Q=0.177 7t1/2+2.077 2,r=0.776 7 | Q=4.227 1t1/2+10.765,r=0.930 3 | |
| Hixcon-克罗韦尔模型 | (100-Q)1/3=-0.024 84t+82.293,r=0.838 7 | (100-Q)1/3=-0.005 9t+4.274 3,r=0.875 7 | |
| Ritger-peppas模型 | lnQ=0.530 2lnt+1.550 1,r=0.921 1 | lnQ=0.497 3lnt+1.8410,r=0.905 5 | |
| Weibull模型 | lnln[1/1-Q]=0.598 5lnt-3.070 9,r=0.936 1 | lnln[1/1-Q]=0.578 7lnt-2.777,r=0.928 9 | |
| DTNE | 零级动力学模型 | Q=0.472 6t+16.522,r=0.865 0 | Q=0.461 3t+ 16.383,r=0.875 5 |
| 一级动力学模型 | ln(1-Q)=-0.009 5t-0.199 1,r=0.905 9 | ln(1-Q)=-0.009 1t-0.190 8,r=0.915 8 | |
| Higuchi模型 | Q=7.159 4t1/2-1.142 5,r=0.943 6 | Q=6.966 9t1/2-1.035 4,r=0.952 2 | |
| Hixcon-克罗韦尔模型 | (100-Q)1/3=-0.011 4t+4.352 0,r=0.893 7 | (100-Q)1/3=-0.011 1t+4.360 2,r=0.9038 | |
| Ritger-peppas模型 | lnQ=0.647 1lnt+1.351 5,r=0.9250 | lnQ=0.603 9lnt+1.520 0,r=0.944 0 | |
| Weibull模型 | lnln[1/1-Q]=0.833 0lnt-3.526 8,r=0.948 1 | lnln[1/1-Q]=0.781 2lnt-3.341 6,r=0.963 8 | |
| Q:累积释放率 | |||
f2相似因子法可以直观的比较体外释放行为相似性,由结果大小即可判断相似性大小。本实验采用了此方法对释放曲线的相似性进行比较,计算公式如下:
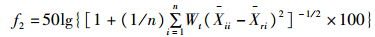
式中f2为相似因子Xii为t时间参比制剂的累积释放百分率,Xii为t时间时受试制剂累积释放百分率,n为有效取样点个数,Wt为权重,本实验设为1。当f2值介于0~50之间时,即可认为两条曲线有显著差异;介于>50~100之间时,即说明两条曲线为无显著差异;f2值越接近100,相似程度也就越高。将实验得到的释放曲线使用上述公式进行两两拟合,计算得到相似因子f2,结果见表 2。从表 2可以看出,在释放介质pH 1.2 HCl溶液中,DTNE和DTI的释放行为相比,存在显著差异,在释放介质pH6.8 PBS缓冲液中,DTNE和DTI也同样存在显著差异;而DTI在释放介质pH1.2 HCl溶液和pH6.8 PBS缓冲液中,其自身释放行为相比无显著差异,同样DTNE在释放介质pH1.2 HCl溶液和pH6.8 PBS缓冲液中,释放行为亦无显著差异。
| 释放曲线1 | 释放曲线2 | f2 | 差异 | ||
| 制剂 | 释放介质 | 制剂 | 释放介质 | ||
| DTI | pH 1.2 HCl溶液 | DTNE | pH 1.2 HCl溶液 | 36.86 | Yes |
| DTI | pH 6.8 PBS | DTNE | pH 6.8 PBS | 43.72 | Yes |
| DTI | pH 1.2 HCl溶液 | DTI | pH 6.8 PBS | 59.77 | No |
| DTNE | pH 1.2 HCl溶液 | DTNE | pH 6.8 PBS | 80.49 | No |
通过HPLC方法测定血浆中DTI的浓度方法进行了精密度试验的考察,测得其日内精密度 的RSD分别为1.66%、0.98%、1.24%(n=3);日间精密度的RSD分别为0.93%、1.55%、2.31%、1.68%、1.16%(n=5)。符合生物样品分析方法的测定要求。 2.3.2 回收率试验结果
本法测定血浆中DTI的浓度的平均回收率为99.42%。表明本测定方法回收率符合含量测定方法。 2.4 HPLC方法测定血浆中去甲氧基姜黄素的浓度
在选定的色谱条件下,取空白血浆、空白血浆+DTI+内标物、血浆样品溶液,参照1.2.7血浆样品的处理方法进行处理、进样,能达到有效的分离且峰形良好,具体色谱图见图 2,血浆中内源性物质在该色谱条件下对药物的测定无干扰,表明该方法能够用于DTI血药浓度的测定。
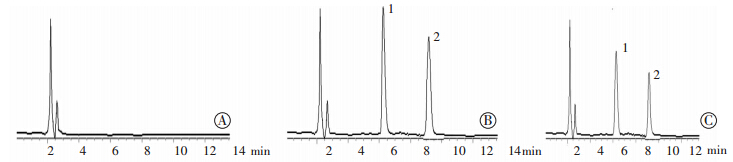 |
| 1:DTI;2:NT A:空白血浆;B:空白血浆+DTI+NT;C:血浆样品 图 2 HPLC色谱图 |
以DTI和内标峰面积比(Y)对DTI浓度(X)做线性回归,得回归方程如下:Y=0.012 9X+0.139 9(r=0.999 8),DTI浓度在15~245 ng/mL浓度范围内与DTI和内标的峰面积比呈良好线性关系。 2.6 药代动力学参数
实验数据使用DAS 2.1.1软件进行非室模型(统计矩)拟合,药-时曲线以及药动学参数见图 3、表 3。从表 3可以看出:①比较DTNE和DTI的AUC(0-∞),发现DTNE的AUC(0-∞)是DTI的4.08倍,说明DTNE的生物利用度是DTI的4.08倍;②DTNE的T1/2是DTI的4.72倍,说明在制备成纳米乳制剂后,DTNE在大鼠体内消除较慢,能长时间保持有效血药浓度;③DTNE的总清除率(CL)小于DTI混悬液,说明DTNE的消除慢,体内作用时间更长;④DTNE在小鼠体内的平均滞留时间(MRT)约为DTI的6倍,表明DTNE在小鼠体内滞留时间较长,能有效延长药物在体内的作用时间。
 |
| 图 3 大鼠口服灌胃给予DTNE和DTI后血药浓度-时间曲线(n=6) |
| 制剂 | Cmax(mg/L) | Tmax(h) | T1/2(h) | AUC(0-∞)(μg·h/L) | MRT(0-∞) (h) | CL[L/(h·kg)] | Vd(L/kg) |
| DTNE | 91.30±3.73 | 0.75 | 38.85±6.54 | 962.84±75.27 | 50.92±4.58 | 40.20±1.57 | 2250.99±360.07 |
| DTI | 76.09±3.83 | 0.50 | 8.23±2.92 | 235.62±11.29 | 8.46±2.61 | 193.03±20.18 | 2244.01±560.11 |
影响口服剂型起效的关键因素是它在消化道内的吸收程度与速度[8],从姜黄根茎中提取出来的姜黄色素难溶于水,且姜黄色素具有口服血药浓度低、生物利用度低[7, 8, 9]等特点,使其药理活性的发挥受到了很大的限制。
姜黄素因其极低的水溶性而使得其药理作用受到了很大程度的限制,为提高姜黄素的生物利用度、延长作用时间及在体内外药代动力学特性,近几年有大量学者对姜黄素的剂型进行改进研究,目前有文献报道的剂型有:固体分散体、脂质体、环糊精包合物、微乳、胶束、纳米粒、醇质体、微球、微囊、前体药物等[13]。钟荣玲等[10]通过将姜黄素制备成姜黄素纳米混悬剂后,制剂的AUC0-∞是游离药物的5.85倍,生物利用度明显提高,表明通过改善姜黄素的水溶性其生物利用有明显提高。
纳米乳是粒径在100 nm以下的乳滴分散在另一液体介质中形成的胶体溶液[14],将纳米乳作为脂溶性药物的基质,可显著提高药物的吸收与释放[15],进一步改善难溶性药物的生物利用度。
本实验主要考察了将DTI制备成DTNE后,经口服灌胃吸收后在SD大鼠体内的药代动力学性质。由药代动力学参数可知,相对于DTI,DTNE在大鼠体内的半衰期延长、血药浓度-时间曲线下面积(AUC)明显提高,说明纳米乳制剂能延缓DTI的吸收,明显提高药物浓度;显著增加生物利用度、延长体内作用时间,显示出良好的缓释效应[16]。由药代动力学参数可知,本实验制备得到的单体去甲氧基姜黄素纳米乳药代动力学参数AUC0-∞为(962.84±75.27) μg·h/L,相对陈曦等[17]姜黄素纳米脂质载体药代动力学研究结果AUC0-∞为(621.14±179.92) μg·h/L及郭曼曼等[18]通过将姜黄素制备成姜黄素PEG-PCL 纳米粒后,姜黄素PEG-PCL纳米粒AUC为(573.06±64.21) μg·h/L 而言,具有更高的曲线下面积,即具有更高的生物利用度。其可能原因为本课题以从姜黄素混合物中分离得到的DTI作为考察对象,而非姜黄素混合物。
DTNE在体外介质中释放速率比DTI快,而体内吸收较DTI慢,可能是因为如下原因:(1)体外释放介质和体内肠段以及胃部构造的差异。本实验按照2010版《中国药典》的规定[19]附录202,选用了2种释放介质:0.1 mol/L的HCl溶液(pH 1.2)模拟胃生理环境,pH 6.8的磷酸盐缓冲液模拟肠道生理环境。DTI为难溶性药物,在水中的溶解度极小,将DTI制备成DTNE后,其在体外介质中的溶解性增加,因此释放速率较大;而体外介质是模拟体内环境,但并不与体内环境一模一样,如不含体内胃肠道的酶,因此会存在一定程度上的差异;(2)按照2010版《中国药典》的规定[19] 附录203,药物体外释放和体内吸收间的体内外相关水平分为3个层次:①体外释放曲线与体内吸收曲线可重叠的最高水平相关;②应用统计矩阵分析原理建立体外释放的平均时间与体内平均滞留时间的相关;③释放时间点与药动学参数之间的单点相关,这种相关的程度是最低的;而本实验只是部分参数呈体内外部分相关,相关性较低,因此会存在体外释放快而体内吸收较慢的情况。
通过将DTI制备成DTNE后具有更好的生物利用度和临床应用前景,旨在为临床新药剂型的研究奠定理论基础。
| [1] | 谌贻璞. 应关注姜黄素在肾脏病防治上的应用前景[J]. 中国中西医结合肾病杂志, 2014, 15(1): 5-6. |
| [2] | Zhu H T, Bian C, Yuan J C, et al. Curcumin attenuates acute inflammatory injury by inhibiting the TLR4/MyD88/NF-κB signaling pathway in experimental traumatic brain injury[J]. J Neuroinflammation. 2014, 11: 59. |
| [3] | Wongeakin N, Bhattarakosol P, Patumraj S. Molecular mechanisms of curcumin on diabetes-induced endothelial dysfunctions: Txnip, ICAM-1, and NOX2 expressions[J]. Biomed Res Int, 2014, 2014: 161346. |
| [4] | Xie Y, Zhao Q Y, Li H Y, et al. Curcumin ameliorates cognitive deficits heavy ion irradiation-induced learning and memory deficits through enhancing of Nrf2 antioxidant signaling pathways[J]. Pharmacol Biochem Behav, 2014, 126: 181-186. |
| [5] | 赵欣, 王爱里, 袁园, 等. 姜黄中姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素的光稳定性分析[J]. 中草药, 2013, 44(10): 1338-1341. |
| [6] | Glombik K, Basta-Kaim A, Sikora-Polaczek M, et al. Curcumin influences semen quality parameters and reverses the di(2-ethylhexyl)phthalate (DEHP)-induced testicular damage in mice[J]. Pharmacol Rep, 2014, 66(5): 782-787. |
| [7] | Tan Q, Wu J, Li Y, et al. A supermolecular curcumin for enhanced antiproliferative and proapoptotic activities: molecular characteristics, computer modeling and in vivo pharmacokinetics[J]. Nanotechnology, 2013, 24(3): 035102. |
| [8] | 曾晓会, 陈玉兴, 赵自明, 等. 姜黄素微囊在大鼠体内的药代动力学研究[J]. 中国实验方剂学杂志, 2010, 16(2): 107-110. |
| [9] | 张立康, 汪小珍, 李婉姝, 等. 姜黄素在大鼠体内药代动力学和生物利用度研究[J]. 中国药理学通报, 2011, 27(10): 1458-1462. |
| [10] | 钟荣玲, 夏智, 武洁, 等. 姜黄素纳米混悬剂在大鼠体内药代动力学考察[J]. 中国实验方剂学杂志, 2013, 19(20): 137-139. |
| [11] | 杨鹏飞, 陈卫东. 纳米乳提高难溶性药物生物利用度的研究进展[J]. 中国药学杂志, 2013, 48(15): 1238-1244. |
| [12] | 杨梅, 胡雪原, 孙立力, 等. HPLC法测去甲氧基姜黄素纳米脂质载体中药物的含量[J]. 激光杂志, 2014, 35(1): 56-57. |
| [13] | 邬随焕, 王云山. 姜黄素研究进展[J]. 数理医药学杂志, 2013, 26(3): 359-360. |
| [14] | 戴伟, 刘新义, 李健和,等. 新型给药系统阳离子型纳米乳的研究进展[J]. 中国药学杂志, 2013, 48(23): 1980-1984. |
| [15] | 阮婧华, 龚涛, 张志荣, 等. 吲哚美辛纳米乳透皮制剂的制备及体外实验评价[J]. 华西药学杂志, 2013, 28(1): 19-22. |
| [16] | 王桐生, 吴金爽, 俞年军, 等. 亳菊总黄酮及其纳米乳制剂在大鼠体内的药动学比较[J]. 中国医院药学杂志, 2014, 34(3): 163-167. |
| [17] | 陈曦, 肖衍宇, 陈祎楠, 等. 姜黄素纳米脂质载体的制备及大鼠体内药代动力学[J]. 中国药科大学学报, 2012, 43(5): 412-417. |
| [18] | 郭曼曼, 管佳妮, 王国伟,等. 姜黄素PEG-PCL纳米粒的制备及药动学和体外抑瘤作用研究[C]//抗肿瘤药物研究新进展与肿瘤个性化药物治疗论坛论文集, 杭州: 浙江省抗癌协会, 2013. |
| [19] | 国家药典委员会. 中国药典2010年版二部[M]. 北京: 中国医药科技出版社, 2010. |



